2. 南京大学功能生物分子研究所, 江苏 南京 210046
2. Institute of Functional Biomolecules, Nanjing University, Nanjing 210046, China
从天然产物中筛选生物活性成分或先导化合物是研究创新药物的有效途径之一。因微生物资源的可再生性,越来越多的科研人员将目光转向微生物次生代谢物,尤其是特境微生物,如海洋微生物、植物内生菌和昆虫共生菌等的次生代谢物[1]。植物内生菌是一种种类繁多而研究甚少的微生物,通过共生方式,它们能在其生活史的一定阶段或全部阶段生活于正常植物组织内。植物内生菌既能产生和宿主植物相同或相似的活性成分[2],也能产生与宿主植物不同的生物活性成分[3]。植物内生菌广泛存在于植物体内,目前研究较多的是来源于特殊生境植物和药用植物的内生菌。
南京大学功能生物分子研究所从药用植物山麻黄Ephedra equisetina Bge. 中分离获得1株内生真菌Myrothecium roridum(菌株编号LLY),本实验对该菌株固体发酵产物粗浸膏的化学成分进行研究,以期发现新颖、强抗肿瘤活性的化合物。通过研究,分离纯化获得9个化合物,分别鉴定为吩嗪- 1-羧酸(1-phenazinecarboxylic acid,1)、1-甲氧基吩嗪(1-methoxyphenazine,2)、N-methyl-1H-indole- 2-carboxamaide(3)、甲基硫赭曲菌素(monomethyl- sulochrin,4)、ditryptophenaline(5)、7,8-二甲基异咯嗪(lumichrome,6)、deoxyleporin B(7)、尿嘧啶(uracil,8)和胸腺嘧啶(thymine,9),结构见图 1。其中化合物7为新的天然产物。体外细胞毒活性测定表明,化合物3对人肝癌细胞株SMMC-7721增殖具有一定的抑制活性。对化合物3进行了初步的作用机制研究,结果发现,化合物3能诱导SMMC-7721细胞凋亡,其增殖抑制作用与S期细胞周期阻滞相关,并受到p27蛋白的调控。
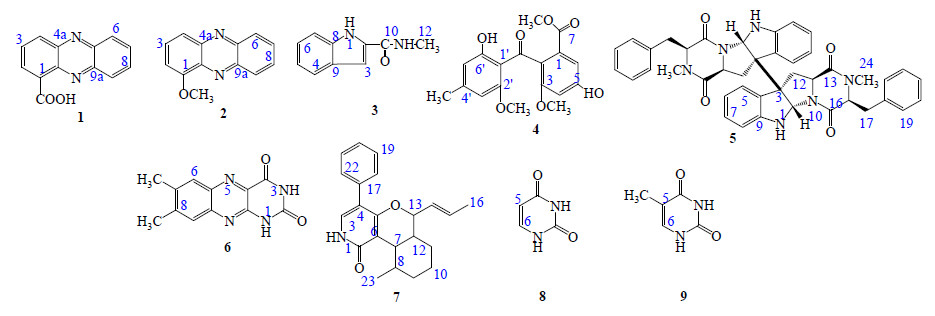 | 图 1 化合物1~9的结构Fig.1 Structures of compounds 1—9 |
AVANCE 600型核磁共振仪;maXis 超高分辨飞行时间质谱仪;Hitachi U-3900紫外分光光度计;Eppendorf 722型紫外分光光度计;Agilent 1260高效液相色谱仪;P200Ⅱ高效液相色谱仪;Sinochrom ODS-AP色谱柱(250 mm×4.6 mm,5 μm);Thermo Series IICO2细胞培养箱;Eppendorf 5475R超速低温离心机;SW-CJ-1F超净工作台;Bio-Tek ELX800多功能酶标仪;QILINBEIER摇床;Eppendorf centrifuge 5415D离心机;BD FACSCalibur流式细胞仪;Bio-Rad JY-ZY5Western blot电泳仪等。
人肝癌细胞株SMMC-7721,由本实验室保存;柱色谱硅胶(200~300目),青岛海洋化工厂分厂;薄层色谱硅胶(GF254),青岛海浪硅胶干燥厂;Sephadex LH-20,瑞典Pharmacia Biotech;色谱纯甲醇,TEDIA公司;氘代三氯甲烷和二甲基亚砜(DMSO),Aldrich公司;氘代甲醇,Cambridge Isotope Laboratories;RPMI 1640培养基,GIBCO公司;胰蛋白酶,Solarbio公司;新生牛血清,上海洛神生物技术有限公司;四甲基偶氮唑盐(MTT)和DMSO,Amresco公司;顺铂,江苏豪森药业股份有限公司;碘化丙锭(PI),上海江莱生物有限公司;兔抗人p27、Cleaved-PARP单克隆抗体,Cell Signaling公司;羊抗人-actin单克隆抗体,Santa Cruz公司;山羊抗兔IgG抗体,北京博士德公司;脱脂奶粉,北京普利莱公司;蛋白质Marker,Ferments公司;Kodak X-感光片,柯达公司;ECL化学发光试剂,北京普利莱公司;显影粉、定影粉,天津市世纪奥博商贸有限公司;其余试剂均为分析纯。
菌株LLY是从海南山麻黄茎中分离得到的一株内生真菌,南京大学宋勇春博士根据其形态特征鉴定为Myrothecium roridum,该菌株现保存在南京大学功能生物分子研究所。
2 方法 2.1 固体发酵产物的提取与分离M. roridum LLY采用固体发酵法[4]进行发酵。固体发酵产物粉碎、晒干后,采用三氯甲烷-甲醇混合溶剂浸提3次(3×10 L),减压去除溶剂得粗浸膏52 g。粗浸膏经硅胶柱色谱进行粗分,三氯甲烷-甲醇(100∶0、100∶1、100∶2、100∶4、100∶8、100∶16、0∶100)梯度洗脱得到7个组分Fr. 1~7。
Fr. 1(2.0 g)经硅胶柱色谱,石油醚-丙酮梯度洗脱,得到组分Fr. 1-3和Fr. 1-4。Fr. 1-3经Sephadex LH-20凝胶柱色谱(三氯甲烷-甲醇1∶1)及HPLC进一步纯化得到0.6 mg化合物1(甲醇-水42∶58;1.0 mL/min)和0.6 mg化合物2(甲醇-水5∶5,1.0 mL/min)。Fr. 1-4经硅胶柱色谱(石油醚-丙酮梯度洗脱)分离、再经Sephadex LH-20凝胶柱色谱(三氯甲烷-甲醇1∶1)分离得到Fr. 1-4-2-2;Fr. 1-4-2-2经HPLC(甲醇-水72∶28,0.8 mL/min)进一步纯化得到化合物7(0.7 mg)。Fr. 2(6.8 g)经硅胶柱色谱(石油醚-丙酮梯度)得到的组分Fr. 2-3,经2次Sephadex LH-20凝胶柱色谱(三氯甲烷-甲醇1∶1)分离得到Fr. 2-3-3-1和Fr. 2-3-3-2。Fr. 2-3-3-1经硅胶(三氯甲烷-甲醇梯度洗脱)、Sephadex LH-20凝胶(三氯甲烷-甲醇1∶1)等柱色谱及HPLC进一步分离纯化得到化合物4(甲醇-水7∶3,1.0 mL/min,7.9 mg)和5(甲醇-水6∶4,0.8 mL/min,2.7 mg)。Fr. 2-3-3-2经HPLC纯化得到13 mg化合物3(甲醇-水5∶5,0.8 mL/min)。Fr. 3(2.0 g)经硅胶柱色谱得到组分Fr. 3-3,经HPLC分离纯化(甲醇-水3∶7,1.0 mL/min)得到化合物6(2.3 mg)。Fr. 4(2.3 g)经硅胶柱色谱,三氯甲烷-甲醇梯度洗脱,得到的组分Fr. 4-4,再经HPLC分离纯化(甲醇-水2∶8,1.0 mL/min)得到化合物8(11.8 mg)和9(16.8 mg)。
2.2 MTT法检测化合物体外细胞毒活性SMMC-7721细胞株在含10%新生牛血清的RPMI 1640培养液中,于37 ℃、5% CO2的CO2培养箱内培养至对数生长期。收集对数生长期的SMMC-7721细胞,以1×104个细胞/孔接种于96孔板,常规贴壁培养24 h后,实验组分别加入2 μL待测化合物(少量DMSO助溶,DMSO终浓度0.2%),阴性对照组和空白组分别加入等体积DMSO和培养液。培养48 h后,每孔加入20 μL MTT,继续培育4 h。然后弃去培养液,每孔滴加150 μL DMSO,37 ℃振荡10 min,使结晶充分溶解,酶标仪在波长490 nm处测定各孔吸光度值。计算IC50值。
2.3 流式细胞术检测细胞周期取对数生长期肿瘤细胞接种在6孔板中,在37 ℃、5% CO2培养箱内培养12 h。然后每孔分别加入等量的不同质量浓度(0.01、0.1、1、2、10 μg/mL)化合物,干预24 h。收集细胞,用预冷的70%乙醇固定细胞,4 ℃保存过夜,至少固定18 h。上机测试前,2 400 r/min离心10 min除去乙醇,将细胞重悬于0.4 mL碘化丙锭染液中(其中含RNaseA),37 ℃保温30 min(碘化丙锭染液终浓度为50 μg/mL,RNaseA终质量浓度为20 μg/mL),然后用400目网筛滤过。最后,进行流式分析,应用ModFit LT3.0软件分析细胞周期中各期细胞所占总细胞的百分率。
2.4 Western blotting法检测蛋白表达分组与给药同“2.3”项。取加药处理后的细胞,弃去培养液,以预冷的PBS洗涤2次,加入相应体积的1×SDS蛋白裂解液,冰上放置30 min。以刮棒刮下细胞,沸水浴10 min,然后4 ℃,12 000 r/min离心10 min。取上清,用改良Lowry法进行蛋白定量。调整样品蛋白质浓度使其相等,保证每个样品孔蛋白上样量一致。蛋白质经SDS-PAGE后,转移至PVDF膜上。PVDF膜以5%脱脂奶粉封闭4 h后,加入一抗过夜。经洗涤后,再加入辣根过氧化酶标记的二抗,室温下反应3~4 h。每步反应结束均用PBST洗涤3次,每次10 min。最后用ECL化学发光,经曝光、显影、定影后,胶片晾干保存,扫描后用Image J软件进行图像定量分析。
2.5 统计分析方法应用 SPSS17.0进行单因素方差分析,组间差异用SNK法比较,P<0.05为差异有显著性。
3 结果 3.1 结构鉴定化合物1:淡黄色针状结晶(三氯甲烷-甲醇),分子式C13H8N2O2,HR-ESI-MS: m/z 225.065 5 [M+H]+, 247.047 5 [M+Na]+(C13H8N2O2Na,计算值247.048 3), 471.106 [2M+Na]+。1H-NMR (600 MHz, DMSO-d6) δ: 8.21 (2H, m, H-6, 9), 7.99 (1H, dd, J = 8.4, 1.2 Hz, H-2), 7.92 (2H, m, H-7, 8), 7.81 (1H, dd, J = 9.0, 6.6 Hz, H-3), 7.55 (1H, dd, J = 6.6, 1.2 Hz, H-4)。以上数据与文献报道基本一致[5],故鉴定化合物1为吩嗪-1-羧酸。
化合物2:淡黄色针状结晶(三氯甲烷-甲醇),分子式C13H10N2O,HR-ESI-MS m/z: 211.086 1 [M+H]+(C13H11N2O,计算值211.087 1), 233.068 1 [M+Na]+, 443.148 3 [2M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 8.42 (1H, d, J = 8.4 Hz, H-9), 8.25 (1H, d, J = 8.4 Hz, H-6), 7.85 (3H, m, H-4, 7, 8), 7.77 (1H, t, J = 8.4 Hz, H-3), 7.10 (1H, d, J = 7.2 Hz, H-2), 4.20 (3H, s, 1-OCH3);13C-NMR (150 MHz, CDCl3) δ: 155.3 (C-1), 144.4 (C-4a), 143.6 (C-5a), 142.3 (C-9a), 137.0 (C-10a), 130.9 (C-7), 130.6 (C-3), 130.3 (C-8), 130.2 (C-9), 129.4 (C-6), 121.6 (C-4), 106.5 (C-2), 56.6 (1-OCH3)。以上数据与文献报道基本一致[6, 7],故鉴定化合物2为1-甲氧基吩嗪。
化合物3:白色针状结晶(甲醇),分子式C10H10N2O。HR-ESI-MS m/z: 175.086 8 [M+H]+(C10H11N2O,计算值175.087 1), 197.068 6 [M+Na]+, 371.148 7 [2M+Na]+。1H-NMR (600 MHz, CD3OD) δ: 7.55 (1H, d, J = 7.8 Hz, H-4), 7.40 (1H, d, J = 7.8 Hz, H-7), 7.17 (1H, t, J = 7.2 Hz, H-6), 7.02 (1H, t, J = 7.2 Hz, H-5), 6.97 (1H, s, H-3), 2.90 (3H, s, H-12);13C-NMR (150 MHz, CD3OD) δ: 164.1 (C-10), 137.5 (C-8), 131.5 (C-2), 128.3 (C-9), 124.2 (C-6), 121.9 (C-4), 120.4 (C-5), 112.3 (C-7), 103.8 (C-3), 25.7 (C-12)。以上数据与文献报道基本一致[8],故鉴定化合物3为N-methyl-1H-indole-2-carboxamaide。
化合物4:白色粉末,分子式C18H18O7。HR-ESI- MS m/z: 369.094 9 [M+Na]+(C18H18O7Na,计算值369.090 5), 715.199 1 [2M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 12.99 (1H, s, 2′-OH), 7.03 (1H, d, J = 1.8 Hz, H-6), 6.62 (1H, d, J = 1.8 Hz, H-4), 6.46 (1H, s, H-3′), 6.06 (1H, s, H-5′), 3.71 (3H, s, 3-OCH3), 3.69 (3H, s, 7-OCH3), 3.37 (3H, s, 6′-OCH3), 2.29 (3H, s, 4′-CH3)。以上数据与文献报道基本一致[9],故鉴定化合物4为甲基硫赭曲菌素。
化合物5:淡黄色粉末,分子式C42H40N6O4。HR-ESI-MS m/z: 693.317 8 [M+H]+, 715.299 9 [M+Na]+(C42H40N6O4Na,计算值715.300 9), 731.273 9 [M+K]+。1H-NMR (600 MHz, CD3OD) δ: 7.61 (4H, t, J = 7.2 Hz, H-20, 20′, 22, 22′), 7.54 (2H, t, J = 7.2 Hz, H-21, 21′), 7.22 (4H, d, J = 7.8 Hz, H-19, 19′, 23, 23′), 7.09 (2H, t, J = 7.8 Hz, H-7, 7′), 7.02 (2H, d, J = 7.8 Hz, H-5, 5′), 6.71 (2H, t, J = 7.8 Hz, H-6, 6′), 6.62 (2H, d, J = 7.8 Hz, H-8, 8′), 5.07 (2H, s, H-2, 2′), 4.45 (2H, brs, H-15, 15′), 3.70 (2H, dd, J = 10.8, 4.8 Hz, H-11, 11′), 3.55 (2H, d, J = 13.8 Hz, H-17a, 17′a), 3.36 (2H, overlapped, H-17b, 17′b), 3.09 (6H, s, H-24, 24′), 1.95 (2H, dd, J = 12.0, 4.8 Hz, H-12a, 12′a), 1.53 (2H, t, J = 12.0 Hz, H-12b, 12′b);13C-NMR (150 MHz, CD3OD) δ: 167.7 (C-13, 13′), 165.6 (C-16, 16′), 152.7 (C-9, 9′), 136.1 (C-18, 18′), 130.7 (C-7, 7′), 130.51 (C-20, 20′, 22, 22′), 130.49 (C-19, 19′, 23, 23′), 129.2 (C-21, 21′), 127.8 (C-4, 4′), 126.5 (C-5, 5′), 119.2 (C-6, 6′), 110.3 (C-8, 8′), 79.9 (C-2, 2′), 64.4 (C-15, 15′), 60.5 (C-3, 3′), 59.7 (C-11, 11′), 37.5 (C-12, 12′), 37.0 (C-17, 17′), 33.2 (C-24, 24′)。以上数据与文献报道基本一致[10, 11, 12],故鉴定化合物5为ditryptophenaline。
化合物6:淡黄色粉末,分子式C12H10N4O2。HR-ESI-MS m/z: 265.069 [M+Na]+(C12H10N4O2Na,计算值265.070 1)和507.150 1 [2M+Na]+。1H-NMR (600 MHz, DMSO-d6) δ: 11.84 (1H, s, 3-NH), 11.67 (1H, s, 1-NH), 7.92 (1H, s, H-9), 7.71 (1H, s, H-6), 2.49 (3H, s, 7-CH3), 2.47 (3H, s, 8-CH3)。以上数据与文献报道基本一致[13],故鉴定化合物6为7,8-二甲基异咯嗪。
化合物7:白色粉末,分子式为C22H25NO2。HR-ESI-MS: m/z 336.195 6 [M+H]+(C22H26NO2,计算值336.196 4), 358.177 5 [M+Na]+。1H-NMR (600 MHz, CDCl3) δ: 11.22 (H, s, 2-NH), 7.41 (2H, d, J = 7.2 Hz, H-18, 22), 7.36 (2H, t, J = 7.8 Hz, H-19, 21), 7.31 (1H, t, J = 7.2 Hz, H-20), 7.16 (1H, s, H-3), 5.74 (1H, m, H-15), 5.38 (1H, m, H-14), 4.85 (1H, dd, J = 11.4, 8.4 Hz, H-13), 2.78 (1H, dd, J = 10.8, 3.6 Hz, H-7), 1.79~1.76 (3H, m, H-12, 11, 9), 1.73 (3H, dd, J = 6.0, 0.6 Hz, H-16), 1.61 (2H, m, H-8, 11), 1.54 (1H, m, H-10), 1.42 (1H, m, H-10), 1.29 (1H, m, H-9), 1.01 (3H, d, J = 6.0 Hz, H-23);13C-NMR (150 MHz, CDCl3) δ: 164.4 (C-1), 160.3 (C-5), 134.4 (C-17), 131.0 (C-3), 130.8 (C-15), 129.5 (C-14), 129.1 (C-18, 22), 128.1 (C-19, 21), 127.0 (C-20), 115.2 (C-6), 111.6 (C-4), 78.1 (C-13), 37.1 (C-7), 36.0 (C-12), 35.9 (C-8), 35.2 (C-9), 26.5 (C-11), 20.9 (C-10), 20.5 (C-23), 17.8 (C-16)。以上数据与文献报道基本一致[14, 15],故鉴定化合物7为deoxyleporin B。
化合物8:白色粉末,分子式为C4H4N2O2。HR-ESI-MS m/z: 113.036 8 [M+H]+, 135.018 0 [M+Na]+(C4H4N2O2Na,计算值135.017 0)和247.042 2 [2M+Na]+。1H-NMR (600 MHz, CD3OD) δ: 7.39 (IH, d, J = 7.8 Hz, H-6), 5.62 (1H, d, J = 7.8 Hz, H-5)。以上数据与文献报道基本一致[16],故鉴定化合物8为尿嘧啶。
化合物9:白色粉末,分子式为C5H6N2O2。HR-ESI-MS m/z: 127.050 6 [M+H]+, 149.032 [M+Na]+(C5H6N2O2Na,计算值149.032 7)和275.074 8 [2M+Na]+。1H-NMR (600 MHz, DMSO-d6) δ: 11.0 (1H, s, H-3), 10.6 (1H, s, H-1), 7.25 (1H, s, H-6), 1.72 (3H, s, 5-CH3);13C-NMR (150 MHz, CD3OD) δ: 167.5 (C-4), 153.8 (C-2), 139.2 (C-6), 110.5 (C-5), 12.2 (5-CH3)。以上数据与文献报道基本一致[16],故鉴定化合物9为胸腺嘧啶。
3.2 化合物的体外细胞毒活性采用MTT法对化合物进行体外细胞毒活性测定,结果发现,化合物3对人肝癌细胞株SMMC-7721具有较强的细胞毒活性,其IC50值为38.0 μg/mL,阳性对照顺铂的IC50值为11.5 μg/mL。
3.3 化合物3对SMMC-7721细胞的细胞周期的影响细胞增殖受细胞周期的精密调控,为探讨化合物3对SMMC-7721细胞的增殖抑制作用是否与细胞周期阻滞相关,采用一定质量浓度(0.01、0.1、1、2和10 μg/mL)的化合物3处理SMMC-7721细胞24 h,然后收集细胞,经乙醇固定、PI染色,然后进行细胞周期分析。结果发现,化合物3干预后,SMMC-7721细胞的S期细胞比例由阴性对照(NC)的24.33%分别增加至27.35%、25.33%、25.88%、26.77%和28.93%。这表明化合物3可导致SMMC-7721细胞的S期细胞增多,即S期细胞周期阻滞,但该阻滞作用较弱(图 2)。
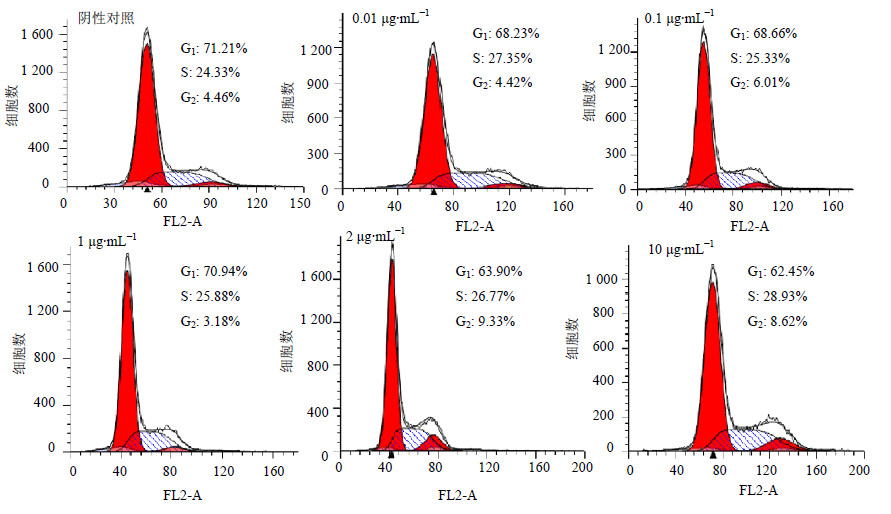 | 图 2 化合物3对SMMC-7721细胞周期的影响Fig.2 Effect of compound 3 on cell cycle of SMMC-7721 cells |
细胞增殖受细胞周期的精密调控,而p27是一种重要的细胞周期负调控蛋白[17]。为探讨化合物3诱导SMMC-7721细胞周期阻滞机制,本实验采用一定浓度(0.01、0.1、1、2和10 μg/mL)的化合物3处理SMMC-7721细胞,24 h后收集细胞蛋白,采用Western blotting分析p27蛋白的量,以未加药孔蛋白作阴性对照,β-actin为内参。结果发现,化合物3处理后,SMMC-7721细胞中p27蛋白表达均明显增加,分别为阴性对照的1.10、1.16、1.27、1.22和1.24倍(图 3),这提示化合物3可能通过上调p27蛋白的表达而诱导SMMC-7721细胞的S期阻滞。
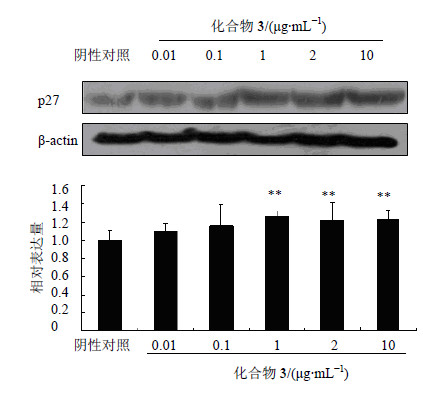 |
与阴性对照比较:*P<0.05 **P<0.01 *P < 0.05 **P < 0.01 vs negative control 图 3 化合物3对SMMC-7721细胞中p27蛋白表达的影响Fig.3 Effectof compound 3 on expression of protein p27 in SMMC-7721 cells |
研究表明,细胞凋亡对细胞的增殖有负调控作用。裂解的PARP通常作为凋亡的标志,因此,通过检测裂解的PARP蛋白是否被活化,可以确定化合物是否具有诱导肿瘤细胞凋亡作用。采用一定浓度(0.01、0.1、1、2和10 μg/mL)的化合物3处理SMMC-7721细胞,24 h后收集细胞蛋白,用Western blotting分析Cleaved-PARP蛋白的表达。结果发现,化合物3作用后SMMC-7721细胞的Cleaved-PARP蛋白被明显活化,说明化合物3可以诱导SMMC- 7721细胞凋亡(图 4)。
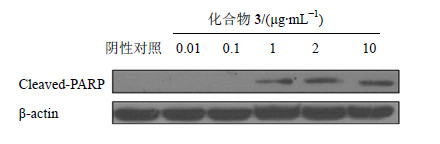 | 图 4 化合物3对SMMC-7721细胞中Cleaved-PARP的影响Fig.4 Effect of compound 3 on Cleaved-PARP in SMMC-7721 cells |
植物内生菌广泛存在于植物体内,与宿主植物互惠共生、协同进化,其次生代谢产物具有结构多样性和生物学功能多样性的特点[1],能够成为新药先导化合物的重要来源。本研究从山麻黄内生真菌M. roridum LLY固体发酵产物中分离获得8个生物碱和1个二苯酮化合物,其中化合物7为新的天然产物。文献表明,化合物1具有较强的抗蜡样芽胞杆菌Bacillus cereus活性(MICs<0.5 μg/mL)[5];化合物4具有较强的抗幽门螺旋杆菌Helicobacter pylori的活性(MICs=10 μg/mL)[9];化合物5是一种神经递质抑制剂[18]。本实验采用MTT法测定了化合物的体外细胞毒活性,结果表明,化合物3对SMMC-7721细胞具有较强的细胞毒活性(IC50值为38.0 μg/mL)。进一步细胞周期分析发现,化合物3可导致SMMC-7721细胞S期阻滞;Western blotting分析发现,化合物3作用后,SMMC-7721细胞中p27蛋白的表达上调,并且Cleaved-PARP蛋白被明显活化。这说明,化合物3能诱导SMMC-7721细胞凋亡;其对SMMC-7721细胞增殖的抑制作用与S期细胞周期阻滞相关,并受到p27蛋白的调控,其作用机制有待进一步深入研究。上述研究表明,山麻黄内生真菌M. roridum LLY固体发酵代谢产物具有丰富的结构多样性和药理活性多样性,能够为进一步药理活性研究提供化合物来源。
| [1] | 戈惠明, 谭仁祥. 共生菌--新活性天然产物的重要来源 [J]. 化学进展, 2009, 21(1): 30-46. |
| [2] | Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanea, an endophytic fungus of Pacific yew [J]. Science, 1993, 260(5105): 214-216. |
| [3] | 张玲琪, 王海昆, 邵 华, 等. 美登木内生真菌产抗癌物质球毛壳甲素的分离及鉴定 [J]. 中国药学杂志, 2002, 37(3): 172-175. |
| [4] | Shen L, Jiao R H, Ye Y H, et al. Absolute configuration of new cytotoxic and other bioactive trichothecene macrolides [J]. Chem Eur J, 2006, 12(21): 5596-5602. |
| [5] | Jayatilake G S, Thornton M P, Leonard A C, et al. Metabolites from an antarctic sponge-associated bacterium, Pseudomonas Aeruginosa [J]. J Nat Prod, 1996, 59(3): 293-296. |
| [6] | Conda-Sheridan M, Marler L, Park E J, et al. Potential chemopreventive agents based on the structure of the lead compound 2-bromo-1-hydroxyphenazine, isolated from Streptomyces species, strain CNS284 [J]. J Med Chem, 2010, 53(24): 8688-8699. |
| [7] | Breitmaier E, Hollstein U. Carbon-13 nuclear magnetic resonance chemical shifts of substituted phenazines [J]. J Org Chem, 1976, 41(12): 2014-2018. |
| [8] | Manriquez V, Galdamez A, Vellz B, et al. N-methyl-1H-indole-2-carboxamine from the marine fungus Cladosporium cladosporioides [J]. J Chilean Chem Soc, 2009, 54(3): 314-316. |
| [9] | Ma Y M, Li Y, Liu J Y, et al. Anti-Helicobacter pylori metabolites from Rhizoctonia sp. Cy064, an endophytic fungus in Cynodon dactylon [J]. Fitoterapia, 2004, 75(5): 451-456. |
| [10] | Movassaghi M, Schmidt M A, Ashenhurst J A. Concise total synthesis of (+)-WIN 64821 and (-)-ditryptophenaline [J]. Angew Chemie, 2008, 47(8): 1485-1487. |
| [11] | Lin A Q, Du L, Fang Y C, et al. Iso-α-cyclopiazonic acid, a new natural product isolated from the marine-derived fungus Aspergillus flavus C-F-3 [J]. Chem Nat Compd, 2009, 45(5): 677-680. |
| [12] | Maes C M, Potgieter M, Steyn P S. NMR assignments, conformation, and absolute configuration of ditryptophenaline and model dioxopiperazines [J]. J Chem Soc Perkin Trans I, 1986: 861-866. |
| [13] | 杨立宏, 金向群, 张 薇. 中华大蟾蜍皮化学成分研究 [J]. 沈阳药科大学学报, 2000, 17(4): 292-295. |
| [14] | Snider B B, Lu Q. Total synthesis of (±)-leporin A [J]. J Org Chem, 1996, 61(8): 2839-2844. |
| [15] | Zhang C W, Jin L, Mondie B, et al. Leporin B: A novel hexokinase II gene inducing agent from an unidentified fungus [J]. Bioorg Med Chem Lett, 2003, 13(8): 1433-1435. |
| [16] | Pretsch E, Buhlmann P, Affolter C. 波谱数据表--有机化合物的结构解析 [M]. 荣国斌译. 上海: 华东理工大学出版社, 2002. |
| [17] | Hartwell L H, Weinert T A. Checkpoints: controls that ensure the order of cell cycle events [J]. Science, 1989, 246(4930): 629-634. |
| [18] | Barrow C J, Sedlock D M. 1'-(2-Phenyl-ethylene)- ditryptophenaline, a new dimeric diketopiperazine from Aspergillus flavus [J]. J Nat Prod, 1994, 57(9): 1239-1244. |
 2015, Vol. 46
2015, Vol. 46

