糖尿病肾病(diabetic nephropathy,DN)是由糖尿病引起的严重程度和危害性最大的慢性血管并发症,其特点是微血管病变导致的肾小球硬化,起病隐匿且进展缓慢,在欧美国家已成为终末期肾病(ESRD)最常见的病因,具体发病机制目前尚不明确。持续高血糖导致大量晚期糖基化终末产物(AGEs)的形成与积聚,AGEs与晚期糖基化终末产物受体(RAGE)相结合,激活AGEs-RAGE信号通路,诱导氧化应激与炎性反应,促进DN的发生与发展[1, 2]。目前针对DN现代医学尚无有效的治疗措施,近年来研究显示,我国传统中药对延缓DN发生发展有一定疗效。绞股蓝Gynostemma pentaphyllum (Thunb.) Makino属多年生草本植物,又名五叶参、七叶胆,具有极高药用价值及保健作用,民间称其为“不老长寿药草”,亦有“南方人参”之美誉。其主要成分是绞股蓝皂苷(GP),GP可明显改善糖尿病大鼠肾脏的氧化应激水平[3, 4],但具体机制尚不明确。GP是否抑制AGEs生成及阻断AGEs-RAGE信号通路目前尚未见相关文献报道。故本实验以人肾小球系膜细胞(HMCs)为研究对象,观察GP对AGEs诱导的HMCs RAGE表达及氧化应激水平的影响,初步探讨GP改善DN的可能机制。
1 材料 1.1 药品与试剂GP(质量分数≥98%,批号J0423AS),大连美仑生物技术有限公司;氨基胍盐酸盐(批号MKBP9234V),美国Sigma公司。AGEs,美国Biovision公司;DMEM低糖培养基,美国Gibco公司;胎牛血清(FBS),南美GEMINI公司;超氧化物歧化酶(SOD)、丙二醛(MDA)和微量还原型谷胱甘肽(GSH)试剂盒均购自南京建成生物工程研究所;Trizol试剂、2×Taq PCR MasterMix及DNA Marker均购自天根生化科技北京有限公司;逆转录酶试剂盒和PCR引物均购自美国Invitrogen公司;兔抗人RAGE抗体,美国ABGENT公司;辣根酶标记山羊抗兔IgG,北京中杉金桥生物技术有限公司。
1.2 仪器SW-CJ-2F超净工作台,苏洁净化设备有限公司;Axiovert 40C倒置相差显微镜,Zeiss公司;PCR扩增仪,Bio-Rad公司;TDL-80-2B低速离心机,上海安亭科学仪器厂;Legend Micro 17R低温高速离心机,Thermo Scientifc;DYY-6D 型电泳仪,北京市六一仪器厂;JS-780培清全自动凝胶成像分析仪,上海培清科技有限公司。
2 方法 2.1 细胞培养HMCs细胞株由中南大学湘雅医学院中心实验室细胞库提供,常规培养于完全培养基(含13% FBS的DMEM低糖培养基)中,置37 ℃、5% CO2培养箱中培养。2~3 d后细胞贴壁达80%~90%时,用0.25%的胰酶消化传代培养。所有细胞体外扩增不超过10代。
2.2 药物配制AGEs用含13% FBS的DMEM低糖培养基配制成质量浓度为200 mg/L的原液,加入不同量的GP,配成含GP的AGEs溶液,使GP的终质量浓度分别为25、75、150 mg/L,4 ℃保存备用。阳性药物氨基胍用高压后的去离子水溶解,以含13% FBS的DMEM低糖培养基(含AGEs 200 mg/L)配制成终浓度为0.1 mmol/L溶液,滤过除菌,4 ℃保存备用。
2.3 分组及给药将对数生长期的HMCs细胞以每瓶5×105个接种于50 mL培养瓶中,置细胞培养箱中孵育过夜,按照随机化原则分组:对照组(含13% FBS的DMEM培养基),AGEs组(AGEs原液200 mg/L),GP低、中、高剂量(含GP 25、75、150 mg/L的AGEs溶液)组,阳性对照组(含氨基胍0.1 mmol/L 的AGEs溶液)。各组细胞培养72 h后待用。
2.4 实时荧光定量PCR检测RAGE mRMA表达Trizol法提取各组细胞总RNA,并检测其浓度。按照逆转录试剂盒步骤合成cDNA,以cDNA为模板进行PCR反应。RAGE上游引物5’-CAGGAATG- GAAAGGAGACCAA-3’,下游引物5’-TAGCTTCC- CTCCGACACACA-3’;GAPDH上游引物5’-TGCACCACCAACTGCTTAGC-3’,下游引物5’-GGCATGGACTGTGGTCATGAG-3’。PCR反应条件:预变性94 ℃、3 min,变性94 ℃、30 s,退火1 min(RAGE退火温度为57 ℃;GAPDH退火温度为59 ℃),复性72 ℃、30 s,共30个循环,延伸72 ℃、5 min。取PCR产物5 μL进行琼脂糖凝胶电泳30 min后,于凝胶成像分析仪中拍照,sensiAnsys凝胶图像分析软件分析电泳图片,并测量各条带灰度值,以RAGE mRNA/GAPDH mRNA表示各组RAGE mRNA表达水平。
2.5 Western blotting检测RAGE蛋白表达水平0.25%胰酶消化各组细胞,将细胞收集于1.5 mL EP管中,加入150 μL RIPA细胞裂解液,冰上裂解30 min,超声(超声10 s间隔30 s,反复3次)使细胞充分裂解。12 000 r/min、4 ℃离心20 min,吸取上清液进行蛋白定量。配制12%分离胶与5%浓缩胶,取30 μg蛋白,加入5×缓冲液,沸水煮10 min使蛋白充分变性。聚丙烯酰胺电泳,100 V,2 h后,4 ℃恒流260 mA下转膜90 min将蛋白转移到醋酸纤维膜上。5%脱脂奶粉封闭1.5 h,分别与GAPDH鼠抗人单克隆抗体及RAGE兔抗人多克隆抗体4 ℃孵育过夜,洗膜每次10 min,3次后与相应的辣根过氧化物酶标记的二抗共同孵育1 h,ECL发光,显影,定影,压片。
2.6 SOD、MDA、GSH检测采用比色法、TBA法检测细胞上清液中SOD、MDA水平,微量酶标法检测细胞内GSH水平。均严格按照试剂盒说明书操作。
2.7 统计方法实验数据以x±s表示,采用SPSS 18.0统计软件进行统计分析。多组间比较采用单因素方差分析,组间两两比较采用t检验。
3 结果 3.1 对HMCs RAGE mRNA的影响AGEs刺激促使HMCs内RAGE mRNA高表达,与对照组比较,AGEs(200 mg/L)诱导HMCs 72 h后,AGEs组和各加药组RAGE mRNA表达量显著增高(P<0.01)。给予GP干预后,可显著下调RAGE mRNA表达,与AGEs组比较,各加药组RAGE mRNA表达量随GP剂量(25~150 mg/L)逐渐增加而下调,差异显著(P<0.01),并呈剂量依赖性。结果见图 1。
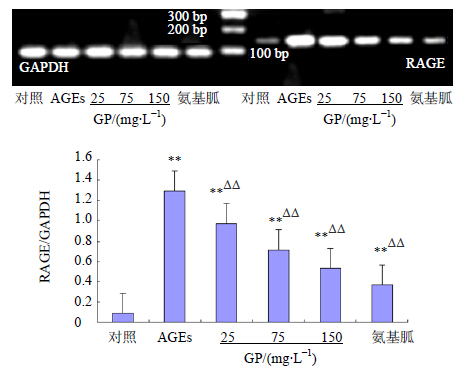 | 与对照组比较:**P<0.01;与AGEs组比较:ΔΔP<0.01,下同 **P < 0.01 vs control group;ΔΔP < 0.01 vs AGEs group, same as below 图 1 GP对HMCs RAGE mRNA 表达的影响 (x±s, n = 3) Fig.1 Effect of GP on expression of RAGE mRNA in HMCs(x±s, n = 3) |
AGEs刺激促使HMCs内RAGE蛋白高表达,与对照组比较,AGEs(200 mg/L)诱导HMCs 72 h后,AGEs组和各加药组RAGE表达量显著增高(P<0.01)。给予GP干预后,可显著下调RAGE蛋白表达,与AGEs组比较,各加药组RAGE蛋白表达量随GP剂量(25~150 mg/L)逐渐增加而下调,并呈剂量依赖性,差异显著(P<0.01)。结果见图 2。
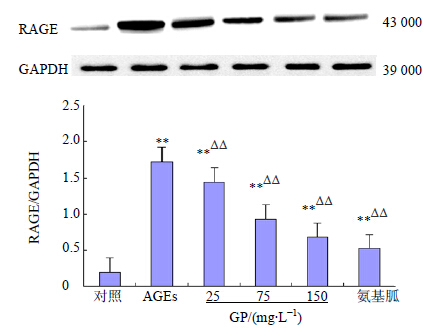 | 图 2 GP对 HMCs RAGE蛋白表达水平的影响 (x±s, n = 3) Fig.2 Effect of GP on expression levels of RAGE protein in HMCs (x±s, n = 3) |
AGEs刺激可明显增加细胞上清液中MDA水平,降低上清液中SOD和细胞内GSH水平,增加细胞内氧化应激水平。与对照组相比,AGEs组及不同剂量GP组SOD、GSH水平显著降低,MDA水平显著升高(P<0.01)。与AGEs组比较,各GP加药组SOD、GSH水平随着GP剂量(25~150 mg/L)逐渐增加而升高,MDA水平下降,且呈剂量依赖性,差异显著(P<0.01)。结果见表 1。
| 表 1 各组细胞中 SOD、MDA及 GSH 水平比较 (x±s, n = 3) Table 1 Comparison on SOD, MDA, and GSH levels in HMCs of each group (x±s, n = 3) |
DN是糖尿病重要的微血管并发症之一,其病理改变主要表现为肾小球系膜细胞的增殖肥大、基底膜增厚及细胞外基质过度积聚,引起肾小球硬化,最终可导致ESRD的发生,是糖尿病患者致残、致死的主要原因。DN的发病机制复杂,目前尚未完全阐明,近年来国内外研究均表明AGEs的形成及氧化应激在DN发生发展中发挥着重要作用。AGEs是机体在长期的高血糖状态下葡萄糖分子可与体内蛋白质发生非酶糖基化反应形成的产物。DN的发生发展与AGEs的积聚关系密切。使用免疫组化的方法可在弥漫性或结节性改变的肾小球系膜、基底膜及小管基底膜和血管壁上大量检出AGEs[5]。研究发现AGEs可独立于高血糖引起系膜细胞的增殖及细胞外基质(ECM)的聚集,促使肾小球硬化的发生[6, 7]。此外,AGEs还可通过与其细胞表面受体 RAGE结合,形成AGE-RAGE系统,通过增强氧化应激、激活核因子-κB(NF-κB)信号途径,调节下游基因表达,刺激多种细胞因子和生长因子的表达,对肾小球及肾小管间质造成不可逆转的损伤,引起肾小球硬化[8]。
氧化应激在DN的进展中起着核心作用[9]。肾脏是氧化应激的靶器官,容易受到ROS攻击,造成氧化损伤,引起病理反应。MDA是脂质过氧化进而形成的产物。SOD活力高低间接反映了机体清除氧自由基的能力。GSH是机体内最重要的非酶性抗氧化物,其水平的多少是衡量机体抗氧化能力大小的重要因素。因而本实验测定三者水平来反映细胞氧化应激水平。
有研究发现AGEs可直接刺激ROS的产生,降低抗氧化酶如SOD和氢氧化物酶的活性,减少谷胱甘肽水平[10]。本研究显示,在AGEs诱导下,HMCs RAGE mRNA 及蛋白表达水平明显上调,同时抗氧化指标SOD和GSH水平下降,氧化指标MDA水平升高。表明AGEs刺激能促使HMCs内RAGE高表达,增强细胞内氧化应激水平。ROS与蛋白质游离氨基和巯基结合形成Amadori(AGEs的前体)产物,其进一步修饰后形成AGEs,所形成的AGEs在细胞膜上与 RAGE结合,活化NF-κB,进一步激活RAGE、IL-6、IL-1、TNF-α 等基因的转录[11, 12]。由此可见,AGEs-RAGE系统与氧化应激关系密不可分,二者相互作用。有日本学者提出AGEs-RAGE-氧化应激轴的观点,认为其参与糖尿病血管并发症,抑制该系统可能为DN提供一个有前景的靶向干预措施[13]。
绞股蓝是我国传统中药,GP为其主要成分,在我国主要分布于秦岭及长江以南广大地区,研究表明[14]绞股蓝具有降血糖、调血脂、抗肿瘤、抗衰老、增强免疫、镇静止痛、防治糖皮质激素不良反应、保护心脏及抗溃疡等药理作用。近年研究发现GP在降血糖、防治DN方面有显著疗效[15]。黄平等[16]研究表明绞股蓝颗粒可抑制DN状态下异常活化的局部肾素血管紧张素系统,调节DN大鼠血糖、血脂代谢,减少尿蛋白保护肾功能,延缓DN的发展。本课题组前期发现GP可抑制AGEs诱导HMCs过度增殖,抑制系膜增殖及细胞外基质产生和积聚,从而延缓DN进程[17]。进一步研究发现,给予不同剂量GP干预后,可下调AGEs刺激后系膜细胞RAGE的异常高表达,同时改善细胞内氧化应激水平。推测其可能的机制是GP阻断了RAGE介导的AGEs-RAGE-氧化应激信号通路,表现为细胞上清液中MDA水平减低和SOD水平增加及细胞内GSH水平增加。
综上所述,GP改善细胞内氧化应激水平可能通过阻断AGEs-RAGE 信号通路,为GP防治DN提供了理论依据。此外,GP是否通过阻断DN其他信号通路如NF-κB、p38MAPK等,改善细胞内氧化应激水平从而延缓DN进展尚不明确,有待进一步深入的研究。仅从体外实验角度探讨GP对AGEs-RAGE信号通路和氧化应激之间的作用是本实验的局限性,本课题组拟进行动物实验进一步深入探讨。
| [1] | Yan S F, Ramasamy R, Schmidt A M. The RAGE axis: a fundamental mechanism signaling danger to the vulnerable vasculature [J]. Circ Res, 2010, 106(5): 842-853. |
| [2] | Reiniger N, Lau K, McCalla D, et al. Deletion of the receptor for advanced glycation end products reduces glomerulosclerosis and preserves renal function in the diabetic OVE26 mouse [J]. Diabetes, 2010, 59(8): 2043-2054. |
| [3] | 郎志芳, 董 琦, 韩继成. 绞股蓝皂甙对糖尿病大鼠肾脏氧化应激影响的研究 [J]. 牡丹江医学院学报, 2005, 26(4): 5-8. |
| [4] | 史 琳, 宋东平, 潘明佳, 等. 绞股蓝皂苷成分的研究进展 [J]. 药物评价研究, 2011, 34(6): 456-464. |
| [5] | Wendt T, Tanji N, Guo J, et al. Glucose, glycation, and RAGE: implications for amplification of cellular dysfunction in diabetic nephropathy [J]. J Am Soc Nephrol, 2003, 14(5): 1383-1395. |
| [6] | Zhang M H, Feng L, Zhu M M, et al. The anti-inflammation effect of Moutan Cortex on advanced glycation end products-induced rat mesangial cells dysfunction and high-glucose-fat diet and streptozotocin-induced diabetic nephropathy rats [J]. J Ethnopharmacol, 2014, 151(1): 591-596. |
| [7] | 侯绍章, 郑芳芳, 李 媛, 等. 甘草酸对 AGEs 培养肾小球系膜细胞及 ECM 表达的影响[J]. 中国药理学通报, 2014, 30(5): 642-645. |
| [8] | Alexiou P , Chatzopoulou M, Pegklidou K, et al. RAGE: a multi-ligand receptor unveiling novel insights in health and disease [J]. Curr Med Chem, 2010, 17(21): 2232-2252. |
| [9] | Arora M K, Singh U K. Oxidative stress:meeting multiple targets pathogenesis of diabetic nephropathy [J]. Curr Drug Targets, 2014, 15(5): 531-538. |
| [10] | 姚美芬, 沈建国. AGE-RAGE系统及氧化应激与糖尿病肾病[J]. 国际泌尿系统杂志, 2008, 28(4): 524-527. |
| [11] | Morcos M, Schlotterer A, Sayed A A, et al. Rosiglitazone reduces angiotensin II and advanced glycation end product-dependent sustained nuclear factor-kappaB activation in cultured human proximal tubular epithelial cells [J]. Horm Metab Res, 2008, 40(11): 752-759. |
| [12] | Al-Malki A L. Oat attenuation of hyperglycemia-induced retinal oxidative stress and NF-κB activation in Streptozotocin-induced diabetic rats [J]. Evid Based Complement Alternat Med, 2013, 2013: 983923. |
| [13] | Yamagishi S, Nakamura K, Matsui T, et al. Agents that block advanced glycation end product (AGE)-RAGE (receptor for AGEs)-oxidative stress system: a novel therapeutic strategy for diabetic vascular complications [J]. Expert Opin Investig Drugs, 2008, 17(7): 983-996. |
| [14] | 朴香兰, 吴 倩. 绞股蓝研究进展 [J]. 时珍国医国药, 2010, 21(7): 1758-1760. |
| [15] | 陈 丹, 黄 平. 绞股蓝防治糖尿病肾病研究 [J]. 吉林中医药, 2011, 31(7): 686-687. |
| [16] | 黄 平, 钱 康. 绞股蓝颗粒对早期糖尿病肾病肾脏肾素-血管紧张素系统的影响 [J]. 中华中医药杂志, 2010, 25(3): 434-439. |
| [17] | 周 康, 唐 灵, 肖福英, 等. 绞股蓝皂苷对AGEs 诱导人肾小球系膜细胞增殖及其TGF-β1、FN mRNA 表达的影响 [J]. 山东医药, 2014, 54(47): 9-12. |
 2015, Vol. 46
2015, Vol. 46


