2. 吉林医药学院基础医学院 机能实验室, 吉林 吉林 132013;
3. 吉林医药学院基础医学院 病理教研室, 吉林 吉林 132013;
4. 吉林医药学院 临床医学系, 吉林 吉林 132013
2. Department of Functional Experimental Science, Basic Medicine, Jilin Medical University, Jilin 132013, China;
3. Department of Pathology, Basic Medicine, Jilin Medical University, Jilin 132013, China;
4. Department of Clinical Medicine, Jilin Medical University, Jilin 132013, China
苦参Sophora flavescens Ait.,又名白茎、水槐、地槐,始载于《神农本草经》,是我国常用传统中药。目前已从苦参中分离鉴定的化学成分有生物碱类、黄酮类、脂肪酸类、氨基酸类、挥发油类等,研究表明苦参具有抗病原微生物[1]、抗炎、抗过敏、抗肿瘤[2]、利尿、抗心律失常、调节免疫和抗氧化[3]等多种药理作用,其主要活性物质是生物碱类和黄酮类[4]。前期研究[5]结果提示苦参总黄酮通过降低心肌局部血管紧张素II(AngII)的水平、抗氧化等发挥抗心肌纤维化的作用,本研究采用异丙肾上腺素(isoprenaline,Iso)构建大鼠心肌纤维化模型,进一步观察苦参总黄酮对大鼠心肌纤维化的作用,并深入探讨其作用机制。
1 材料 1.1 实验动物清洁级Wistar大鼠,雌雄各半,体质量(220±20) g,由吉林大学基础医学部实验动物中心提供,合格证号SCXK(吉)2008-0005。
1.2 药品与试剂苦参总黄酮(西安草翠芯生物科技有限公司,批号20120926,质量分数80%);Iso(西安仁红生物科技有限公司,批号20120706);卡托普利(上海普康药业有限公司,批号20121011);丙二醛(MDA)、考马斯亮蓝试剂盒(南京建成生物工程公司);I型胶原、III型胶原、AngII ELISA试剂盒(美国BD公司);肿瘤坏死因子α(TNF-α)ELISA试剂盒(上海浩本生物科技有限公司);NO试剂盒(碧云天试剂公司)。
1.3 主要仪器722可见分光光度计(上海欣茂仪器有限公司产品);Model 680型酶标仪(美国Bio-rad公司);FVl000型激光共聚焦显微镜(日本Olympus公司)。
2 方法 2.1 动物分组和给药方法Wistar大鼠随机分为6组(每组12只):对照组,模型组,苦参总黄酮低、中、高剂量(100、200、400 mg/kg)组,卡托普利(50 mg/kg)组。除对照组外,各组大鼠均每天背部sc Iso 5 mg/kg,连续7 d,建立大鼠心肌纤维化模型。苦参总黄酮组及卡托普利组自造模第2天开始ig给药,连续21 d,每天1次,对照组和模型组ig给予相同体积的蒸馏水。
2.2 心脏质量参数及指标检测大鼠末次给药24 h,称体质量(BW),10%水合氯醛(0.3 mL/kg)麻醉,腹主动脉取血,静置30 min以上,3 000 r/min离心15 min,分离得血清,−20 ℃冻存。开胸取心脏,去除大血管、心外膜脂肪组织,用冰生理盐水清洗,滤纸吸干后称全心质量(HW)和左心室质量(LVW),计算心重指数(HW/BW,mg/g)和左心室重指数(LVW/BW,mg/g)。取左心室心肌组织,在冰浴下制成5%、1%组织匀浆,4 ℃、4 000 r/min离心15 min,取上清液备用。按照ELISA试剂盒说明,取1%心肌匀浆用酶标仪测定心肌中I型、III型胶原、TNF-α水平;取1%心肌匀浆用酶标仪测定心肌中NO水平;取血清用酶标仪检测血清中AngII水平;取5%心肌匀浆严格按试剂盒说明用分光光度计测定MDA水平。
2.3 心肌HE染色每组随机选取大鼠2只,取心脏,将心脏于4%多聚甲醛固定24 h,常规石蜡包埋,切片,HE染色,光学显微镜下观察并拍照。
2.4 统计学分析实验所有数据以x±s表示,采用SPSS 13.0软件进行统计,组间比较采用方差分析及q检验。
3 结果 3.1 对心肌纤维化大鼠心脏质量参数及心肌中I型、III型胶原水平的影响与对照组比较,模型组大鼠HW/BW、LVW/BW明显升高,心肌中I型、III型胶原水平均升高(P<0.05、0.01);与模型组比较,苦参总黄酮200、400 mg/kg剂量组及卡托普利组大鼠HW/BW、LVW/BW、心肌中I型、III型胶原水平均呈下降趋势,且差异显著(P<0.05、0.01),结果见表 1。
| 表 1 苦参总黄酮对Iso诱导的心肌纤维化大鼠HW/BW、LVW/BW及心肌中I型、III型胶原水平的影响 (x±s, n = 10) Table 1 Effect of flavonoids from S. flavescens on HW/BW and LVW/BW, concentration of collagens I and III in myocardium of myocardial fibrosis rats induced by Iso (x±s, n = 10) |
模型组血清中AngII水平及心肌TNF-α水平明显高于对照组(P<0.01),苦参总黄酮低、中、高剂量可降低血清中AngII水平、心肌中TNF-α水平,与模型组比较差异显著(P<0.05、0.01),结果见表 2。
| 表 2 苦参总黄酮对Iso诱导的心肌纤维化大鼠血清中 AngII水平及心肌TNF-α水平的影响(x±s, n = 10) Table 2 Effect of flavonoids from S. flavescenson concentration of AngII in serum and concent of TNF-α in myocardium ofmyocardial fibrosis ratsinduced by Iso (x±s, n = 10) |
模型组大鼠心肌中NO水平显著低于对照组,MDA水平显著高于对照组(P<0.01);苦参总黄酮中、高剂量升高心肌中NO水平,降低MDA水平,与模型组比较差异显著(P<0.05),结果见表 3。
| 表 3 苦参总黄酮对Iso诱导的心肌纤维化大鼠心肌中NO和MDA水平的影响(x±s, n = 10) Table 3 Effects of flavonoids from S. flavescenson content of NO and MDA in myocardium of myocardial fibrosis rats induced by Iso (x±s, n = 10) |
对照组心肌结构完整,横纹清晰,细胞核居中,间质未见血管扩张及炎性细胞的浸润。模型组心肌结构紊乱,可见不同程度的心肌细胞萎缩、变性、灶状坏死及炎性细胞浸润,可见明显的纤维化病灶形成。苦参总黄酮100 mg/kg组与对照组比较,有心肌细胞变性、灶状坏死,但纤维化不明显,与模型组比较,心肌纤维化有改善。苦参总黄酮200、400 mg/kg组及卡托普利组心肌损伤程度明显减轻,心肌结构尚规整,虽有较明显的变性改变,但未见明显的坏死及纤维化病灶形成。结果见图 1。
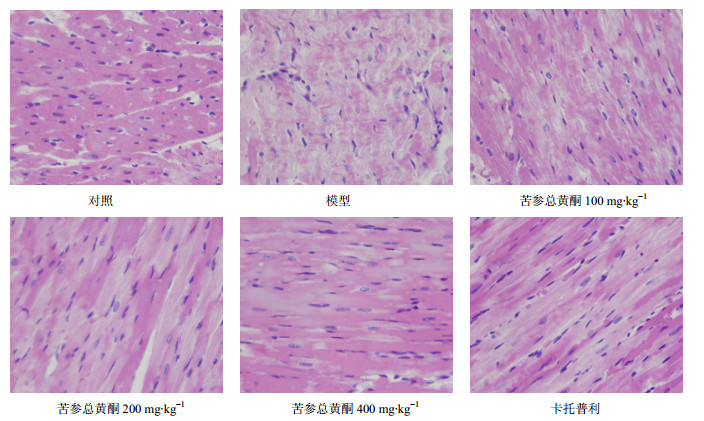 | 图 1 各组大鼠心肌组织病理改变Fig.1 Pathologic changes of myocardium tissues of rats in each group |
各种原因引起的心肌损害,随着病变持续和病程慢性化,将导致心肌纤维化,心肌纤维化时局部心肌细胞凋亡,取而代之的是心肌成纤维细胞增殖和纤维性胶原成分增多,心脏功能逐步减退,最终导致心功能障碍、心力衰竭和心律失常。因此预防及控制心脏间质胶原增生从而有效防治心肌纤维化的措施,是延缓心力衰竭、减少心律失常发生的重要手段。目前研究显示多种因素可引起心肌纤维化的发生,包括肾素-血管紧张素-醛固酮系统(renin- angiotensin-aldosterone system,RAAS)、内皮素、缓激肽、儿茶酚胺、NO及生长因子(转化生长因子-β、结缔组织生长因子等)。RAAS激活是公认的导致MF的神经内分泌机制,在心脏重构中起关键作用。其中,AngII具有生长因子样作用,AngII可通过自分泌和旁分泌的方式发挥作用,是刺激心肌肥大的重要体液因素之一,并可刺激心脏成纤维细胞增殖,引起心肌纤维化。AngII致心肌纤维化的信号通路复杂,主要通过与其特异性受体AngII I型受体结合,并激活一系列信号分子通路将细胞外信号传递至细胞内产生纤维化效应[6, 7, 8]。心肌纤维化的发生过程中,有炎症反应的参与,在心肌缺血损伤及发生炎症反应时,TNF-α过量表达可诱发心肌细胞肥大、凋亡及心肌成纤维细胞增殖[9],导致心肌纤维化、心力衰竭,有研究[10]显示AngII可促进TNF-α合成,而抗TNF-α治疗可阻止心腔扩大,改善间质胶原重构,减轻心肌纤维化[8]。本研究在前期结果基础上发现,Iso颈背部sc建立大鼠心肌纤维化模型较成功,模型组表现为HW/BW、LVW/BW明显升高,循环系统和心肌局部的AngII、I和III型胶原水平明显增高,心肌TNF-α水平增高,心肌病理可见心肌损伤、明显的纤维化病灶形成。给予苦参总黄酮21 d后,可见大鼠HW/BW、LVW/BW降低,循环系统和心肌局部的AngII水平降低,心肌组织中I、III型胶原及TNF-α水平明显降低,病理改变较模型组改善,可见苦参总黄酮可通过抑制循环系统和心肌局部的AngII的生成,从而降低心肌中TNF-α的水平、减少胶原的产生,进而抑制心肌纤维化。
在调节心肌纤维化的生物活性物质中,NO受到人们的重视。NO是一种内源性调节因子,具有抑制血小板聚集、改善血管内皮功能、舒张血管、降低血压、延缓心室肥厚等多种心血管系统作用[11]。有研究[12]发现在肾小管调节血压及内环境稳定中,NO会抑制AngII对心血管系统的作用。本研究发现模型组大鼠心肌中NO水平显著低于对照组,经苦参总黄酮治疗后大鼠心肌中NO的水平增加,且随剂量增加药物作用依次增强,因此推测苦参总黄酮可能通过升高心肌组织中NO浓度,拮抗AngII所致的心肌纤维化,延缓并逆转心室肥厚,改善心肌纤维化。近年研究显示心肌纤维化的发展与氧化应激密切相关。脂质过氧化产物MDA的水平变化可直接反映心肌细胞膜脂质过氧化的速度与程度,并间接反映细胞损伤的程度。在实验中发现,经苦参总黄酮治疗后心肌中MDA水平显著降低,说明苦参总黄酮的抗心肌纤维化作用的发挥也有抗氧化的参与,与前期研究结果一致[5]。
综上所述,苦参总黄酮抑制心肌纤维化的作用可能与其通过提高NO水平及抗氧化作用而拮抗循环及心肌局部AngII的生成,从而降低心肌中TNF-α及胶原生成有关,本研究对心肌纤维化疾病防治具有一定的参考价值,但进一步的具体细胞信号转导机制还需进一步探讨。
| [1] | Chong E S, Hwang G B, Nho C W, et al. Antimicrobial durability of air filters coated with airborne Sophora flavescens nanoparticles [J]. Sci Total Environ, 2013, 444: 110-114. |
| [2] | Sun M Y, Cao H Y, Sun L, et al. Antitumor activities of kushen: literature review [J]. Evid Based Complement Alternat Med, 2012, 2012: 373219. |
| [3] | Xu W R, Lin H S, Zhang Y, et al. Compound Kushen Injection suppresses human breast cancer stem-like cells by down-regulating the canonical Wnt/β-catenin pathway [J]. J Exp Clin Cancer Res, 2011, 30(1): 103-112. |
| [4] | 顾关云, 肖年生, 蒋 昱. 苦参的化学成分、生物活性和药理作用 [J]. 现代药物与临床, 2009, 24(5): 265-271. |
| [5] | 范红艳, 王艳春, 任 旷, 等. 苦参总黄酮对异丙肾上腺素所致大鼠心肌纤维化的影响 [J]. 中药药理与临床, 2013, 29(4): 76-78. |
| [6] | 谢永进, 盖鲁粤. 血管紧张素Ⅱ致心肌纤维化及其信号转导机制研究进展 [J]. 解放军医学院学报, 2014, 35(6): 630-633. |
| [7] | Chen J X, Zeng H, Reese J, et al. Overexpression of angiopoietin-2 impairs myocardial angiogenesis and exacerbates cardiac fibrosis in the diabetic db/db mouse model [J]. Am J Physiol Heart Circ Physiol, 2012, 302(4): H1003-H1012. |
| [8] | Li L, Zhang Z C, Lei H, et al. Angiotensin II reduces cardiac adipoR1 expression through AT1 receptor/ROS/ERK1/2/c-Myc pathway [J]. PLoS One, 2013, 8(1): e49915. |
| [9] | Venkatachalam K, Venkatesan B, Valente A J, et al. WISP1, a pro-mitogenic, pro-survival factor, mediates tumor necrosis factor-α (TNF-α)-stimulated cardiac fibroblast proliferation but inhibits TNF-α-induced cardiomyocyte death [J]. Biol Chem, 2009, 284(21): 14414-14427. |
| [10] | Duerrschmid C, Crawford J R, Reineke E, et al. TNF receptor 1 signaling is critically involved in mediating angiotensin-II-induced cardiac fibrosis [J]. J Mol Cell Cardio, 2013, 57: 59-67. |
| [11] | Villanueva1 C, Giulivi C. Subcellular and cellular locations of nitric-oxide synthase isoforms as determinants of health and disease [J]. Free Radic Biol Med, 2010, 49(3): 307-316. |
| [12] | Horita S, Nakamura M, Shirai A, et al. Regulatory roles of nitric oxide and angiotensin II on renal tubular transport [J]. World J Nephrol, 2014, 3(4): 295-301. |
 2015, Vol. 46
2015, Vol. 46


