2. 河北省中医学院, 河北 石家庄 050071;
3. 承德市中心医院, 河北 承德 067000
2. Hebei University of Chinese Medicine, Shijiazhuang 050071, China;
3. Chengde Center Hospital, Chengde 067000, China
玄麦甘桔颗粒是《中国药典》载入的中药品种,源于古方玄麦甘桔汤,由玄参、麦冬、甘草、桔梗4味药材成,具有滋阴润肺、祛痰利咽的功效,用于治疗阴虚火旺所致的咽炎、咳嗽等呼吸道系统疾病[1, 2]。玄参的主要有效成分为环烯醚萜类成分[3];麦冬的主要活性成分为皂苷和黄酮类成分[4];甘草的主要活性成分为三萜皂苷和黄酮类化合物[5, 6];桔梗的主要活性成分为甾体皂苷类成分[7]。《中国药典》2010年版中仅将玄参和麦冬的定性鉴别反应作为现行标准,已有文献报道[8, 9, 10, 11]主要采用HPLC法以玄参和甘草中的甘草苷、甘草酸铵、哈巴俄苷为指标成分建立定量测定质控方法,仅针对其中1~2类代表性有效成分分别测定,分析周期较长,质量控制方法不全面。中药复方制剂成分复杂,建立多指标成分定量测定方法可更客观、全面地反映制剂质量。
目前,对于玄麦甘桔颗粒中有效成分的定量分析尚无对几大类成分中代表性指标的同时定量分析报道。本实验采用UPLC-MS/MS技术[12]同时测定各组方药材中主要活性物质的8种代表性成分哈巴苷、哈巴俄苷、麦冬皂苷D、麦冬黄烷酮A、麦冬黄烷酮B、甘草苷、甘草酸铵和桔梗皂苷D,以期为玄麦甘桔颗粒提供更高效、全面、可靠的质量控制方法。
1 仪器与材料AB Sciex QTRAPTM 5500型串联四极杆线性离子阱质谱仪,美国Applied Biosystems公司,含有Turbo V离子源和三重四极杆线性离子肼串联质量分析器。超高效液相色谱系统,Shimadzu 30A UPLC System,Kyoto,日本,配有Shimadzu 30AD二元高压梯度泵、Shimadzu CTO30A柱温箱和Shimadzu SIL30AC自动进样器,Analyst 1.6.1数据采集软件。BP211D型分析天平,北京赛多利斯仪器有限公司;KQ5200E型超声波清洗器,江苏昆山市超声仪器有限公司;雷勃尔LG16-B高速离心机,北京雷勃尔离心机有限公司。
对照品哈巴苷(批号20141015)、哈巴俄苷(批号20141125)、麦冬皂苷D(批号20140305)、麦冬黄烷酮A(批号20140617)、麦冬黄烷酮B(批号20140612)、甘草苷(批号20140923)、甘草酸铵(批号20140926)和桔梗皂苷D(批号20140519)购自南京春秋生物科技有限公司,质量分数均大于98%。甲醇、乙腈、甲酸为色谱纯,水为娃哈哈纯净水。玄麦甘桔颗粒由药店购得,规格:10 g/袋,云南白药集团,批号ZFA1406、ZGA1405;成都第一药业有限公司,批号150019、150023;宁夏多维药业有限公司,批号51078、51079;太极集团重庆中药二厂有限公司,批号1405062;四川禾润制药有限公司,批号141003。
2 方法与结果 2.1 色谱条件色谱柱为Phenomenex Kinetex C18柱(50 mm×2.1 mm,5 μm);柱温20 ℃;流动相为乙腈-0.1%甲酸水溶液,梯度洗脱:0~8 min,1%~60%乙腈;8~10 min,60%~1%乙腈;体积流量0.3 mL/min;进样量5 μL;进样前平衡2 min。
2.2 质谱条件电喷雾离子源(ESI源),离子源温度为600 ℃,正、负离子同时监测模式,Turbo V离子源。源喷射电压为5 500、−4 500 V,雾化气(gas 1)和加热气(gas 2)分别为414、448 kPa,帘气为172 kPa,接口处加热,采用正负离子同时检查,多反应监测模式(MRM)。8种被测成分的监测离子对分别为哈巴苷m/z 363.0/201.0,甘草苷m/z 417.1/255.0,哈巴俄苷m/z 493.3/345.1,桔梗皂苷D m/z 1 225.0/ 1 093.2,甘草酸铵m/z 822.4/351.0,麦冬皂苷D m/z 855.6/287.3,麦冬黄酮A m/z 341.1/178.0和甲基麦冬黄烷酮B m/z 327.0/178.0。8种待测物的MS2监测离子对、解簇电压和碰撞能量等参数见表 1。
| 表 1 玄麦甘桔颗粒中8种化学成分的保留时间、监测离子与主要质谱参数 Table 1 Retention time, monitoring ions, and main mass parameters of eight components in Xuanmai Ganjie Granules |
分别取哈巴苷、甘草苷、哈巴俄苷、桔梗皂苷D、甘草酸铵、麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B对照品适量,精密称定,加甲醇溶解,摇匀,制成含哈巴苷2.3 μg/mL、甘草苷2.0 μg/mL、哈巴俄苷0.9 μg/mL、桔梗皂苷D 24 μg/mL、甘草酸铵3.1 μg/mL、麦冬皂苷D 1.9 μg/mL、麦冬黄烷酮A 0.43 μg/mL和麦冬黄烷酮B 0.38 μg/mL的混合对照品溶液。对照品MRM色谱图见图 1。
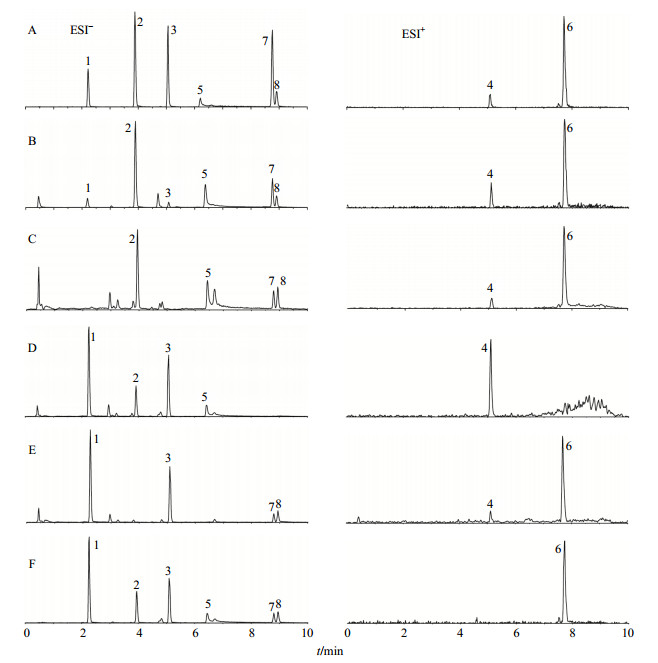 |
1-哈巴苷2-甘草苷3-哈巴俄苷4-桔梗皂苷D 5-甘草酸铵6-麦冬皂苷D 7-麦冬黄烷酮A 8-麦冬黄烷酮B 1-harpagide 2-liquiritin 3-harpagoside 4-platycodin D 5-ammonium glycyrrhetate 6-ophiopogonin D 7-methylophiopogonanone A 8-ethylophiopogonanone B 图 1 混合对照品溶液(A)、玄麦甘桔颗粒样品(B)、玄参阴性对照溶液(C)、麦冬阴性对照溶液(D)、甘草阴性对照溶液(E)、桔梗阴性对照溶液(F)正负离子TIC色谱图Fig.1 Positive and negative ions TIC of mixed reference solution (A),Xuanmai Ganjie Granules (B),Scrophulariae Radix negative control solution (C),Ophiopogonis Radix negative control solution (D),Lycyrrhizae Radix et Rhizoma negative control solution (E),and Platycodonis Radix negative control solution (F) |
精密称取玄麦甘桔颗粒剂0.2 g,加入50%乙醇20 mL,称定质量,超声处理0.5 h,冷至室温,用50%乙醇补足减失的质量,摇匀,14 000 r/min 离心5 min,取上清液过0.22 μm微孔滤膜,取续滤液作为供试品溶液,待测。供试品总离子流(TIC)色谱图见图 1。
2.5 阴性对照溶液的制备哈巴苷、哈巴俄苷来源于玄参,甘草苷、甘草酸铵来源于甘草,麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B来源于麦冬,桔梗皂苷D来源于桔梗,按其处方比例和工艺,分别制备缺少玄参、缺少麦冬、缺少甘草、缺少桔梗药材的阴性对照样品,并按“2.4”项下方法制备各阴性对照溶液。
2.6 方法学考察 2.6.1 专属性考察分别取混合对照品溶液、供试品溶液及阴性样品溶液,按“2.1”和“2.2”项下色谱和质谱条件进样,记录TIC色谱图,结果见图 1。阴性样品在哈巴苷、甘草苷、哈巴俄苷、桔梗皂苷D、甘草酸铵、麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B出峰处无干扰,表明方法专属性良好。
2.6.2 线性关系考察分别精密吸取混合对照品溶液适量,加甲醇-水(50∶50)稀释得系列质量浓度的混合对照品溶液,摇匀,即得,按“2.1”和“2.2”项下色谱和质谱条件测定。以峰面积积分值为纵坐标(Y),对照品质量浓度为横坐标(X)进行线性回归,得回归方程:哈巴苷Y=876 X+526,r=0.999 6;甘草苷i>Y=2.66×103 X-523,r=0.995 6;哈巴俄苷Y=3.2×103 X+537,r=0.998 1;桔梗皂苷D Y=0.18 X+15.7,r=0.997 4;甘草酸铵Y=2.58×103 X+5.05×103,r=0.997 1;麦冬皂苷D Y=8.54×103 X+2.01×103,r=0.999 7;麦冬黄烷酮A Y=4.81×104 X+3.64×104,r=0.999 2;麦冬黄烷酮B Y=8.93×103 X+3.54×103,r=0.998 5;各被测物线性范围分别为9~2 250、8~2 000、3.4~850、96~24 000、12.4~3 100、3.6~1 900、1.7~425、1.5~375 ng/mL。
2.6.3 精密度考察取供试品溶液(样品批号ZFA1406),在“2.1”和“2.2”项色谱和质谱条件下,连续进样6次,记录色谱峰面积,哈巴苷、哈巴俄苷、麦冬皂苷D、麦冬黄烷酮A、麦冬黄烷酮B、甘草苷、甘草酸铵和桔梗皂苷D峰面积的RSD分别为1.1%、1.3%、1.9%、2.1%、1.7%、2.3%、1.4%、2.6%,结果表明仪器精密度良好。
2.6.4 稳定性考察取同一份供试品溶液(样品批号ZFA1406)于室温下放置12 h,每隔3 h测定1次,记录峰面积,哈巴苷、甘草苷、哈巴俄苷、桔梗皂苷D、甘草酸铵、麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B峰面积的RSD分别为0.9%、1.5%、1.1%、2.0%、1.2%、0.8%、1.6%、2.2%,实验结果表明供试品在室温下放置12 h内稳定。
2.6.5 重复性考察精密称取同一批样品(批号ZFA1406)0.3 g共6份,按“2.4”项下方法平行制备6份供试品溶液,进样分析,哈巴苷、甘草苷、哈巴俄苷、桔梗皂苷D、甘草酸铵、麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B质量分数的RSD分别为1.9%、2.5%、1.3%、1.0%、2.7%、0.9%、2.6%、1.2%,方法重复性良好。
2.6.6 加样回收率考察取同一批次玄麦甘桔颗粒(批号ZFA1406)6份,每份0.1 g,分别精密加入哈巴苷、哈巴俄苷、麦冬皂苷D、麦冬黄烷酮A、麦冬黄烷酮B、甘草苷、甘草酸铵和桔梗皂苷D对照品适量,按“2.4”项下方法制备供试品溶液,按照“2.1”和“2.2”项下色谱和质谱条件分别注入液质联用仪测定分析,计算加样回收率。结果哈巴苷、甘草苷、哈巴俄苷、桔梗皂苷D、甘草酸铵、麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B的平均回收率分别为99.9%、97.5%、101.3%、98.5%、97.2%、102.8%、101.6%、99.2%,RSD分别为1.9%、2.5%、1.3%、1.0%、2.7%、0.9%、2.6%、1.2%。
2.7 样品测定收集不同生产厂家不同批次玄麦甘桔颗粒样品,按“2.4”项下方法制备供试品溶液,取对照品和供试品溶液适量,在“2.1”和“2.2”项下色谱和质谱条件下进样分析,测定结果见表 2。
| 表 2 玄麦甘桔颗粒中8种化学成分定量测定结果 Table 2 Determination of eight components in Xuanmai Ganjie Granules |
对常用流动相甲醇-水、乙腈-水和乙腈-甲酸水进行了考察,实验结果表明使用乙腈-甲酸水体系作流动相时被测成分峰形对称,分离效果好。对加入甲酸的比例进一步考察,发现水相中加入0.1%甲酸能够达到最佳的分离效果和稳定的响应值,最后决定本方法采用0.1%甲酸-乙腈水溶液为流动相进行梯度洗脱。
本实验考察了正、负离子扫描方式下各被测成分的响应强度并进行比较,发现正离子模式下麦冬皂苷D和桔梗皂苷D产生的碎片离子响应值高也更为稳定,而哈巴苷、哈巴俄苷、麦冬黄烷酮A、麦冬黄烷酮B、甘草苷和甘草酸铵在负离子模式下响应较好。因此,本实验选择采用同一分析周期内正、负离子同时监测,既兼顾了各分析物质谱碎裂性质,又大幅缩短了分析时间。
将多种药效成分同时进行定量测定的方法正是中药复方质量控制最有效的手段。玄麦甘桔颗粒由4味中药等比组成,而现有文献仅限于选择玄参和甘草中的主要成分作为定量指标[8, 9, 10, 11]。本实验增加了对麦冬和桔梗中主要有效成分的考察,其中麦冬和桔梗的主要活性成分麦冬皂苷D和桔梗皂苷D紫外吸收较弱,采用HPLC法灵敏度差,分析周期长,很难兼顾中药多组分的同时测定。本实验采用UPLC-MS/MS法,由每味药材中选择1~3个主要成分作为定量指标(玄参中的哈巴苷和哈巴俄苷;麦冬中的麦冬皂苷D、麦冬黄烷酮A和麦冬黄烷酮B;甘草中的甘草苷和甘草酸铵;桔梗中的桔梗皂苷D),较已有文献报道[8, 9, 10, 11, 12],不仅大大提高了方法的灵敏度,更兼顾到制剂组方中的每味中药,为更全面地控制该制剂的质量提供了新的方法。
由样品定量测定结果可以看出,不同厂家玄麦甘桔颗粒之间所测活性成分的质量分数差异较大,可能与生产工艺及药材来源不同有关,因此玄麦甘桔颗粒定量测定方法的建立为改进和完善药材质量控制和制备工艺控制等措施提供了有力保证。
| [1] | 李 方. 玄麦甘桔汤治疗咽炎性咳嗽30例 [J]. 辽宁中医药大学学报, 2008, 10(8): 90-92. |
| [2] | 唐华平, 郝月琴, 王 宏, 等. 加味玄麦甘桔汤治疗咳嗽变异性哮喘100例临床观察 [J]. 中国实验方剂学杂志, 2008, 14(10): 64-67. |
| [3] | 张刘强, 李医明. 近10年玄参属植物化学成分和药理作用研究进展 [J]. 中草药, 2011, 42(11): 2360-2366. |
| [4] | Fan X H, Wang Y, Cheng Y Y, et al. LC/MS fingerprinting of Shenmai injection: A novel approach to quality control of herbal medicines [J]. J Pharmaceut Biomed Anal, 2006, 40: 591-598. |
| [5] | 陶伟伟, 段金廒, 杨念云, 等. 乌拉尔甘草皂苷类成分研究 [J]. 中草药, 2013, 44(12): 1552-1557. |
| [6] | 王 青, 苗文娟, 向 诚, 等. 乌拉尔甘草中黄酮类化学成分的研究 [J]. 中草药, 2014, 45(1): 31-36. |
| [7] | 李 婷, 徐文珊, 李西文, 等. 中药桔梗的现代药理研究进展 [J]. 中药药理与临床, 2013, 29(2): 205-209. |
| [8] | 包小红, 周 娟, 伍丕娥. HPLC法测定玄麦甘桔颗粒中甘草酸和哈巴俄苷 [J]. 中成药, 2011, 33(4): 625-628. |
| [9] | 张 萍, 郭亚东, 马银海, 等. RP-HPLC法测定玄麦甘桔颗粒中的甘草苷, 甘草酸, 哈巴俄苷, 肉桂酸的含量 [J]. 药物分析杂志, 2008, 28(5): 735-738. |
| [10] | 郭文婷, 梁从庆. RP-HPLC梯度洗脱法测定玄麦甘桔胶囊中哈巴俄苷与肉桂酸含量 [J]. 中药材, 2008, 31(8): 1257-1259. |
| [11] | 蒋华科, 陈 纯, 符孝军. 高效液相色谱法测定玄麦甘桔颗粒中甘草酸的含量 [J]. 中南药学, 2012, 10(2): 103-105. |
| [12] | 乔晓莉, 肖学凤, 周大铮, 等. UPLC-MS/MS法同时测定注射用益气复脉 (冻干) 中13种成分 [J]. 中草药, 2014, 45(23): 3402-3407. |
 2015, Vol. 46
2015, Vol. 46


