麦冬为百合科沿阶草属植物麦冬Ophiopogon japonicus (Linn. f.) Ker-Gawl. 的干燥块根,具有多种功效,主要功效为养阴润肺、益胃生津、清心除烦[1],其化学成分主要有皂苷、高异黄酮类、多糖、氨基酸等[2, 3, 4],其中高异黄酮类为其主要的活性成分,甲基麦冬高异黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B的量在麦冬黄酮类成分中较高。麦冬的主流商品主要产自于浙江和四川,分别称为杭麦冬和川麦冬[5]。国内外很多相关文献报道对麦冬高异黄酮类化学成分进行测定[6, 7, 8],而本研究主要利用UPLC-PDA测定杭麦冬和川麦冬中3种高异黄酮类成分的量,比较杭麦冬和川麦冬3种活性成分的量差异;近年来,对麦冬黄酮类成分的抗氧化研究也有报道[9, 10],同时麦冬水提物中也含有黄酮、多糖等活性成分,具有抗氧化、抗衰老等作用[11],通过比较其抗氧化能力的差异性,从体外药效学角度评价2个产地药材的质量差异,为麦冬药材的质量控制及道地性研究提供依据。
1 材料与仪器 1.1 材料麦冬样品分别采自四川、浙江麦冬种植地,经中国医学科学院北京协和医学院药用植物研究所李先恩研究员鉴定为百合科沿阶草属植物麦冬Ophiopogon japonicus (Linn. f.) Ker-Gawl. 的干燥块根。麦冬挖出后,取下块根,洗净,烘干。干燥后粉碎,过60目筛,待用,样品的来源见表 1。
| 表 1 麦冬样品来源 Table 1 Resource of OphiopogonisRadix |
美国Waters Acquity超高效液相色谱仪,PDA检测器;百万分之一天平(Mettled Toledo);NV752N紫外可见分光光度计(上海佑科仪器仪表有限公司),KQ-5200DV型数控超声波清洗器(昆山市超声仪器有限公司)。
色谱乙腈(美国Fisher公司),实验用水为娃哈哈纯净水,甲酸(色谱级,美国Fisher公司);其余试剂均为分析纯(北京化学工业公司)。对照品:甲基麦冬高异黄酮A(质量分数≥98%)、甲基麦冬黄烷酮A(质量分数≥98%),购自上海永恒生物科技有限公司;甲基麦冬黄烷酮B(质量分数≥98%),购自上海一林生物科技有限公司;1,1-二苯基-2-苦肼基自由基(DPPH,质量分数≥98.0% 批号KD1212YC13,上海源叶生物科技有限公司);维生素C(VC,批号 20131210,上海源叶生物科技有限公司)。
2 方法与结果 2.1 色谱条件色谱柱为ACQUITYTM UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm,Waters Corp.,Milford,美国);流动相为乙腈-0.2%甲酸水溶液,以55∶45等度洗脱12 min,柱温30 ℃,体积流量0.2 mL/min,检测波长296 nm,进样量2 μL。
2.2 对照品溶液的制备分别取对照品甲基麦冬高异黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B,精密称定,加甲醇溶解,分别制成含甲基麦冬高异黄酮A 0.054 mg/mL、甲基麦冬黄烷酮A 0.97 mg/mL、甲基麦冬黄烷酮B 1.33 mg/mL的混合对照品溶液。
2.3 DPPH溶液的配制准确称取25 mg的DPPH无水乙醇定容至100 mL量瓶中,配成250 μg/mL的母液,储存于4 ℃低温冰箱,从母液中取20 mL于100 mL量瓶中,DPPH质量浓度为50 μg/mL。
2.4 阳性对照的配制准确称取24.5 mg的VC,用新煮沸冷却后的蒸馏水定容至25 mL,即得到980 mg/mL的VC母液,待测时再稀释至所需的质量浓度。
2.5 供试品溶液的制备精确称取麦冬粉末1.000 0 g,用50 mL甲醇超声提取30 min,滤过,减压蒸干,加甲醇溶解,定容至5 mL的量瓶中,即得供试品溶液。
2.6 标准曲线的绘制分别精密吸取上述对照品溶液适量,按不同比例稀释,配制成含甲基麦冬高异黄酮A 0.5、1.6、2.7、3.8、4.9、5.9 μg/mL对照品溶液;含甲基麦冬黄烷酮A 4.9、9.7、14.6、19.4、24.3、29.1 μg/mL对照品溶液;含甲基麦冬黄烷酮B 5.3、10.6、16.0、21.3、26.6、31.9 μg/mL对照品溶液,按“2.1”项下色谱条件测定,记录色谱图及峰面积。以各对照品的质量浓度对数为横坐标,峰面积对数为纵坐标绘制标准曲线,得甲基麦冬高异黄酮A 的回归方程Y=1.075 3 X+4.060 8,R2=0.998 3,在0.24~7.1 μg/mL内线性关系良好;甲基麦冬黄烷酮A的回归方程Y=0.995 9 X+4.542 2,R2=0.997 7, 在2.1~43.6 μg/mL内线性关系良好;甲基麦冬黄烷酮B的回归方程Y=1.284 6 X+4.073 2,R2=0.999 2,在2.5~47.8 μg/mL内线性关系良好。
2.7 方法学考察 2.7.1 精密度试验精密吸取供试品溶液,按“2.1”项下色谱条件测定,连续进样6次,每次进样量2 μL。测得甲基麦冬高异黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B峰面积的RSD为 1.28%、1.67%、1.72%,表明仪器精密度良好。
2.7.2 重复性试验取同一批样品,按“2.5”项制备方法平行制备6份供试品溶液,进样2 μL,测定计算各成分的量。甲基麦冬高异黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B质量分数的RSD依次为0.13%、1.91%、1.09%,RSD均小于2%。
2.7.3 稳定性试验取同一份供试品溶液在0、2、4、8、12、24 h进样,在“2.1”项下色谱条件测定。测得甲基麦冬高异黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B峰面积的RSD依次为0.16%、1.75%、1.79%。
2.7.4 加样回收率试验称取6份已测定的麦冬药材,每份约1 g,精密称定,分别加入3种对照品溶液适量,按“2.5”项方法制备供试品溶液,在“2.1”项下色谱条件测定,计算回收率,结果甲基麦冬高异黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B的平均回收率分别为100.85%、101.54%、96.59%。
2.8 样品的测定取不同产地的麦冬样品,按照“2.5”项方法制备供试品溶液,按“2.1”项的色谱条件,采用外标法计算,色谱图见图 1,测定结果见表 2。杭麦冬高异黄酮的量均高于川麦冬,具有显著性差异;同一产地的麦冬2014年的量均比2013年的量高,同一产地不同时间采收的麦冬高异黄酮的量无明显差异。其中OJS-6中高异黄酮量低于OJS-7,说明施用膨大剂会影响麦冬有效成分的量。
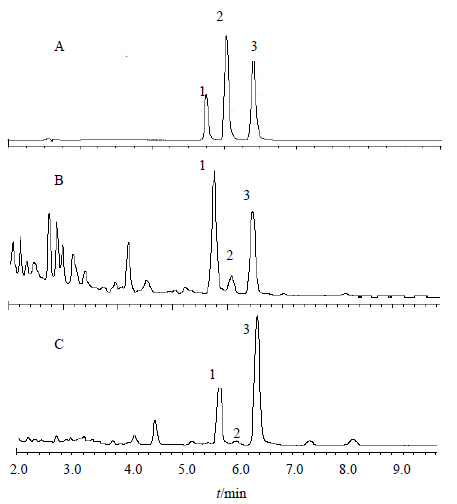 |
A-对照品溶液 B-川麦冬样品 C-杭麦冬样品 1-甲基麦冬高异黄酮A 2-甲基麦冬黄烷酮A 3-甲基麦冬黄烷酮B A-reference substance B-sample of OJS C-sample of OJZ 1-methylophiopogonone A 2-methylophiopogonanone A 3-methylophiopogonanone B 图 1 麦冬样品的UPLC色谱图 Fig.1 UPLC of O. japonicus samples |
| 表 2 川麦冬与杭麦冬中3种高异黄酮的定量测定结果及麦冬水提物清除DPPH自由基的IC50值 Table 2 Determination of three homoisoflavones and scavenging effects for DPPH (IC50) of water extract from OJS and OJZ |
取不同产地的麦冬干燥块根。粉碎过筛,第1次加入12倍量水浸泡30 min,超声提取40 min,15 000 r/min离心10 min,取上清液,第2次加入10倍量水超声提取30 min,离心,取上清液,合并2次上清液,减压浓缩至干,加水定容至10 mL量瓶中,制得麦冬水提物供试品溶液的质量浓度为0.1 g/mL,再从母液中分别吸取1.0、1.2、1.4、1.6、1.8、2.0 mL于10 mL量瓶中,制成不同质量浓度的麦冬水提物溶液。
2.9.2 麦冬水提物清除DPPH自由基IC50值的测定取2 mL不同质量浓度的麦冬水提物溶液,加入2 mL DPPH溶液,涡旋混合后,在室温下避光反应30 min,517 nm处测其吸光度(A)值,以A0表示空白对照吸光度,按公式计算各麦冬水提物对DPPH自由基的清除率(IR)。采用SPSS 19.0软件计算,根据清除率曲线求得IC50值,结果见表 2。
IR=1-(A1-A2)/A0
A0为2 mL DPPH+2 mL无水乙醇的吸光度,A1为2 mL样品+2 mL DPPH的吸光度,A2为2 mL样品+2 mL无水乙醇的吸光度
2.9.3 测定结果从表 2中可知川麦冬水提物IC50平均值(16.59 μg/mL)高于杭麦冬水提物的IC50平均值(14.48 μg/mL),阳性对照VC的IC50值为7.06 μg/mL。结果表明浙江地区表现出较强的抗氧化活性,同一产地的抗氧化活性也有差异但不显著。
3 讨论麦冬种质资源丰富,作用范围广,是重要的药用资源植物。四川和浙江为主要麦冬产区,种植历史悠久,川麦冬的生长周期短,仅栽培1年后便可收获,而且产量大,杭麦冬的生长周期长,需种植2到3年收获,在浙江道地药材中列为“浙八味”之一[12],由于杭麦冬的生长周期长,如今杭麦冬的种植逐渐减少,生产量逐渐下降[13]。
本实验从麦冬高异黄酮量的角度比较杭麦冬与川麦冬的质量差异性,采用HPLC法测定麦冬高异黄酮量的研究已有文献报道[14, 15],而本实验比较了UPLC-PDA与普通的液相色谱法,结果显示,超高效液相色谱法的分离效果好,分析时间短,灵敏度高,节约溶剂,与液质联用技术相比成本低,适合样品的定量测定。采用DPPH法测定麦冬水提物清除自由基的作用,麦冬的水提取物以水为溶媒,更为环保,无害;传统中药主要以水煎液入药,并且水提物中含有多糖、黄酮等成分,具有一定的抗氧化作用。但本研究对杭麦冬及川麦冬质量评价的研究存在着局限性,单从一类成分的量及体外的药效上不足以全面地评价中药材的产地差异性,应综合药效学,分子遗传性,显微、性状鉴定等多方面,多角度去评价,为进一步对麦冬质量评价的研究提供参考依据。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 马海波. 麦冬化学成分的研究 [D]. 北京: 北京中医药大学, 2013. |
| [3] | 蒋慧莲. 麦冬特征性成分及其质量标准研究 [D]. 杭州: 浙江中医药大学, 2013. |
| [4] | 陈 屏, 徐东铭, 雷 军. 麦冬化学成分及药理作用的研究现状 [J]. 长春中医学院学报, 2004, 20(1): 35-36. |
| [5] | 余伯阳, 徐国钧. 中药麦冬的资源利用研究 [J]. 中草药, 1995, 26(4): 205-225. |
| [6] | 陈有根, 戴俊东, 古海峰. 麦冬药材及其提取物中甲基麦冬黄烷酮A和B的HPLC法测定 [J]. 中草药, 2007, 38(11): 1640-1643. |
| [7] | Lin Y N, Zhu D N, Qi J, et al. Characterization of homoisoflavonoids in different cultivation regions of Ophiopogon japonicus and related antioxidant activity [J]. J Pharm Biomed Anal, 2010, 52(5): 757-762. |
| [8] | Tran M H, Cao Van T, Nguyen T D, et al. Homoisoflavonoid derivatives from the roots of Ophiopogon japonicus and their in vitro anti-inflammation activity [J]. Bioorg Med Chem Lett, 2010, 8(20): 2412-2416. |
| [9] | De Mey E, De Maere H, Dewulf L, et al. Assessment of the N-nitrosopiperidine formation risk from piperine and piperidine contained in spices used as meat product additives [J]. Eur Food Res Tech, 2014, 238(3): 477-484. |
| [10] | Yi F Z, Jin Q I, Zhu D N, et al. Homoisoflavonoids from Ophiopogon japonicus and its oxygen free radicals (OFRs) scavenging effects [J]. Chin J Nat Med, 2008, 6(3): 201-204. |
| [11] | 张易水, 刘祥忠, 李 华. 麦冬对衰老模型大鼠抗衰老作用的研究 [J]. 深圳中西医结合杂志, 1999, 19(6): 26-27. |
| [12] | 翟胜利.“道地药材”是保证中药疗效的根源 [J]. 首都医药, 2006(15): 34-37. |
| [13] | 简美玲, 李 荷, 毛润乾. 麦冬种质资源的研究进展 [J]. 广东药学院学报, 2011, 27(5): 549-551. |
| [14] | 金 虹, 王化东, 何 礼, 等. 川产麦冬及其须根组织学与麦冬皂苷量的对比研究 [J]. 中草药, 2014, 45(7): 1002-1005. |
| [15] | 贾 诚, 叶正良, 姜秀晶, 等. HPLC同时测定麦冬药材中3种黄酮类成分的含量 [J]. 中国药学杂志, 2011, 46(15): 1209-1211. |
 2015, Vol. 46
2015, Vol. 46


