马尿泡Przewalskia tangutica Maxim. 又名矮莨菪,是茄科(Solanaceae)马尿泡属Przewalskia Maxim. 植物,为我国西部特有植物;生长于海拔3 200~5 000 m的高山砾石地及干旱草原。在《晶珠本草》中有记载,它是藏药中的常用药,其根和种子及全草均可做药用,具有镇痛、解痉、杀虫、消炎等药效,用于胃肠痉挛疼痛、白喉、炭疽;外用疮疡、皮肤瘙痒[1, 2]。1984年,肖培根等[3]对茄科中的三分三、唐古特山莨菪、马尿泡等54种植物的托烷类生物碱有效成分进行分析,结果发现马尿泡中托烷类生物碱的量高,可以直接作为工业生产该类药物的原料。伴随着马尿泡药用价值的发现,大量野生资源被挖掘,一方面造成了马尿泡野生资源面临濒危,另一方面也造成了严重的生态破坏[4]。近年来研究表明,东莨菪碱作为一些药物合成的重要中间原料,也使得该化合物在国际市场上的需求增长很快,是莨菪碱的10倍[5, 6, 7]。选用化学合成的方法存在成本高、生产周期长、合成有效成分的产量较低[8]。因此,对高产东莨菪碱的马尿泡野生资源进行合理的开发研究,了解其高产东莨菪碱的机制,可能是解决东莨菪碱供求矛盾的有效途径,也是间接保护传统藏药资源,保护生态环境的有效办法。
目前,国内外对马尿泡的研究主要集中在细胞学、系统学、植物化学、组织培养等方面[4, 9, 10, 11, 12]。有关马尿泡组织培养的研究主要以野生芽为材料,受季节性限制且野生芽经消毒后不易存活,繁殖速率低等问题,严重限制该植物资源的开发利用[4]。传统的器官再生途径存在遗传变异大,可能会影响其体内生物碱的合成代谢,对后续研究产生影响。因此,建立在种子无菌苗基础上的茎段组织快速繁殖体系能够有效地解决上述问题。本实验对于保护马尿泡植物资源、实现可持续利用,研究次生代谢物质生物合成机制、实现工业化生产等,具有一定的参考价值。另外,为利用基因工程对马尿泡进行遗传改造,培育高产东莨菪碱的转基因植株或生物反应器提供了研究基础。
1 材料和方法 1.1 材料马尿泡种子于2013年9月16日采自青海省果洛州兴海县,海拔为4 200 m(东经99.9°,北纬35.7°),采集样品由中国科学院西北高原生物研究所陈世龙研究员鉴定为马尿泡Przewalskia tangutica Maxim.,取少数种子保存于青藏高原标本馆。
1.2 方法 1.2.1 种子无菌苗繁殖体系由本实验室建立,生长旺盛。 1.2.2 马尿泡茎段快速繁殖体系在无菌条件下,将种子无菌苗取出,切取带有腋芽的茎段接种在含有不同激素的MS培养基中(表 1),每瓶接种5个外植体,重复6次。培养条件:培养温度(25±2)℃,光照强度为3 000 lx,12 h/d光照条件下培养。
| 表 1 不同植物激素组合对马尿泡不定芽诱导和增殖的影响 Table 1 Effects of different phytohormone combination on inductivity and multiplication rates of P. tangutica adventitious buds |
由本实验室继代保存获得。
1.2.4 基本培养基MS培养基,附加8%琼脂和30 g/L蔗糖,pH 5.8。
1.2.5 HPLC法测定马尿泡不同组织中生物碱将组培苗从三角瓶中取出,洗干净根上带有的琼脂,按照根、茎、叶的组织类型收集,45 ℃烘干,密封,4 ℃低温保存材料。定量测定参考王环等[11]的测定方法。
2 结果与分析 2.1 不同质量浓度激素对马尿泡芽增殖的影响将带有腋芽的茎段转接至添加不同质量浓度的细胞分裂素和生长素的基本MS培养基上,实验结果表明(表 1),6-BA/NAA值为4时,从腋芽部位诱导出不定芽的诱导率最高,为96.67%,增殖系数为2.21。比值过高或者过低都不利于芽的分化。实验发现,在不添加NAA只添加6-BA的培养基中部分腋芽能产生不定芽,但不定芽的叶片黄化,且极易产生分支,不能持续生长,表明NAA对不定芽的正常生长发挥重要作用,最终筛选出最适合腋芽分化培养基为MS+6-BA 2.0 mg/L+NAA 0.5 mg/L。在最适培养基上,腋芽基部靠近培养基部位在接种后2周左右会产生少量浅绿色的愈伤组织,腋芽伸长,3周左右在愈伤组织周围陆续产生不定芽,成簇生长,芽体健壮(图 1-A)。
 | A-腋芽处分化出不定芽 B-生根分化 C-再生植株 D-愈伤组织 A-adventitious buds induced from axillary bud B-rooting differentiation C-regenerated plantlet D-callus 图 1 马尿泡组织培养的不同阶段 Fig.1 Different phases of tissue culture of P. tangutica |
将诱导产生的不定芽接种在含有不同质量浓度NAA的培养基中,结果如图 2所示,在一定范围内,随着NAA质量浓度的不断升高,不定芽上诱导产生不定根的数量和诱导率都有所提高。当NAA质量浓度为0.5 mg/L时,第3周左右,不定芽上陆续产生不定根,第4周统计,相对其他处理诱导率最高为71.67%,平均每个外植体上产生3.25个不定根(图 1-B),且组培苗生长健壮(图 1-C)。
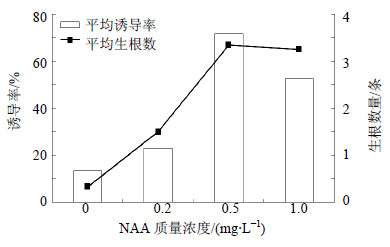 | 图 2 不同质量浓度 NAA 对马尿泡茎段生根的影响 Fig.2 Effects of NAA with different concentration on rooting of P. tangutica stems |
利用HPLC法测定马尿泡组培苗不同部位和愈伤组织中4种托烷类生物碱的量,结果表明(图 3),除愈伤组织中没有检测到山莨菪碱外,其他组织中均检测到4种生物碱活性成分,与野生植株相比,生物碱总量明显低于野生植株,仅为野生植株的百分之几。对马尿泡组培苗不同组织和愈伤组织中4种托烷类生物碱量的比较发现,组培苗根中总生物碱的量最高,高达141.25 μg/g,但不同类型生物碱在不同组织中的量变化特征存在差异,如东莨菪碱的量从高到低顺序为叶>根>茎>愈伤组织,而阿托品的变化顺序为根>愈伤组织>茎>叶。这一结果与王环等[11]测定的野生植株中地上部分4种生物碱的量均明显低于地下部分的结果不一致,问题可能在于其组织培养微环境对体内生物碱合成通路的关键酶产生影响而导致的。
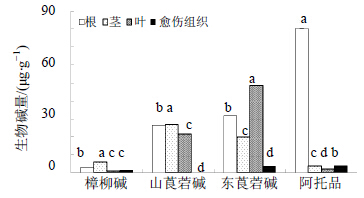 | 不同字母表示差异显著 (P<0.05) Significant differences were expressed by differrent lowercase (P < 0.05) 图 3 马尿泡组培苗不同组织中4种托烷类生物碱的量 Fig.3 Contents of four alkaloids in different tissues of P. tangutica seedlings |
植物激素在植物离体条件下器官再生途径中扮演着重要的角色,一般认为细胞分裂素/生长素的比值高有利于芽的分化,比值低有利于根的分化,合适的激素配比是诱导植株再生的重要条件之一[4]。本实验建立了种子无菌苗基础上的茎段快繁体系,筛选出最适合芽增殖培养基为MS+6-BA 2.0 mg/L+NAA 0.5 mg/L,诱导率最高为96.67%,最适合不定芽生根培养基为MS+NAA 0.5 mg/L,根的诱导率最高,为71.67%,能够在短时间内培育出长势一致的幼苗,连续继代培养可以有效保存马尿泡的种质资源。马尿泡野生种子→种子无菌苗→再生苗的种质资源保存途径与传统的器官再生途径相比,可以实现野生种子在4 ℃低温条件下的长期保存,并保证需要时在短期内可以获得长势一致的试管苗供研究使用,为马尿泡种质资源的长期保存提供了有效途径,同时也可能为其他面临濒危的高原特有药用植物资源的种质资源保存提供一个可行的途径。
郑光植等[13]通过对茄科药用植物三分三的组织培养研究,反驳了曾经普遍被人们接受的茄科植物根是莨菪碱和东莨菪碱惟一或者主要合成部位的结论,提出了任何药用植物细胞或者组织在离体条件下都具有“母体”那种合成药用成分的能力的观点。研究表明,外植体的选择不仅影响愈伤组织、发状根和再生植株的诱导率,也对培养细胞和发根中的次生代谢产物的量产生影响[14, 15, 16, 17, 18]。能否提供具有合成生物碱全能性的试管苗材料是后续对马尿泡植物进行遗传改良,获得高效生产东莨菪碱的转化植株或生物反应器,研究生物碱合成调控机制的基础。本实验利用HPLC法对马尿泡组培苗不同组织中4种托烷类生物碱的量测定结果表明,组培苗根中总生物碱量最高,高达141.25 μg/g,不同类型生物碱在不同组织中的量的变化特征存在差异,这可能与器官建成过程中基因的差异性表达有关,但根、茎、叶都具有合成4种生物碱的能力。植物组织器官培养是广泛用于合成药用植物次生代谢产物的主要手段,如生产紫杉醇的细胞培养[19]、生产生物碱和多糖的铁皮石斛的原球茎培养(微器官繁殖)[20]、生产托品烷类生物碱的天仙子双基因转化发根培养[16],都取得了很好的研究成果。大量研究表明,次生代谢产物在植物体内的合成存在位置差异,如莨菪碱和东莨菪碱的量在曼陀罗不同器官存在差异[21],控制东莨菪碱合成的关键酶基因H6H主要在颠茄根的中柱鞘细胞高效表达[22]。本实验对进一步研究马尿泡次生代谢产物生物合成机制,实现资源的可持续利用和工业化生产具有一定的参考价值。
| [1] | 中国科学院西北高原生物研究所. 藏药志 [M]. 西宁: 青海人民出版社, 1991. |
| [2] | 刘尚武. 青海植物志 [M]. 西宁: 青海人民出版社, 1991. |
| [3] | 肖培根, 何丽一, 王立为. 莨菪类藏药的研究 [J]. 中药通报, 1984, 9(1): 8-11. |
| [4] | 徐文华, 周国英, 陈桂琛, 等. 藏药马尿泡离体快繁技术研究 [J]. 中草药, 2009, 40(2): 297-298. |
| [5] | 杨春贤, 周启贵, 陈 敏, 等. PMT和H6H双基因共转化颠茄发根的植株再生 [J]. 中草药, 2007, 38(10): 1548-1551. |
| [6] | 杨春贤, 阳义健, 彭梅芳, 等. 颠茄发根培养系统的建立 [J]. 西南师范大学学报: 自然科学版, 2006, 31(2): 115-118. |
| [7] | Bruhn J G. The use of natural-products in modern medicien [J]. Atca Pharm Nord, 1989, 1(3): 117-130. |
| [8] | Drager B. Tropinone reductases enzeymes at the branch point of tropane alkaloid metabolism [J]. Phytochemistry, 2006, 67(4): 327-337. |
| [9] | 杨冬之. 茄科天仙子族: 结构、分化和系统关系 [D]. 北京: 中国科学院研究生院, 2002. |
| [10] | 张发起, 高庆波, 陈世龙, 等. 青海省三种茄科植物种子微形态特征 [J]. 植物分类与资源学报, 2013, 35(3): 290-294. |
| [11] | 王 环, 潘 莉, 张晓峰. HPLC法测定天仙子和马尿泡中3种托烷类生物碱的含量 [J]. 西北药学杂志, 2002, 17(1): 9-10. |
| [12] | Gong H, Chen G, Li F X, et al. Involvement of G6PDH in heat stress tolerance in the calli from Przewalskia tangutica and Nicotiana tabacum [J]. Biol Plant, 2012, 56(3): 422-430. |
| [13] | 郑光植, 何静波, 王世林. 药用植物组织培养研究-III 三分三愈伤组织的分化对莨菪碱和东莨菪碱含量的影响 [J]. 植物生理学报, 1980, 6(4): 377-381. |
| [14] | Oksman-Caldentey K M. Tropane and nicotine alkaloid biosynthesis novel approaches toward biotechnological production of plant-derived pharmaceuticals [J]. Cur Pharm Biotechnol, 2007, 8(4): 203-210. |
| [15] | Moyano E, Palazon J, Oksman-Caldentey K M, et al. Biotransformation of hyoscyamine into scopolamine in transgenic tobacco cell cultures [J]. J Plant Physiol, 2007, 164(4): 521-524. |
| [16] | Zhang L, Ding R X, Tang K X, et al. Engineering tropane biosynthetic pathway in Hyoscyamus niger hairy root cultures [J]. PNAS, 2004, 101(17): 6786-6791. |
| [17] | 王 莉, 张 辉, 朱 江, 等. 何首乌毛状根的诱导及其培养 [J]. 生物工程学报, 2002, 18(1): 69-71. |
| [18] | 陈永勤, 朱蔚华. 不同种类红豆杉愈伤组织的诱导及紫杉醇含量的差异 [J]. 中草药, 2000, 31(3): 216-218. |
| [19] | 李志良, 李干雄, 饶秋容, 等. 红豆杉细胞培养中紫杉醇高产细胞株的筛选及其稳定性分析 [J]. 植物资源与环境学报, 2007, 16(1): 62-65. |
| [20] | 陈晓梅. 真菌诱导子对铁皮石斛原球茎生长及次生代谢产物的影响 [D]. 北京: 中国协和医科大学, 2004. |
| [21] | Iranbakhsh A, Oshaghi M A, Majd A. Distribution of atropine and scopolamine in different organs and stages of development in Datura stramonium L. (Solanaceae). Structure and ultrastructure of biosynthesizing cells [J]. Acta Biol Cracoviensia Series Bot, 2006, 48(1): 13-18. |
| [22] | Suzuki K I, Yun D J, Chen X Y, et al. An Atropa belladonna hyoscyamine 6β-hydroxylase gene is differentially expressed in the root pericycle and anthers [J]. Plant Mol Biol, 1999, 40(1): 141-143. |
 2015, Vol. 46
2015, Vol. 46


