2. 国药控股天津有限公司, 天津 300040
2. Chinese Medicine Holding Tianjin Co., Ltd., Tianjin 300040, China
骨碎补为水龙骨科植物槲蕨Drynaria roosii Nakaike的干燥根茎,具有疗伤止痛、补肾强骨等功效,常用于跌扑闪挫、筋骨折伤、肾虚腰痛、筋骨痿软、耳鸣耳聋、牙齿松动等症;外用治疗斑秃、白癜风等[1, 2]。骨碎补主要含有黄酮、三萜、苯丙素以及挥发油类等化学成分[3]。本课题组研究表明骨碎补中含有一系列的呋喃衍生物[4],本实验继续研究骨碎补75%乙醇提取物的化学成分。采用醋酸乙酯萃取法,结合正相硅胶、反相ODS、Sephadex LH-20及制备高效液相等柱色谱法分离鉴定了7个化合物,经理化性质及波谱方法鉴定其结构分别为:12-O-咖啡酰基-12-羟基正十二烷酸甲酯(12-O-caffeoyl-12-hydroxyldodecanoic acid methyl ester,1)、对羟基苯丙酸(p-hydroxy benzenepropanoicacid,2)、3,4-二羟基-苯乙醇8-O-β-D-吡喃阿洛糖苷(3,4-dihydroxyphenyl ethyl 8-O-β-D-allopyranoside,3)、木犀草素7-O-β-D-吡喃葡萄糖苷(luteolin 7-O-β-D-glucopyranoside,4)、补骨脂素(psoralen,5)、原儿茶酸(protocatechoic acid,6)、咖啡酸(caffeic acid,7),其中化合物1为新化合物,2~5为首次从槲蕨属植物分离得到。
1 仪器与材料Bruker AVANCEIII 500超导核磁共振波谱仪(瑞士布鲁克公司);Agilent 6410(三重四级杆)及6520(四级杆-飞行时间)系列质谱仪(美国安捷伦公司);制备高效液相色谱仪为Agilent 1200 series(美国安捷伦公司),制备色谱柱:Agilent Eclipse XDB-C18柱(250 mm×21.2 mm,7 μm);Rudolph Autopol® IV automatic polarimeter旋光仪(l=50 mm,美国鲁道夫公司)。薄层色谱板GF254(天津思利达科技有限公司);柱色谱硅胶(青岛海洋化工厂分厂);反相ODS(50 μm,日本YMC公司);Sephadex LH-20(美国GE公司);分析纯石油醚、甲醇、乙醇、醋酸乙酯及色谱纯甲醇等有机溶剂(天津市康科德科技有限公司)、二氯甲烷、氯仿(分析纯,天津市江天化工技术有限公司)。
骨碎补药材购买于河北省安国市药材市场,经天津中医药大学第二附属医院刘宗昌主任药师鉴定为水龙骨科植物槲蕨Drynaria roosii Nakaike的干燥根茎,标本(20120301)存放于天津中医药大学第二附属医院。
2 提取与分离骨碎补(20 kg)用8倍量体积分数75%乙醇回流提取2次,每次2 h,滤过,合并滤液,减压回收,真空干燥得干膏2 994 g。取干膏2 400 g,加去离子水2.5 L混悬,用等体积的醋酸乙酯萃取3次,合并醋酸乙酯层,减压浓缩得醋酸乙酯萃取物400 g。对萃取物进行硅胶柱色谱分离,二氯甲烷-甲醇(100∶0→0∶100)梯度洗脱,TLC检识,合并相同组分,得5个组分Fr. 1~5。
Fr. 1(75 g)经硅胶柱色谱,石油醚-醋酸乙酯(100∶0→0∶100)梯度洗脱,TLC检识,合并相同组分,得到8个组分,其中Fr. 1.3(675 mg)经Sephadex LH-20(甲醇洗脱)和制备高效液相色谱(75%甲醇洗脱)分离得到了化合物5(18 mg);Fr. 2(70 g)经硅胶柱色谱,石油醚-醋酸乙酯(100∶0→0∶100)梯度洗脱,得到8个组分,其中Fr. 2.8(3 143 mg)经制备高效液相色谱(65%甲醇洗脱)分离得到化合物2(120 mg);Fr. 3(60 g)经硅胶柱色谱,氯仿-甲醇(100∶0→0∶100)梯度洗脱,得到10个组分,其中Fr. 3.10(2 230 mg)经Sephadex LH-20(甲醇洗脱)和制备高效液相色谱(65%甲醇洗脱)分离得到化合物1(32 mg);Fr. 4(100 g)经ODS柱色谱,甲醇-水(30∶70→100∶0)梯度洗脱,得到11个组分,其中Fr. 4.1(8.56 g)经Sephadex LH-20(甲醇洗脱)和制备高效液相色谱(30%甲醇洗脱)分离得到化合物4(140 mg);Fr. 4.2(5.62 g)经制备高效液相色谱(40%甲醇洗脱)分离得到化合物6(1 450 mg);Fr. 4.4(3.25 g)经制备高效液相色谱(55%甲醇洗脱)分离得到化合物3(517 mg)和7(27 mg)。
3 结构鉴定化合物1:白色无定形粉末,易溶于甲醇。[α]20D +4.9°(c 0.1, MeOH)。在负离子HR-ESI-TOF-MS谱中,可以看到准分子离子峰m/z: 391.211 9 [M-H]-(C22H31O6,计算值391.212 6),推测其分子式为C22H32O6。红外吸收图谱中3 340和1 729 cm-1分别提示羟基和羰基的存在。紫外图谱中在325和300 nm有最大吸收。在1H-NMR (500 MHz, CD3OD) 谱低场区,可以看到1组ABX芳香氢信号δ 7.03 (1H, d, J = 1.5 Hz, H-2′), 6.94 (1H, dd, J = 1.5, 8.0 Hz, H-6′), 6.77 (1H, d, J = 8.0 Hz, H-5′)];1组反式烯氢信号δ 7.52 (1H, d, J = 16.0 Hz, H-7′), 6.25 (1H, d, J = 16.0 Hz, H-8′);在中低场区可以观测到1组连氧氢信号δ 4.16 (2H, t, J = 6.5 Hz, H-12);在高场区可以看到1组脂肪氢信号δ 2.30 (2H, t, J = 7.0 Hz, H-2), 1.69 (2H, m, H-11), 1.59 (2H, t, J = 7.0 Hz, H-3), 1.39 (2H, m, H-6), 1.30 (12H, m, H-4, 5, 7~10),氢谱中还可看到1个甲氧基信号δ 3.64 (3H, s, 1-OCH3)。在13C-NMR (125 MHz, CD3OD) 谱中出现6个相应的芳香碳信号δ 127.8 (C-1′), 115.2 (C-2′), 146.9 (C-3′), 149.6 (C-4′), 116.5 (C-5′) 和123.0 (C-6′);1组双键碳信号δ 146.8 (C-7′), 115.3 (C-8′);2个羰基碳信号δ 169.5 (C-9′) 和176.1 (C-1);10个脂肪碳信号:δ 34.8 (C-2), 29.9 (C-11), 27.1 (C-6), 26.1 (C-3), 30.2~30.6 (C-4, 5, 7~10);1个连氧碳信号δ 65.6 (C-12),以及1个甲氧基信号δ 52.0。经数据对比发现化合物1与12-O-咖啡酰基-12-羟基正十二烷酸[5]仅相差1个甲氧基。HMBC谱(图 1)中可以观测到δ 3.64 (-OCH3) 与δ 176.1 (C-1) 相关;δ 4.16 (H-12) 与δ 169.5 (C-9′) 相关,分别表明甲氧基连于C-1位;9′位羰基连与C-12位相连。经HSQC、HMBC二维谱验证化合物的碳氢直接相关和重要的远程相关信息,最终确定化合物1为12-O-咖啡酰基-12-羟基正十二烷酸甲酯,经SCI finder检索,该化合物为1个新化合物,命名为骨碎补烷酸酯A。具体核磁数据见表 1。
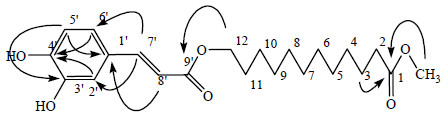 | 图 1 化合物1的重要HMBC相关Fig.1 Key HMBC correlations of compound 1 |
| 表 1 化合物1的1H-NMR和13C-NMR数据 Table 1 1H-NMR and 13C-NMR data of compound 1 |
化合物2:白色无定形粉末。ESI-MS m/z: 167.0[M+H]+,推测其相对分子质量为166。在1H-NMR (500 MHz, CD3OD) 谱低场区,可以看到1组AA′BB′芳香氢信号δ 6.69 (2H, d, J = 8.5 Hz, H-2, 6), 7.02 (2H, d, J = 8.5 Hz, H-3, 5),在高场区可以看到1组脂肪氢信号δ 2.80 (2H, t, J = 7.5 Hz, H-7), 2.53 (2H, t, J = 7.5 Hz, H-8)。在13C-NMR (125 MHz, CD3OD) 谱上出现4个相应的芳香碳信号δ 116.2, 130.3, 133.0和156.8,进一步验证化合物存在AA′BB′对称结构,13C-NMR谱中还观测到δ 177.0,推测为羧基碳信号,高场区δ 31.3和37.2分别为C-7和C-8信号。经1H、13C-NMR谱数据推测,并与文献报道对比[6],确定化合物2为对羟基苯丙酸。
化合物3:白色无定形粉末。ESI-MS m/z: 317.0 [M+H]+,推测其相对分子质量为316。在1H-NMR (500 MHz, DMSO-d6) 谱可以看到芳香氢信号δ 6.62 (1H, brs, H-2), 6.63 (1H, d, J = 8.0 Hz, H-6), 6.48 (1H, d, J = 8.0 Hz, H-5);脂肪氢信号δ 2.66 (2H, m, H-7), 3.85 (1H, dt, J = 9.5, 16.5 Hz, H-8b), 3.48 (1H, dt, J = 9.5, 16.5 Hz, H-8a);以及1组β-D-阿洛糖信号δ 4.47 (1H, d, J = 8.0 Hz, H-1′), 3.13 (1H, dd, J = 2.0, 8.0 Hz, H-2′), 3.82 (1H, brd, J = 2.0 Hz, H-3′), 3.27 (1H, dd, J = 2.0, 9.5 Hz, H-4′), 3.47 (1H, dd, J = 6.0, 9.5 Hz, H-5′), 3.42 (1H, dd, J = 6.0, 11.5 Hz, H-6′a), 3.64 (1H, d, J = 11.5 Hz, H-6′b)。在13C-NMR (125 MHz, DMSO-d6) 谱上出现6个相应的芳香碳信号δ 129.2 (C-1), 116.2 (C-2), 144.9 (C-3), 143.4 (C-4), 115.4 (C-5) 和119.4 (C-6);1组脂肪碳信号δ 35.1 (C-7), 69.8 (C-8);1组β-D-阿洛糖信号δ100.4 (C-1′), 70.5 (C-2′), 71.3 (C-3′), 67.4 (C-4′), 74.3 (C-5′) 和61.3 (C-6′)。经1H、13C-NMR谱数据推测,并与文献报道对比[7, 8],确定化合物3为3,4-二羟基-苯乙醇8-O-β-D-吡喃阿洛糖苷。
化合物4:黄色无定形粉末。ESI-MS m/z: 448.9 [M]+,推测其相对分子质量为448。1H-NMR (500 MHz, DMSO-d6) 谱低场区,可以看到δ 12.99 (1H, s) 为5位羟基与羰基缔合信号;芳香氢信号δ 6.45 (1H, d, J = 2.0 Hz, H-6), 6.79 (1H, d, J = 2.0 Hz, H-8) 和6.75 (1H, s, H-3);δ 6.91 (1H, d, J = 8.5 Hz, H-5′), 7.42 (1H, d, J = 2.0 Hz, H-2′) 和7.45 (1H, dd, J = 2.0, 8.5 Hz, H-6′);1组β-D-葡萄糖信号δ 5.08 (1H, d, J = 7.5 Hz, H-1″), 3.28 (1H, m, H-2″), 3.30 (1H, m, H-3″), 3.19 (1H, m, H-4″), 3.45 (1H, m, H-5″), 3.71 (1H, dd, J = 4.0, 11.5 Hz, H-6″b), 3.49 (1H, m, H-6″a)。在13C-NMR (125 MHz, DMSO-d6) 谱上出现黄酮苷元相应的15个碳信号:δ 94.6 (C-8), 99.4 (C-6), 103.1 (C-3), 105.2 (C-10), 113.5 (C-2′), 115.9 (C-5′), 119.1 (C-6′), 121.3 (C-1′), 145.7 (C-3′), 149.8 (C-4′), 156.8 (C-9), 161.0 (C-5), 162.8 (C-7), 164.4 (C-2) 和181.8 (C-4);β-D-葡萄糖信号:δ 99.8 (C-1″), 73.0 (C-2″), 76.3 (C-3″), 69.4 (C-4″), 77.2 (C-5″), 60.5 (C-6″)。经1H、13C-NMR谱数据推测,并与文献报道对比[9],确定化合物4为木犀草素7-O-β-D-吡喃葡萄糖苷。
化合物5:白色结晶。ESI-MS m/z: 187.1 [M]+,推测其相对分子质量为186。在1H-NMR (500 MHz, DMSO-d6) 谱低场区,可以看到1组邻位耦合的芳香氢信号δ 6.44 (1H, d, J = 9.5 Hz, H-3), 8.18 (1H, d, J = 9.5 Hz, H-4);还可以观测到2个呋喃氢邻位耦合信号δ 7.10 (1H, d, J = 2.5 Hz, H-4′), 8.11 (1H, d, J = 2.5 Hz, H-5′),以及2个孤立芳香氢信号δ 7.73 (1H, s, H-5), 8.02 (1H, s, H-8)。核磁数据经文献报道对比[10],确定化合物5为补骨脂素。
化合物6:白色无定形粉末。ESI-MS m/z: 155.0 [M]+,推测其相对分子质量为154。在1H-NMR (500 MHz, DMSO-d6) 谱低场区,可以看到1组ABX芳香氢信号δ 7.34 (1H, d, J = 2.0 Hz, H-2), 7.29 (1H, dd, J = 2.0, 8.0 Hz, H-6), 6.78 (1H, d, J = 8.0 Hz, H-5)。在13C-NMR (125 MHz, DMSO-d6) 谱上出现6个相应的芳香碳信号δ 121.6 (C-1), 116.5 (C-2), 144.8 (C-3), 149.9 (C-4), 115.1 (C-5) 和121.8 (C-6);1个羰基碳信号δ 167.2。经1H、13C-NMR谱数据推测,并与文献报道对比[11],确定化合物6为原儿茶酸。
化合物7:白色无定形粉末。在正离子ESI-MS谱中,可以看到准分子离子峰m/z: 181.1 [M]+,推测其相对分子质量为180。在1H-NMR (500 MHz, CD3OD) 谱低场区,可以看到1组ABX芳香氢信号:δ 7.05 (1H, d, J = 1.0 Hz, H-2), 6.94 (1H, dd, J = 1.0, 8.0 Hz, H-6), 6.78 (1H, d, J = 8.0 Hz, H-5),1组反式烯氢信号δ 7.54 (1H, d, J = 16.0 Hz, H-7), δ 6.22 (1H, d, J = 16.0 Hz, H-8)。在13C-NMR (125 MHz, CD3OD) 谱上出现6个相应的芳香碳信号δ 127.8 (C-1), 115.2 (C-2), 146.8 (C-3), 149.4 (C-4), 116.5 (C-5) 和122.9 (C-6);1组双键碳信号δ 147.1 (C-7), 115.5 (C-8);1个羰基碳信号δ 171.1 (C-9)。经1H、13C-NMR谱数据推测,并与文献报道对比[12],确定化合物7为咖啡酸。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 彭 双, 韩立峰, 王 涛, 等. 骨碎补中的化学成分及药理作用研究进展 [J]. 天津中医药大学学报, 2012, 31(2): 122-125. |
| [3] | 李顺祥, 龙 勉, 张志光. 骨碎补的研究进展 [J]. 中国中医药信息杂志, 2002, 9(11): 75-78. |
| [4] | 隋洪飞. 骨碎补化学成分分离鉴定 [J]. 内蒙中医药, 2015, 34(5): 142-143. |
| [5] | Wang X L, Wang N L, Gao H, et al. Phenylpropanoid and flavonoids from osteoprotective fraction of Drynaria fortunei [J]. Nat Prod Res, 2010, 24(13): 1206-1213. |
| [6] | Owen R W, Haubner R, Mier W, et al. Isolation, structure elucidation and antioxidant potential of the major phenolic and flavonoid compounds in brined Olive Drupes [J]. Food Chem Toxicol, 2003, 41(5): 703-717. |
| [7] | Franzyk H, Olsen C E, Jensen S R. Dopaol 2-keto-and 2, 3-diketoglycosides from Chelone obliqua [J]. J Nat Prod, 2004, 67(6): 1052-1054. |
| [8] | Liang Y H, Ye M, Yang W Z, et al. Flavan-3-ols from the rhizomes of Drynaria fortunei [J]. Phytochemistry, 2011, 72(14/15): 1876-1882. |
| [9] | Lu Y R, Foo L Y. Flavonoid and phenolic glycosides from Salvia officinalis [J]. Phytochemistry, 2000, 55(3): 263-267. |
| [10] | 范菊娣. 从补骨脂中分离鉴定补骨脂素和异补骨脂素 [J]. 贵阳医学院学报, 2003, 28(2): 171-174. |
| [11] | Flamini G, Antognoli E, Morelli I. Two flavonoids and other compounds from the aerial parts of Centaurea bracteata from Italy [J]. Phytochemistry, 2001, 57(4): 559-564. |
| [12] | Teng R W, Wang D Z, Wu Y S, et al. Nmr assignments and single-crystal X-ray diffraction analysis of deoxyloganic acid [J]. Magn Reson Chem, 2005, 43(1): 92-96. |
 2015, Vol. 46
2015, Vol. 46


