石头花属Gypsophila L. 为石竹目石竹科植物,约150种,分布于亚洲、欧洲及南美洲。我国有18种1变种[1]。石头花属植物可供药用,也可供观赏。其具有清热凉血、活血化瘀、消肿止痛、化腐生肌等功效,可治虚劳骨蒸、阴虚久疾、小儿疳热等[2,3]。现代研究表明,该属主要药用种类有长蕊石头花(又名霞草、丝石竹)、大叶石头花、头状石头花等,其中药用成分主要为皂苷类。其皂苷类成分也被证实在抗肿瘤、免疫调节等方面有显著的活性。本文着重阐述石头花属的植物资源、主要化学成分、药理作用3个方面的研究进展。 1 中国石头花属植物的分类
我国石头花属植物大多分布于西北、华北和东北地区,新疆是其分布和分化集中地,种数往东递减。河北石头花、华山石头花、刺序石头花和细叶石头花为我国特有种[4]。目前研究发现长蕊石头花、草原石头花、大叶石头花等可供药用。按多年生或一年生、茎直立或斜升、植株高矮、苞片干膜质或叶状、花萼有无白色间隔及宽狭、花序形状、密集或疏散、有无刺、花梗粗细等将中国石头花属种分为5组[4]。其种类及植物资源分布见表 1[4,5]。
| 表 1 中国石头花属种类及植物资源分布 Table 1 Species in Gypsophila L. and their resource distribution in China |
黄酮类化合物是许多中药中的有效成分,具有保肝、降血压、抗菌、抗心律失常等作用。此外,其还具有抗自由基、抑制肿瘤细胞和抗致癌促进因子作用,可以防止机体的脂质过氧化反应[6]。目前从石头花属植物中共发现10个黄酮类化合物,具有黄酮(I)和双苯吡酮(II)2种母核(图 1),化合物名称及取代基见表 2。
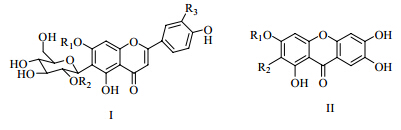 | 图 1 石头花属植物的黄酮类成分母核 Fig. 1 Parent nuclei of flavonoids from plants in Gypsophila L. |
| 表 2 石头花属植物的黄酮类成分 Table 2 Flavonoids from plants in Gypsophila L. |
目前,该属植物中的环肽类化合物结构式、名称和植物来源见图 2和表 3。
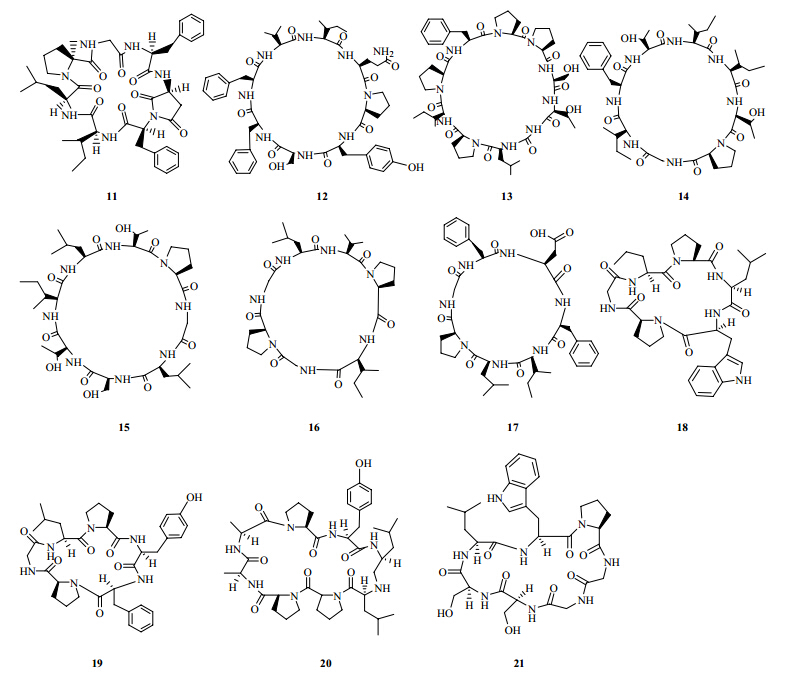 | 图 2 石头花属植物的环肽类成分结构 Fig. 2 Chemical structures of cyclic peptides from plants in Gypsophila L. |
| 表 3 石头花属植物的环肽类化合物 Table 3 Cyclic peptides from plants in Gypsophila L. |
目前,从该属中分离得到了2种母核的甾醇类化合物(图 3)。化合物名称、取代基和植物来源见表 4。
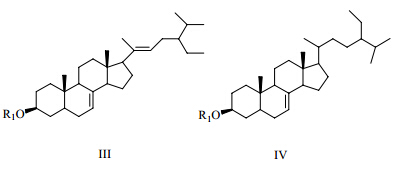 | 图 3 石头花属植物的甾醇类成分母核 Fig. 3 Parent nuclei of sterols from plants in Gypsophila L. |
| 表 4 石头花属植物的甾醇类成分 Table 4 Sterols from plants in Gypsophila L. |
采用顶空固体微萃取法、索氏提取法及水蒸气蒸馏法从长蕊石头花中提取挥发性成分,并用GC-MS联用技术确定了131种成分,主要为苯及苯的同系物、醇醚类、烷烃类、烯类、酯类、茚类、芴类及杂环类。主要化合物有3-methyl-butanal(26)、squalene(27)、1,2-benzenedicarboxylic acid diisooctyl ester(28)、naphazoline(29)、2- methyl-naphthalene(30)、4-methyl-1-pentanol(31)、anethole(32)、benzeneacetaldehyde(33)、methyl hexadecanoate(34)、naphazoline(35)、2,3- dihydro-4-methyl-1H-indene(36)、phenmetrazine(37)等[19,20,21,22]。 2.5 三萜及其皂苷类
三萜及其皂苷类成分不仅是该属植物的主要化学成分,也是具有生物活性的有效成分。该属植物中的三萜类成分几乎都是五环三萜。石头花属中主要的三萜皂苷类化合物见图 4和表 5。
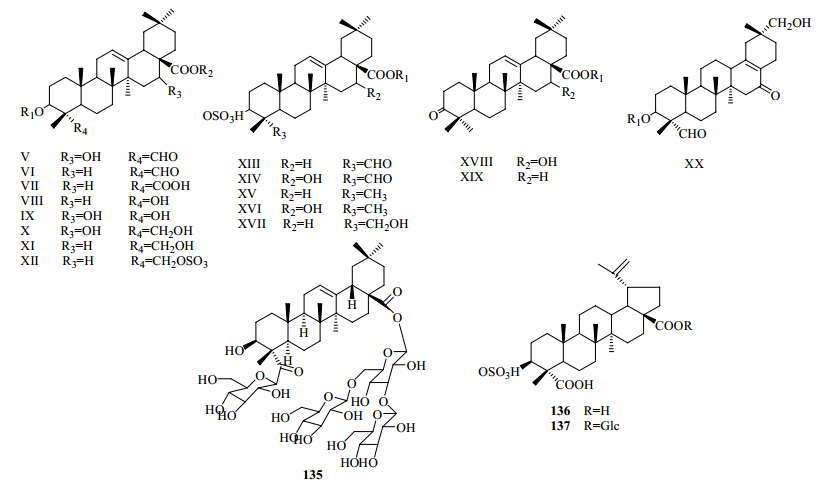 | 图 4 石头花属植物的三萜类成分母核及部分结构 Fig. 4 Parent nuclei and some structures of triterpenoids from plants in Gypsophila L. |
| 表 5 石头花属植物的三萜类成分 Table 5 Triterpenoids from plants in Gypsophila L. |
石头花属中还含有其他化合物,如tetracosyl caffeate[7](138)、alternariol[7](139)、alternariol monomethylether[7](140)、syringaldehyde[8](141)、 arbutin[8](142)、octadecyl caffeate[16,17,18](143)、ferulic acid[17,18](144)、p-hydroxycinnamic acid[48](145)、dihydroferulic acid[48](146)、syringic acid[48](147)、vanillic acid[48](148)等。上述部分化合物的结构式见图 5。
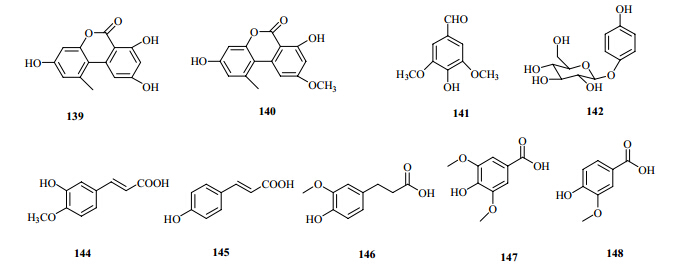 | 图 5 石头花属植物的其他成分结构式 Fig. 5 Chemical structures of other compounds from plants in Gypsophila L. |
采用MTT法及8种人源肿瘤细胞株(KB、PC-3M、A549、KeTr3、A2780、SMMC-7721、HT29、SGC7901)对霞草(长蕊石头花)中霞草皂苷(43)进行细胞毒活性评价,发现其具有一定的体外抑瘤作用,IC50小于50 μg/mL[18,37,49,50,51]。研究还表明,ip 7.5、10.0 mg/kg霞草皂苷(43)对小鼠S180肉瘤和H22肝癌具有明显的抑制作用,抑瘤率分别为32.8%、51.1%和42.3%、45.8%,与对照组比较均具有统计学意义,虽然抑瘤率不及阳性对照组,但不良反应较轻[49]。
Arslan等[31]发现石头花属植物G. pilulifera Boiss. & Heldr. 中化合物44对A549细胞具有明显的选择抑制活性(IC50>16 μmol/L)。 3.2 抗肥胖作用
韩立坤等[52]通过探讨丝石竹水层的总皂苷部位对高脂肪饮食诱发小鼠肥胖的影响,发现其对胰脂肪酶活性呈浓度依赖性抑制,对血浆三酰甘油升高有抑制作用;对高脂肪饮食负荷而导致的体质量及脂肪量增加有抑制作用,证实其具有抗肥胖作用。Zheng等[30]通过测定油酸(甘油三油酸酯中的油酸)的释放率测定脂肪酶活性,发现长蕊石头花中的皂苷成分43、71、135具有胰脂肪酶抑制作用,当这3种化合物的质量浓度均为1 mg/mL时,对脂肪酶活性抑制率分别为58.2%、99.2%和50.3%,具有明显的抗肥胖作用。 3.3 抗糖尿病作用
石头花属中的长蕊石头花、圆锥石头花中的部分皂苷具有抗糖尿病作用;有很强的α-葡萄糖苷酶抑制活性[25,36,37]。α-葡萄糖苷酶抑制剂可以阻碍膳食碳水化合物的吸收,抑制餐后高血糖症。Luo等[25]发现长蕊石头花中的化合物65、118、132具有比阿卡波糖更强的α-葡萄糖苷酶抑制活性。 3.4 保肝作用
从G. trichotoma Wender. 中分得的apigenin-O/ C-diglucoside具有抑制CCl4sub>诱导的肝脏氧化损伤的保护作用[53]。从缕丝花中分得的isoorientin-2″-O-α- L-arabinopyranosyl(8)具有抗肝纤维化甚至肝硬化的作用[11]。
3.5 免疫抑制作用
Luo等[25]研究表明,从霞草根中分离得到的化合物38在10~100 μg/mL时能有效增加粒细胞的吞噬作用(40%~75%),在100 ng/mL~1 pg/mL时,表现出对T细胞活化的免疫抑制作用。
3.6 抗氧化作用
黄海兰等[54]发现霞草提取物具有较强的抗氧化活性。利用DPPH法、Marklund、邻二氮菲-Fe2+氧化法及磷钼络合物法测定各提取物抗氧化活性,同时与合成抗氧化剂BHT进行对照。结果表明,在实验所测浓度下,醋酸乙酯萃取物清除DPPH自由基能力比同浓度的BHT强,其还原能力与BHT非常接近。石油醚萃取物具有很强的清除羟自由基和过氧自由基能力,且均高于同浓度的BHT。张凤梅等[55]发现满天星中的黄酮类化合物isoorientin-2″- O-α-L-arabinopyranosyl(8)具有较高的抗氧化活性(IC50=9.8 μmol/L)。
3.7 其他
霞草挥发油中的化学成分如squalene(27)具有抗肿瘤、抗疲劳、抗感染、免疫调节和抗氧化功效,广泛应用于医药、食品、化妆品工业等领域[21];naphazoline(29)为拟肾上腺素药,有收缩血管作用,用于过敏性及炎症性鼻充血、急慢性鼻炎、眼充血等,对细菌性过敏性结膜炎亦有效,并能减轻眼睑痉挛;anethole(32)对因化疗或放疗导致的白细胞减少症及其他原因引起的白细胞减少症有一定疗效;phenmetrazine(37)为拟交感神经药,与苯丙胺类似,作用于下丘脑饱感中枢,并影响糖代谢致食欲减退,体质量下降,可用于治疗肥胖症[20]。
4 结语
石头花属植物中含有非常丰富的化合物,具有多种药理作用。目前,从石头花属植物中分离得到的化学成分主要是三萜及其皂苷类。有研究报道,其中总黄酮的量很高,是很多栽培蔬菜的几倍甚至上百倍。黄酮类物质具有保肝、降压、抗菌等多种药理作用[56]。目前,对该属植物的研究虽然已取得了一些进展,但仍存在一些不足,主要体现在对该属植物的化学成分方面的研究不够全面,以及药理活性研究不够深入,如化合物的生物合成途径、单体化合物的活性筛选以及提高相对分子质量大、极性大的皂苷类化合物药理活性及生物利用度等方面的研究都有待进一步加强。因此,还需要利用现代药学的研究手段,结合细胞生物学、分子生物学等各相关学科知识,对石头花属中黄酮类、三萜类及其他有效成分进行合理的开发利用,扩展该属植物的应用范围,提高应用价值。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志 (第26卷)[M]. 北京: 科学出版社, 1996. |
| [2] | 江苏新医学院. 中药大辞典 (下册)[M]. 上海: 上海人民出版社, 1972. |
| [3] | 邵世光. 霞草的生物学特性和利用[J]. 中国林副特产, 2004(6): 51. |
| [4] | 鲁德全. 中国石头花属的分类和分布[J]. 植物研究, 1994, 14(4): 330-337. |
| [5] | 皮锡铭, 潘晓玲. 新疆石头花属植物分类研究及其生态地理分布[J]. 新疆大学学报: 自然科学版, 1991, 8(3): 86-91. |
| [6] | 龚金炎, 张 英, 吴晓芹. 黄酮类化合物抗病毒活性的研究进展[J]. 中草药, 2008, 39(4): 623-627. |
| [7] | 聂 飚, 罗建光, 孔令义. 头状石头花化学成分研究[J]. 药学研究, 2010, 18(4): 350-352. |
| [8] | 武海艳, 孙敬勇, 仲 英, 等. 霞草花化学成分研究[J]. 食品与药品, 2012, 14(5): 115-117. |
| [9] | Nie W, Luo J G, Kong L Y. C-Glycosylflavonoids from the aerial part of Gypsophila pacifica[J]. Chin J Nat Med, 2010, 8(4): 250-252. |
| [10] | 张凤梅, 太志刚, 杨亚滨, 等. 满天星中的一个新黄酮苷[J]. 分析实验室, 2009, 28(增刊): 236-237. |
| [11] | Huang Q F, Zhang S J, Zheng L, et al. Protective effect of isoorientin-2″O-a-L-arabinopyranosyl isolated from Gypsophila elegans on alcohol induced hepatic fibrosis in rats[J]. Food Chem Toxicol, 2012, 50(6): 1992-2001. |
| [12] | Elbandy M, Miyamoto T, Lacaille-Dubois M A. Sulfated lupane triterpene derivatives and a flavone C-glycoside from Gypsophila repens[J]. Chem Pharm Bull, 2007, 55(5): 808-811. |
| [13] | Luo J G, Wang X B, Ma L, et al. Gypsophin: A novel a-glucosidase inhibitory cyclic peptide from the roots of Gypsophila oldhamiana[J]. Bioorg Med Chem Lett, 2007, 17(16): 4460-4463. |
| [14] | Wang G, Luo J G, Yang M H, et al. Six new cyclic peptides from the roots of Gypsophila oldhamiana[J]. Chem Pharm Bull, 2013, 61(4): 489-495. |
| [15] | Bruzual De Abreu M, Dal Piaz F, Temraz A, et al. Gypsins A-D from Gypsophila arabica[J]. J Nat Prod, 2008, 71(8): 1336-1342. |
| [16] | 孙敬勇, 仲 英, 左春旭, 等. 霞草中化学成分的分离与结构鉴定[J]. 药学学报, 2005, 40(11): 994-996. |
| [17] | 罗建光, 何丽丽, 孔令义. 丝石竹的化学成分[J]. 中国天然药物, 2006, 4(5): 382-384. |
| [18] | 武海艳, 安 琨, 李海波, 等. 霞草化学成分及药理活性研究进展[J]. 食品与药品, 2011, 13(5): 213-216. |
| [19] | 李彩芳, 刘世峰, 田璞玉, 等. 顶空固相微萃取GC-MS法分析霞草花的挥发性成分[J]. 中国药房, 2010, 21(3): 2929-2930. |
| [20] | 危 晴, 王晓杰, 陈 亮, 等. GC-MS法分析霞草挥发油中的化学组分[J]. 湖北农业科学, 2012, 51(4): 813-815. |
| [21] | 李双石, 王晓杰, 彭 冲, 等. 顶空固相微萃取-气质联用分析长蕊石头花的挥发性成分[J]. 江苏农业科学, 2011, 9(3): 441-442. |
| [22] | 危 晴, 王晓杰, 陈 亮, 等. 同时蒸馏萃取法提取霞草挥发油的GC-MS分析[J]. 安徽农业科学, 2012, 40(9): 5216-5217. |
| [23] | Luo J G, Kong L Y, Yoshiaki T, et al. Two new monodesmosidic triterpene saponins from Gypsophila oldhamiana[J]. Chem Pharm Bull, 2006, 54(8): 1200-1202. |
| [24] | Ziminl I, Du L, Noell O, et al. Triterpenoid saponins from Gypsophila oldhamiana[J]. J Nat Prod, 1995, 58(10): 1632-1635. |
| [25] | Luo J G, Ma L, Kong L Y. New triterpenoid saponins with strong a-glucosidase inhibitory activity from the roots of Gypsophila oldhamiana[J]. Bioorg Med Chem, 2008, 16(6): 2912-2920. |
| [26] | Yotova M, Krasteva I, Jenett-Siems K, et al. Triterpenoids in Gypsophila trichotoma Wend.[J]. Phytochem Lett, 2012, 5(4): 752-755. |
| [27] | 罗建光, 张 洁, 孔令义. 丝石竹三萜成分的研究[J]. 中国中药杂志, 2006, 31(19): 1640-1641. |
| [28] | Luo J G, Liu J, Kong L Y. New pentacyclic triterpenes from Gypsophila oldhamiana and their biological evaluation as glycogen phosphorylase inhibitors[J]. Chem Biodiv, 2008, 5(5): 751-757. |
| [29] | Bai H, Zhong Y, Xie X Y, et al. A major triterpenoid saponin from Gypsophila oldhamiana[J]. Chem Biodiv, 2007, 4(5): 955-960. |
| [30] | Zheng Q, Li W, Han L K, et al. Pancreatic lipase-inhibiting triterpenoid saponins from Gypsophila oldhamiana[J]. Chem Pharm Bull, 2007, 55(4): 646-650. |
| [31] | Arslan I, Celik A, Chol J H. A cytotoxic triterpenoid saponin from under-ground parts of Gypsophila pilulifera Boiss. & Heldr.[J]. Fitoterapia, 2012, 83(4): 699-703. |
| [32] | Nie W, Luo J G, Kong L Y. New triterpenoid saponins from the roots of Gypsophila pacifica Kom.[J]. Carbohyd Res, 2010, 345(1): 68-73. |
| [33] | Chen Q, Luo J G, Kong L Y. New triterpenoid saponins from the roots of Gypsophila perfoliata Linn.[J]. Carbohyd Res, 2011, 346(14): 2206-2212. |
| [34] | Pertuit D, Avunduk S, Mitaine-Offer A C, et al. Triterpenoid saponins from the roots of two Gypsophila species[J]. Phytochemistry, 2014, 102: 182-188. |
| [35] | Arslan I, Celik A, Melzig M F. Nebulosides A-B, novel triterpene saponins from under-ground parts of Gypsophila arrostii Guss. var. nebulosa[J]. Bioorg Med Chem, 2013, 21(5): 1279-1283. |
| [36] | Yao S, Luo J G, Ma L, et al. Two new triterpenoid saponins from the roots of Gypsophila paniculata with potent α-glucosidase inhibition activity[J]. Chin J Nat Med, 2011, 9(6): 401-405. |
| [37] | Yao S, Ma L, Luo J G. New triterpenoid saponins from the roots of Gypsophila paniculata L.[J]. Helv Chim Acta, 2010, 93(2): 361-374. |
| [38] | Yao S, Ma L, Luo J G, et al. Triterpenoid saponins from the roots of Gypsophila paniculata[J]. Chin J Nat Med, 2010, 8(1): 28-33. |
| [39] | Chen Q, Luo J G, Kong L Y. Triterpenoid saponins from Gypsophila altissima L.[J]. Chem Pharm Bull, 2010, 58(3): 412-414. |
| [40] | 孙敬勇, 仲 英, 尹俊亭, 等. 霞草中三萜化合物的分离与结构鉴定[J]. 中草药, 2005, 36(5): 644-646. |
| [41] | Voutquenne-Nazabadioko L, Gevrenova R, Borie N, et al. Triterpenoid saponins from the roots of Gypsophila trichotoma Wender.[J]. Phytochemistry, 2013, 90: 114-127. |
| [42] | Hani M, Elgamal A, Soliman H S M, et al. Isolation of triterpene saponins from Gypsophila capillaris[J]. Phytochemistry, 1995, 38(6): 1481-1485. |
| [43] | Acebes B, Díaz-Lanza A M, Bernabé M. A saponin from the roots of Gypsophila bermejoi[J]. Phytochemistry, 1998, 49(7): 2077-2079. |
| [44] | Acebes B, Bernabé M, Díaz-Lanza A M, et al. Two new sulfated saponins from the roots of Gypsophila bermejoi[J]. J Nat Prod, 1998, 61(12): 1557-1559. |
| [45] | Elbandy M, Miyamoto T, Lacaille-Dubois M A. New triterpenoidal saponins from Gypsophila repens[J]. Helv Chim Acta, 2007, 90(2): 260-270. |
| [46] | Luo J G, Nie W, Kong L Y. Three new sulfated triterpenoids from the roots of Gypsophila pacifica[J]. J Asian Nat Prod Res, 2011, 13(6): 529-533. |
| [47] | Krasteva I, Jenett-Siems K, Kaloga M, et al. 3-O-sulfo-triterpenoid saponins from Gypsophila trichotoma Wend[J]. Z Naturforsch, 2009, 64b(3): 319-322. |
| [48] | Shen-Chieh C, Molly C E, John J B. Allelochemical phenolic acids from Gypsophila paniculata[J]. J Undergraduate Chem Res, 2008, 7(1): 1-3. |
| [49] | 田桂红, 周 玲, 胡志力, 等. 霞草总苷对S180和H22实体瘤的抑制作用[J]. 山东中医杂志, 2008, 27(1): 52-54. |
| [50] | 田桂红, 周 玲, 仲 英, 等. 霞草皂苷对A549细胞和小鼠Lewis肺癌的抑制作用[J]. 济南大学学报: 自然科学版, 2013, 27(2): 169-172. |
| [51] | Zhang W, Luo J G, Zhang C, et al. Different apoptotic effects of triterpenoid saponin-rich Gypsophila oldhamiana root extract on human hepatoma SMMC-7721 and normal human hepatic L02 cells[J]. Biol Pharm Bull, 2013, 36(7): 1080-1087. |
| [52] | 韩立坤. 丝石竹水层总皂苷部分的抗肥胖作用[J]. 国外医学: 中医中药分册, 2005, 27(3): 185-186. |
| [53] | Simeonova R, Kondeva-Burdina M, Vitcheva V, et al. Protective effects of the apigenin-O/C-diglucoside saponarin from Gypsophila trichotoma on carbone tetrachloride-inducedhepatotoxicity in vitro/in vivo in rats[J]. Phytomedicine, 2014, 14(2): 148-154. |
| [54] | 黄海兰, 王海媛, 王宗花, 等. 霞草提取物的抗氧化活性研究[J]. 食品工业科学, 2012, 33(4): 114-116. |
| [55] | 张凤梅, 太志刚, 蔡 乐, 等. 满天星中的黄酮类化合物及其抗氧化活性[J]. 云南大学学报: 自然科学版, 2011, 33(1): 93-95. |
| [56] | 耿敬章, 李春华, 仇农学. 霞草的成分分析及营养评价[J]. 中国食物与营养, 2005(8): 41-43. |
 2015, Vol. 46
2015, Vol. 46


