2. 西南大学生命科学学院, 三峡库区生态环境教育部重点实验室, 重庆 400715;
3. 西南林业大学林学院, 国家林业局西南地区生物多样性保育重点实验室, 云南 昆明 650224
2. Key Laboratory of Eco-environments of Three Gorges Reservoir Region, Ministry of Education, School of Life Sciences, Southwest University, Chongqing 400715, China;
3. Key Laboratory of Biodiversity Conservation in Southwestern China, State Forestry Administration, School of Forestry, Southwest Forestry University, Kunming 650224, China
黄连Coptis chinensis Franch. 又名味连、川黄连、鸡爪连,为毛茛科黄连属多年生草本植物,三级渐危种[1]。野生黄连大多分布于四川、重庆、湖南、湖北、陕西、贵州省海拔1 200~1 700 m的山谷密林之中。黄连性寒、味苦,根茎入药,具有清热燥湿、泻火解毒等作用[2, 3],临床上还用于细菌性痢疾、局部化脓性感染、心律失常、胃炎及十二指肠溃疡等病的治疗[4]。
由于黄连根茎有效成分小檗碱的独特药效,使得药材市场对其需求量逐年增加。而土壤盐渍化是农业栽培生产中主要障碍之一,目前我国的盐渍土地面积不断扩大,对农业生产造成了巨大的经济损失。目前对黄连的研究主要集中在化学成分、药理作用、临床应用及资源保护等方面[5, 6, 7, 8, 9]。对黄连栽培过程中的环境胁迫主要集中在热胁迫、冷胁迫、干旱胁迫等方面,但是对盐胁迫的研究报道较少[10, 11, 12, 13]。
一氧化碳(carbon monoxide,CO)是继一氧化氮(NO)之后发现的一种新的细胞信使分子[14],是一种广泛分布于生物体内的活性气体信号分子,在体内执行多种生理功能。随着对内源性NO作为体内最重要的气体信使分子的研究深入,人体内与NO理化性质相似的CO的生理调节功能才引起了不少研究者的广泛注意[15]。低浓度的CO不仅能有效抑制盐胁迫下小麦生长受阻、水分流失和叶绿素衰变,而且还能加强植物抗氧化系统的抗氧化能力[16, 17, 18]。进一步研究发现CO还参与不少的植物生理代谢过程,CO可诱导盐胁迫下小麦种子的萌发,通过提高过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)及超氧化物歧化酶(SOD)等抗氧化酶的活性,减少膜质过氧化作用,缓解萌发过程所受的氧化胁迫[19],但有关CO对盐胁迫下黄连幼苗光合特性及叶绿素荧光特性的研究未见报道。
叶绿素荧光诱导动力学以光合作用理论为基础,是探测和分析植物光合功能的重要手段,为研究光系统II(PSII)及其电子传递过程提供了丰富信息[20]。因此,叶绿素荧光动力学技术是研究植物光合生理状况及植物与逆境胁迫关系的理想探针[21, 22, 23]。目前关于盐胁迫对植物体叶绿素荧光参数的影响有部分报道[24, 25, 26],但是关于盐胁迫对黄连叶绿素荧光方面的研究未见报道。本实验利用NaCl模拟盐胁迫,采用外源物质进行恢复处理,从而研究不同浓度的外源物质处理对黄连幼苗叶片光合色素量、叶绿素荧光参数、光合特性等一系列光合生理指标的影响,为进一步探索外源CO提高黄连幼苗的抗盐机制提供理论依据,为黄连在实际栽培中遇到的盐胁迫问题提供新的解决思路。
1 材料供试的黄连幼苗由重庆市石柱黄连培育基地提供,经西南大学生命科学学院何平教授鉴定为Coptis chinensis Franch. 的两年生幼苗。CO的供体高铁血红蛋白(hematin,H)为Sigma公司生产,H预先配制成5 μmol/L的母液,4 ℃下保存,用时按照需要进行稀释。
2 方法 2.1 黄连幼苗不同处理的实验设计选取长势一致的两年生幼苗移入培养钵中,每盆植入一株,盆中基质按松针土-腐殖土-沙土=2∶2∶1的比例混合形成。经过10 d的缓苗期后,进行盐胁迫试验,共设置6个处理:(1)Hoagland营养液空白对照(CK1);(2)Hoagland营养液+100 mmol/L NaCl盐胁迫对照(CK2);(3)Hoagland营养液+100 mmol/L NaCl+0.5 μmol/L H(T1);(4)Hoagland营养液+100 mmol/L NaCl+1.0 μmol/L H(T2);(5)Hoagland营养液+100 mmol/L NaCl+2.0 μmol/L H(T3);(6)Hoagland营养液+100 mmol/L NaCl+5.0 μmol/L H(T4)。每个处理10株幼苗,3次重复,每天定期向花盆内补充Hoagland营养液。分别于盐胁迫后的第5、10和15天进行取样,取样时选取植株中等大小的功能叶片。测量的相关指标包括幼苗叶片叶绿素a(Chl a)、叶绿素b (Chl b),总叶绿素 [Chl (a+b)] 和类胡萝卜素(Car)量、相关叶绿素荧光参数、黄连植株的的净光合速率(Pn)、气孔导度(Gs)、叶片蒸腾速率(Tr)及胞间CO2浓度(Ci)。
2.2 黄连叶片光合色素量的测定光合色素包括Chl a、Chl b、Chl (a+b)和Car的量均采用张志良等[27]的方法进行测定,用日本岛津UV-2550紫外分光光度计测量不同波段下的吸光度,每处理3个重复。
2.3 黄连叶片光合作用气体交换参数的测定测量方法为本实验室常规方法,每次测定时间为9:00~11:00,测定叶片为生长完好、无病虫害、叶面积相近的第3~4完全展开叶。气体交换参数用Li-6400XT(Li-Cor,美国)6400-01 CO2注入系统及6400-02 LED红蓝光源测定,在500 μmol/(m2·s)的光量子通量密度下测定叶片Pn、Gs、Ci和Tr等叶片气体交换参数,测量时的室温设置为25 ℃,CO2浓度设为380 μmol/mol。每一重复为同叶位叶片,每次测定4株,共3次重复。
2.4 黄连叶片叶绿素荧光参数的测定实验中叶绿素荧光参数采用PAM-2100便携式荧光仪(德国Walz公司)[28]进行测定。叶片暗适应30 min后,先用一束小于0.05 μmol/(m2·s) 的测量光(频率为600 Hz)照射叶片,测初始荧光(Fo),随后施加饱和脉冲光 [5 000 μmol/(m2·s),脉冲时间0.8 s],测得最大荧光(Fm)和可变荧光(Fv=Fm-Fo),并计算暗适应叶片PSII最大潜在光化学效率(Fv/Fm)。打开测量光 [500 μmol/(m2·s)],待Ft稳定后,取此时的Ft为稳态荧光(Fs);然后再打开一个同样强度的饱和脉冲光 [5 000 μmol/(m2·s)],荧光上升到能化类囊体最大荧光(Fm′);叶片经过短暂的暗适应后,打开远红光 [7 μmol/(m2·s)],得到能化类囊体最小荧光(Fo′)。其他荧光参数如下:Fv、Fv/Fm、PSII潜在活性(Fv/Fo)、PSII有效光化学效率(Fv′/Fm′)、光化学猝灭系数(qP)=(Fm′-Fs)/(Fm′-Fo′)、非光化学猝灭系数(NPQ)=(Fm-Fm′)/Fm′、表观光合电子传递速率(ETR)和PSII实际光化学效率(ΦPSII)、光下光合功能相对限制值(PED)=1-(qP×Fv′/Fm′)/0.83均由仪器自动给出;通过计算得出潜在光化学效率(Fv/Fo),光化学速率(PCR)=Fv′/Fm′×qP×PED,热耗散速率(HDR)=(1-Fv′/Fm′)×PED,每处理3盆,每盆重复测定6次。
2.5 数据处理采用SSPS 12.0统计软件对数据进行方差分析,以Duncan’s新复级差法比较不同处理间的差异性。
3 结果与分析 3.1 不同浓度的H处理对黄连植株外部形态的影响黄连植株在处理前生长良好,当用单一的100 mmol/L NaCl进行胁迫后,截至到第4天并无明显的变化,到第6天时,植株幼嫩叶片边缘开始出现萎缩,叶柄无明显变化,到第10天时,幼嫩叶片和叶柄均开始出现枯黄,较大的成年叶片边缘也开始枯黄。截至到第15天时,幼嫩叶片全部枯黄,成年叶片边缘枯黄面积加大,约占1/2。经过不同浓度H处理后,植株出现枯黄的现象减少,部分植株生长良好,叶片未出现枯黄现象,并且在4个不同的处理浓度中,2.0 μmol/L处理后的植株叶片与对照组(CK1)相比无明显变化。以上外部形态的变化表明盐胁迫明显地使黄连植株的生长受到抑制,而H对于缓解盐胁迫具有一定的积极作用。
3.2 H对盐胁迫下黄连幼苗叶片光合色素量的影响由表 1可以很明显地看出经过100 mmol/L NaCl处理后,黄连幼苗叶片色素(Chl a、b)量都表现出相似的变化趋势,均有不同程度的降低,并且随着胁迫时间的延长,减少幅度增加,当处理进行到第15天时,各色素量降至最低。其中Chl a量降低程度最大,与未经处理的CK1差异显著。在经过不同浓度的H处理后,黄连叶片光合色素量较单一盐对照CK2来讲均有不同的提升,并且随着H处理时间的延长,光合色素增加的趋势越来越明显。H处理提高了Chl a的量,在第5天浓度为2.0 μmol/L时,效果最好,量达到0.852 mg/g,随着时间的延长,在此处理浓度下,量略有增加,但与第5天时处理相比,差异并不显著,这说明了H处理对盐胁迫下的黄连幼苗有一定程度的持续作用。H对盐胁迫下黄连幼苗叶片Chl b量的影响显示,在处理初期效果不显著,随着处理时间的延长(15 d),效果才逐渐表现出来,并且与对照CK2形成了显著性差异。另外,各浓度梯度之间的差异性不显著。以上结果表明,盐胁迫对黄连叶片Chl b量有一定的抑制效应,在胁迫初期表现的并不突出,但是随着时间延长,胁迫作用显著,H对盐胁迫引起的光合色素量降低有一定的缓解作用。
| 表 1 盐胁迫下不同处理对黄连幼苗叶片光合色素量的影响 Table 1 Changes of photosynthetic pigment in leaves of C. chinensis seedlings with different treatments of H under salt stress |
总的来讲,随着胁迫时间的延长,黄连幼苗叶片Chl (a+b) 及Car量均呈下降趋势。在胁迫初期,Chl (a+b) 量在NaCl胁迫下变化并不显著,但是随着胁迫时间的延长,其量呈现出显著降低的趋势,Car表现出相似的变化趋势,这说明盐胁迫均显著抑制了叶绿素及Car的合成,并有可能加速了两者的降解。当用不同浓度的H进行处理后,Chl (a+b) 量均有不同程度的增加,在处理初期,不同浓度梯度之间的变化并不显著,随着时间的延长,效果逐渐明显,均在2.0 μmol/L的浓度下与盐对照CK2相比形成显著差异。Car的变化趋势与Chl (a+b) 的变化趋势基本相似,量均有一定程度地升高。在处理初期升幅最大,随着胁迫时间的延长,量升高幅度呈下降趋势,在第15天时其量较第10天相比都有所降低,但是差异并不显著。这说明H对Car的影响较为迟缓,及Car在遭受到盐胁迫时降低程度并不像叶绿素那样明显,同样的在用外源物质进行处理时,增加幅度也是有限的,这从另一个方面反映了Car的稳定性。以上结果均说明外源H对促进光合色素量的提升具有显著的作用,有效地缓解了盐胁迫对光合色素合成的抑制效应。
3.3 H对盐胁迫下黄连幼苗叶片Chla/Chl b和Car/Chl (a+b) 量的影响图 1所示为盐胁迫下Chl a/Chl b及Car/Chl (a+b)的变化情况,随着盐胁迫时间的延长,Chl a/Chl b呈现出规律的降低现象。Car/Chl (a+b) 的变化则自始至终都呈现出升高的趋势,在处理至第10天时,升高幅度最明显,在处理至第15天时,幅度有所降低。这说明在盐胁迫下,Chl a的稳定性不及Chl b高,并且Chl (a+b) 的稳定性不及Car高。在用H进行处理后,Chl a/Chl b值情况发生了不同程度地改变,不同浓度的处理均升高了Chl a/Chl b,即对Chl a的量的促进作用大于对Chl b的作用,并且在第10天时,效果最佳,随着时间的延长,效果略有降低,但是仍然与对照相比差异显著。对Car/Chl (a+b) 的比值则随着处理时间的延长呈现出降低趋势,此结果表明外源物质处理显著增加了Chl (a+b) 量,且增加幅度高于Car。以上结果均表明,盐胁迫对Chl a的伤害较Chl b更大,对Chl (a+b) 的伤害较Car的伤害更大。外源物质有效地提高了叶绿素的量,特别是Chl a的量。
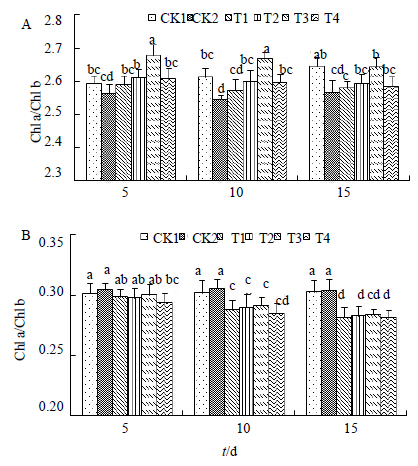 | 图 1 Chl a/Chl b (A) 和Car/Chl (a+b) (B) 的变化Fig.1 Changes of Chl a/Chl b (A) and Car/Chl (a + b) (B) |
从图 2-A可以看出对照组CK1的Fo比较稳定,不会随着时间的延长产生大幅度的变化。而盐胁迫处理CK2在第5天时就出现大幅度的升高,并且随着时间的延长逐渐升高,并且在第15天时达到最大值(0.326)。经过H处理后,Fo明显下降,各不同处理都与CK2形成显著差异。在各不同H处理浓度中,2.0 μmol/L的处理效果最为显著,使Fo下降至0.189,甚至低于对照CK1(0.211),并且随着时间的延长,一直保持在一个较低的水平。Fm表示的是PSII反应中心处于完全关闭时的荧光产量,可以用来反映通过PSII的电子传递情况。图 2-B显示经过盐胁迫后Fm呈下降趋势,并且随着处理时间的延长,下降幅度也越来越明显,第5天和第10天之间形成显著差异,在第15天时下降到最低(0.982),与对照CK1(1.315)相比差异显著。在经过H处理后,Fm开始上升,并且不同浓度的处理均显著提高了Fm值。相同浓度下,不同处理时间差异并不显著,当浓度为2.0 μmol/L处理时间为10 d时,Fm达到最大值(1.385)。以上结果均说明,在盐胁迫初期,H具有显著提升Fm的作用。
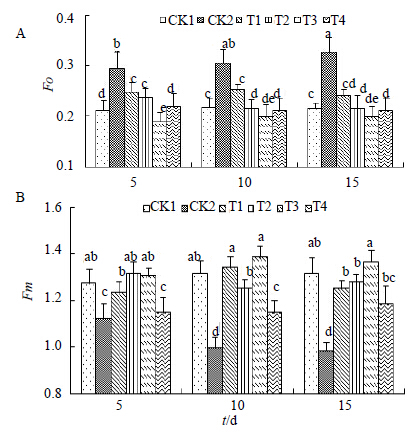 | 图 2 Fo (A) 和Fm (B) 的变化Fig.2 Changes of Fo (A) and Fm (B) |
图 3所示为黄连植株在100 mmol/L的NaCl下,随着胁迫时间的延长,叶片Fv/Fm和Fv/Fo的变化趋势。正常条件下,黄连的Fv/Fm维持在0.834左右,并且不会随着时间的延长有大幅度的变化,但是在经过NaCl处理后,Fv/Fm呈现出降低的趋势,且随着胁迫时间的延长,降低幅度增加。并与对照CK1形成显著差异,且在第15天时达到最低值(0.668)。当用H进行处理后,Fv/Fm值升高,并且不同浓度的升高幅度不同,低浓度(0.5 μmol/L)的升高幅度在处理初期较低,但是随着时间的延长,升高幅度越来越明显,1.0 μmol/L(T2)和5.0 μmol/L(T4)的H在处理前期就表现出良好的效果。2.0 μmol/L的处理效果最为明显,且在处理初期就与其他处理相比形成显著差异,在处理到第10天时,达到最大值(0.857)。Fv/Fo变化趋势与Fv/Fm相似。当用不同浓度的H处理后,其值呈现升高趋势,当H浓度达到2.0 μmol/L(T3)时,上升至最大值(5.993)。以上结果均说明,盐胁迫下黄连Fo显著升高,Fm、Fv/Fm和Fv/Fo 均显著降低,在经过2.0 μmol/L的H处理后,Fo降低至空白对照CK1水平,Fm、Fv/Fm和Fv/Fo 均显著升高。
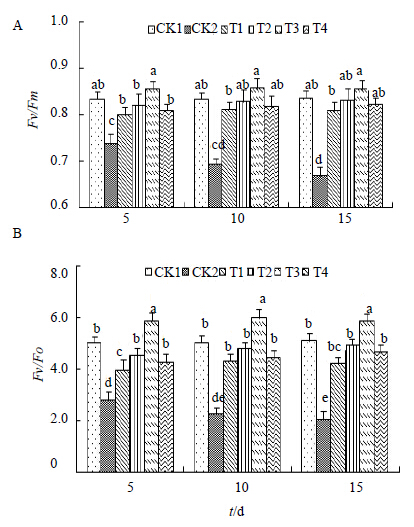 | 图 3 Fv/Fm (A) 和Fv/Fo (B) 的变化Fig.3 Changes of Fv/Fm (A) and Fv/Fo (B) |
图 4所示为盐胁迫下黄连Fv′/Fm′和ΦPSII的变化趋势,两者表现出了相似的变化趋势,Fv′/Fm′和ΦPSII随着盐胁迫浓度以及胁迫时间的延长呈现出持续下降的趋势。Fv′/Fm′表示的是开放的PSII反应中心原初光能转化效率[29],称为PSII有效光化学效率或天线色素转化率。盐胁迫下Fv′/Fm′的变化趋势与Fv/Fm和Fv/Fo的变化趋势相似。当受到盐胁迫后,Fv′/Fm′呈下降趋势,并且随着时间的延长,下降幅度升高,到第15天时,降到最低值(0.533),与对照CK1相比,差异显著。当用H处理(T3)后,其值呈升高趋势,并且随着处理时间的延长逐渐升高,在第15天时达到最高(0.696),与CK2相比,提高幅度为30.58%,并且其他浓度的处理也不同程度的提高了Fv′/Fm′值。ΦPSII表示的是PSII反应中心受到环境胁迫时,存在部分反应中心关闭情况下的实际光化学效率。在受到盐胁迫时,ΦPSII在胁迫初期就显著降低,随着胁迫时间的延长,持续降低,但降低程度在时间梯度上差异不显著。经过H处理(T3)后,ΦPSII升高,当处理至第15天时,达到最大值(0.534),甚至超过未经任何处理的CK1(0.524),与CK2相比,提高幅度为38.34%,H对ΦPSII的提高幅度远远大于对Fv′/Fm′的提高幅度,这说明H对盐胁迫下黄连有效光化学效率和实际光化学效率都有显著提高,且对实际光化学效率的提高幅度最大。
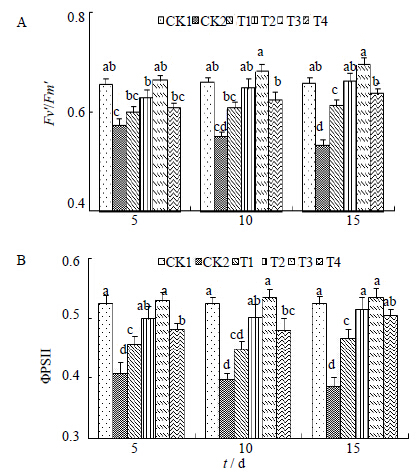 | 图 4 Fv′/Fm′ (A) 和ΦPSII (B) 的变化 Fig.4 Changes of Fv′/Fm′ (A) and ΦPSII (B) |
qP主要反映处于激发态的PSII反应中心通过电荷分离进行原初光化学反应,代表PSII反应中心开放部分的比例[30, 31, 32]。由图 5可以看出,在受到盐胁迫后,qP呈下降趋势,并且随着胁迫时间的延长,下降趋势也越来越大,且不同处理时间之间形成显著差异,说明胁迫对此项指标的影响较为明显。NPQ的变化趋势与qP正好相反,在受到盐胁迫时,其数值呈现上升趋势,不同的是NPQ并没有随时间的延长而出现大幅度的变化,各处理时间之间差异并不显著。但是与CK1相比形成显著差异。在经过H处理后qP呈上升趋势,且随着时间的延长,上升幅度增加,在浓度为2.0 μmol/L,处理时间为第10天时达到最大值(0.859),与对照CK1(0.809)相比,差异显著。其他浓度处理也具有相似的变化趋势且均与对照CK2形成显著差异,这说明了,H处理显著地恢复了因盐胁迫而导致的黄连qP下降的情况,并且将其水平恢复到正常值以上。NPQ在经过H处理后呈现出下降趋势,并且也是随着时间延长,下降幅度增加,最后下降到0.255,与对照CK1(0.201)相比无明显差异。图 6显示HDR随着盐胁迫时间的延长而增加,并且不同时间之间差异显著。在经过H处理后呈现下降趋势,但是不同处理浓度之间差异并不显著。NPQ通常是用来表示PSII反应中心非光化学能量耗散能力的大小[33],它与HDR都是通常用来反映热耗散情况的重要指标。经过H处理后,NPQ和HDR降低,qP升高,以上说明H有效地促进了光化学反应的进行。
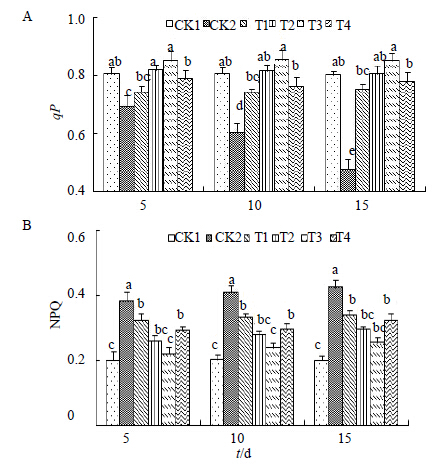 | 图 5 qP (A) 和NPQ (B) 的变化Fig.5 Changes of qP (A) and NPQ (B) |
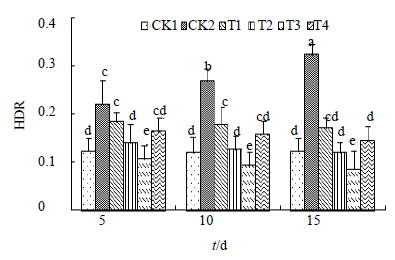 | 图 6 HDR的变化Fig.6 Changes of heat dissipation rate |
由图 7可以看出,ETR和PCR的变化趋势相似,当未经任何处理时,两者基本不发生任何变化,当进行单一盐胁迫后,两者均大幅度下降,并且随着胁迫时间的延长,下降程度逐渐增大。在第15天时两者均达到最低值,分别为23.821和60.413,与对照CK1(32.954和82.106)相比,形成显著差异。当经过不同浓度的H处理后,ETR和PCR均呈上升趋势,并且各不同浓度处理与对照CK2相比,差异显著,说明H的处理效果较为显著。当H处理浓度为2.0 μmol/L(T3),ETR处理为第15天时,达到最大值(32.400),而PCR也是在处理第15天时达到最大值(97.959),均与CK2形成显著性差异,并且高于对照CK1,这说明H的处理效果较为显著。
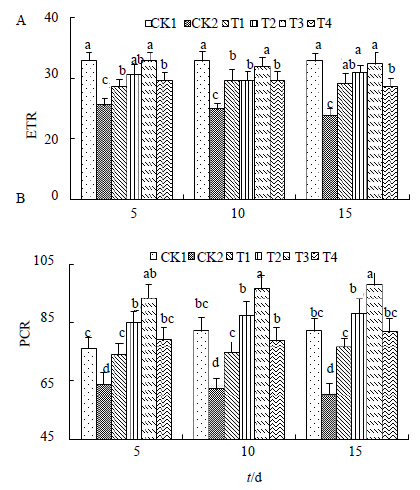 | 图 7 ETR (A) 和PCR (B) 的变化Fig.7 Changes of ETR (A) and PCR (B) |
图 8-A所示为盐胁迫下Pn的变化,随着NaCl处理时间的延长,黄连Pn呈现出持续降低的趋势,并且在处理达到15 d时降低至最小值 [3.475 μmol/(m2·s)],与空白对照相CK1 [6.671 μmol/(m2·s)]形成显著差异。在经过H处理后,显著提高了黄连叶片Pn的水平,在处理时间为5 d时,低浓度的H处理(T1、T2)即可显著提高Pn的水平,当浓度达到2.0 μmol/L(T3)时,达到最大值[6.361 μmol/(m2·s)],与空白对照CK1 [6.364 μmol/(m2·s)] 相比,差异不显著,这说明H处理已经使得盐胁迫下的黄连幼苗Pn恢复到正常水平,且与盐对照CK2相比差异显著。图 8-B所示为盐胁迫下Gs的变化,随着NaCl胁迫时间的延长,黄连叶片Gs呈现出降低的趋势,在第15天时CK2达到最小值 [0.131 μmol/(m2·s)]并与对照CK1 [0.371 μmol/(m2·s)]形成显著差异。在经过H处理后,Gs水平均有不同程度地提高,在处理时间为5 d时,各不同H浓度均对Gs有一定程度的提高,但升幅较小,随着处理时间的延长,处理效果越来越明显,在处理时间为15 d时,其水平达到最高,为0.349 μmol/(m2·s),处理浓度也是以2.0 μmol/L为最佳,与Pn的变化规律相似。
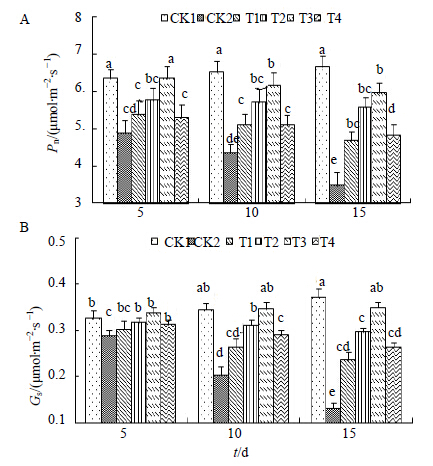 | 图 8 Pn (A) 和Gs (B) 的变化Fig.8 Changes of Pn (A) and Gs (B) |
图 9所示为盐胁迫下Ci的变化,在胁迫初期,随着NaCl胁迫处理时间延长,Ci水平呈现出持续显著地升高趋势,并且与对照组CK1相比差异显著,表明盐胁迫显著地提高了黄连叶片Ci的水平。当用H进行处理后,Ci的升高趋势均有不同程度的缓解,在处理初期(5 d)时,T3处理(2.0 μmol/L)就使得Ci降到172.66 μmol/mol,H处理在整个处理过程均表现出了显著的持续性,在10 d和15 d时,T3处理后的结果(179.84和173.21 μmol/mol)均与各自的盐对照CK2(223.55和240.58 μmol/mol)形成显著性差异。以上结果表明外源H有效地降低了盐胁迫下Ci水平,减少了CO2积累引起的光合作用效率的降低。
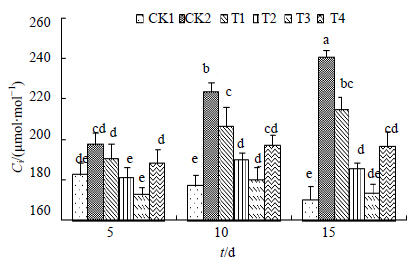 | 图 9 Ci的变化Fig.9 Changes of Ci |
图 10可以看出,盐胁迫下黄连叶片Tr在处理初期(5 d)与对照相比并没有显著变化,但是当处理时间延长至10 d时,蒸腾速率呈降低变化趋势,与对照CK1差异显著。并且随着NaCl处理时间的延长,降低幅度变大,特别是处理后期,到最低值。当用H处理后,均不同程度提高了Tr水平,在处理初期效果并不显著,各浓度梯度处理与盐对照CK2相比差异并不显著。但随着处理时间的延长,盐对照CK2的降低程度显著增加,外源物质处理的效果也越来越明显,虽然最大值出现并不是在处理中后期,但是处理的中后期对叶片蒸腾速率Tr的提升幅度却远远高于处理前期。总的来看,在H处理的后期,Tr达到0.545 μmol/(m2·s),为盐对照CK2的1.37倍,这说明外源H能有效地缓解盐胁迫下黄连叶片蒸腾速率降低的趋势。
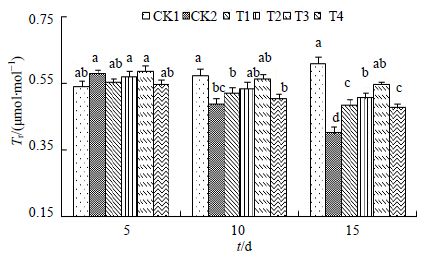 | 图 10 Tr的变化Fig.10 Changes of Tr |
叶绿素荧光诱导动力学检测技术是以植物体内叶绿素为天然探针,包含着丰富的光合信息,可以快速、灵敏、无损伤探测水分胁迫对植物光合作用的影响[34]。许多研究已证明PSII是光抑制的重要部位,许多胁迫因子,如干旱、盐碱、热害和冷害等都可以使PSII光能利用效率下降,从而使植物更易受到光抑制的伤害[35]。目前虽然有关盐胁迫对PSII光能利用效率影响的报道较多,但尚缺乏统一的认识,如Ara等[36]认为盐胁迫促进PSII的功能,Everard等[37]则认为盐胁迫抑制PSII的功能。PSII反应中心的破坏可以引起Fo的增加,Fo表示的是PSII反应中心处于完全开放时的荧光产量,盐胁迫引起了Fo的升高,说明了黄连叶片PSII天线色素吸收的能量流向光化学的部分减少,以荧光形式等散失的能量增加,并且随着时间的延长,破坏程度越高。Fm为最大荧光,是PSII反应中心处于完全关闭时的荧光产量,可以用来反映通过PSII的电子传递情况。实验中,黄连在受到盐胁迫后,Fm明显降低,Fv也明显下降,表明盐胁迫处理降低了PSII反应中心QA的氧化态数量,使QA→QB传递电子的能力下降,从而形成较多QB非还原性PSII反应中心,导致PSII反应中心放氧活性降低[38],尤其是高盐浓度使Fo值有所升高,表明PSII反应中心发生不可逆转的失活或破坏[39]。
本研究中,经过盐胁迫后的黄连植株叶片叶绿素的量大幅度减少,这说明盐胁迫破坏了光合色素的合成,而外源H则减缓了光合色素降低的趋势,促进了光合色素的合成。Fv/Fm值表示的是PSII原初光能转化换效率,表明PSII利用光能的能力,与植物的光合作用光抑制程度密切相关,又称为最大光化学量子产量。Fv′/Fm′表示的是开放的PSII反应中心原初光能转化效率[40],称为PSII有效光化学效率或天线色素转化率。Fv/Fm是经常采用的叶绿素荧光指标之一,通常在胁迫条件下此指标会降低[32],同时表明光系统II遭受到破坏[41]。本研究中黄连幼苗受到盐胁迫后,Fv/Fm和Fv′/Fm′均呈现出显著的下降,这说明光系统II遭受到破坏。ΦPSII反映的是PSII反应中心在有部分关闭情况下的实际原初光能捕获效率[42]。在本实验中盐胁迫引起ΦPSII大幅度降低,且随着胁迫时间的延长,降低程度加大。在经过不同浓度的H处理后,显著地提高了光能捕捉效率。
qP值的大小可以反映PSII原初电子受体QA的氧化还原状态和PSII开放中心的数目[43]。光化学猝灭系数NPQ在一定程度上反映了PSII反应中心的开放程度,而NPQ是光合机构的一种自我保护机制。NPQ过程是植物体为了避免光抑制和膜受到伤害,调整过量能量耗散的一套适应机制。光系统通过提高非辐射性热耗散可以消耗PSII吸收的过多光能,从而起到保护PSII反应中心免受因吸收过多光能而引起的光氧化和光抑制伤害。本实验结果表明,盐胁迫下黄连叶片的qP下降,说明盐胁迫导致黄连叶片PSII反应中心的开放程度降低,从天线色素上捕获的光能用于光化学反应的份额减少,PSII反应中心的光化学活性变弱,使累积在PSII反应中心的光能过剩,黄连通过提高NPQ及时耗散了过剩的光能,有效保护了光合机构。
本研究中通过不同浓度的NaCl模拟盐胁迫后,黄连的光合特性也发生了变化。Pn、Gs和Tr均有大幅度的降低,而Ci则发生显著的升高。引起植物叶片Pn降低的因素主要分为2大类;类是气孔因素阻止了CO2的供应,主要受气孔数量、气孔孔径、气孔开度等的影响[44];另一类为非气孔因素,主要受内部的酶活力和光合组分控制[45]。因此,检查气孔限制是否是Pn下降的主要原因,既要看气孔导度Gs的大小,同时还要看Ci的变化。若Cs和Gi下降,则气孔因素是主要的;Gs下降而Ci升高则非气孔因素是主要的。本研究显示,NaCl胁迫导致黄连幼苗叶片Gs逐渐下降,Ci逐渐升高,说明盐胁迫下尽管诱导了部分气孔的关闭,使Gs下降,但是非气孔限制才是光合作用的主要限制因素。外源H处理减轻了NaCl胁迫下黄连幼苗叶片Pn、Gs和Tr的下降幅度,Ci的升高幅度也显著降低,表明H处理可以缓解盐胁迫对黄连幼苗叶片光合作用的非气孔限制,维持光系统的较高活性。这与前面NaCl胁迫下黄连幼苗叶片叶绿素荧光参数影响的测定结果是一致的,即NaCl胁迫导致黄连幼苗PSII反应中心受损,光化学活性降低,而不同的外源物质可以缓解NaCl胁迫对PSII的损伤,维持PSII光化学活性及光合电子传递的正常进行。
综合以上实验结果,H处理显著提高了盐胁迫下黄连叶片光合色素量和Pn、Gs和Tr、Ci水平。在对叶绿素荧光方面的作用具体表现在显著提高了黄连叶片Fm、Fv/Fm、Fv/Fo、ΦPSII、Fv′/Fm、qP、ETR和PCR的水平,降低了Fo和NPQ的值,从而保护了PSII反应中心不受伤害,减少PSII和电子传递链的过分还原,进而缓解了盐胁迫对黄连造成的伤害。
| [1] | 傅立国. 中国植物红皮书-稀有濒危植物[M]. 北京:科学出版社, 1991. |
| [2] | 中国药典[S]. 一部. 2010. |
| [3] | 赵中振, 肖培根. 当代药用植物典[M]. 上海: 上海世界图书出版社, 2007. |
| [4] | 马伏英. 黄连等中药抗实验性小鼠柯萨奇B3病毒性心肌炎的实验研究[J]. 武警医学, 1998, 9(4): 187-190. |
| [5] | 郭志刚, 赵 琳, 孙瑞强, 等. 利川黄连小檗碱量[J].中国医学科学院学报, 2004, 26(6): 618-621. |
| [6] | Chae S H, Jeong I H, Choi D H, et al. Growth-inhibiting effects of Coptis japonica root-derived isoquinoline alkaloids on human intestinal bacteria[J]. J Agric Food Chem, 1999, 47(3): 934-938. |
| [7] | Kuo C L, Chi C W, Chan T Y, et al. The anti-inflammatory potential of berberine in vitro[J]. Cancer Lett, 2004, 109(3): 407-414. |
| [8] | 薛宝娟, 李志慧, 张玉杰, 等. 吴茱萸次碱对5种黄连生物碱大鼠体外肝代谢的抑制作用[J]. 中草药, 2014, 45(9): 1293-1296. |
| [9] | 张春平, 何 平, 胡世俊, 等. 外源5-氨基乙酰丙酸对盐胁迫下黄连种子萌发及幼苗生理特性的影响[J]. 中草药, 2014, 45(24): 3618-3626. |
| [10] | 李品明, 孙玉芳, 杨丙贤, 等. 低温胁迫对黄连膜脂过氧化作用和抗氧化酶活性的影响[J]. 中国农学通报, 2011, 27(15): 117-120. |
| [11] | 孙玉芳, 王三根, 尹 丽, 等. 高温胁迫对黄连生理特性的影响研究[J]. 植物生理科学, 2006, 22(4): 236-238. |
| [12] | 李品明, 杨丙贤, 孙玉芳, 等. 高温胁迫对黄连幼苗活性氧代谢及保护酶活性的影响[J]. 安徽农业科学, 2011, 39(18): 10796 -10798. |
| [13] | 田桂香, 汤绍虎, 武敬亮, 等. 干旱胁迫对黄连生理作用的影响[J]. 西南师范大学学报: 自然科学版, 2006, 31(2): 133-136. |
| [14] | Dulak J, Jozkowicz A. Carbon monoxide:a ""new"" gaseous modulater of gene expression[J]. Acta Biochim Pol, 2003, 50(15): 31-48. |
| [15] | Longom M, Jain V, Vedernikov Y P, et al. Effect of nitric oxidean and carbon monoxide on uterine contractility during human and rat pregnancy[J]. Am J Obstet Gynecol, 1999, 181(4): 981-988. |
| [16] | Huang B K, Xu S, Xuan W, et al. Carbon monoxide alleviates salt-induced oxidative damage in wheat seedling leaves[J]. J Integr Plant Biol, 2006, 48(3): 249-254. |
| [17] | Liu K L, Xu S, Xuan W, et al. Carbon monoxide counteracts the inhibition of seed germination and alleviated oxidative damage caused by salt stress in Oryza sativa [J]. Plant Sci, 2007, 172(3): 544-555. |
| [18] | Xu J, Xuan W, Huang B K, et al. Carbon monoxide-induced adventitious rooting of hypocotyl cuttings from mung bean seedling[J]. Chin Sci Bull, 2006, 51(6): 668-674. |
| [19] | Xu S, Sa Z S, Cao Z Y, et al. Carbon monoxide alleviates wheat seed germination inhibition and counteracts lipid peroxidation mediated by salinity[J]. J Integr Plant Biol, 2006, 48(10): 1168-1176. |
| [20] | 李鹏民, 高辉远, Reto J S. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用[J]. 植物生理与分子生物学学报, 2005, 31(6): 559-566. |
| [21] | 林世青, 许春辉, 张其德, 等. 叶绿素荧光动力学在植物抗性生理学、生态学和农业现代化中的作用[J]. 植物学通报, 1992, 9(1): 1-16. |
| [22] | 周 洁, 张 霁, 郭兰萍, 等. 稀土元素镧对黄花蒿光合作用及青蒿素积累的影响[J]. 中草药, 2010, 41(8): 1371-1374. |
| [23] | 张春平, 何 平, 袁凤刚, 等. 外源5-氨基乙酰丙酸对干旱胁迫下草珊瑚叶绿素荧光特性及能量分配的影响[J]. 中草药, 2012, 43(1): 164-172. |
| [24] | Jaume F, Josefina B, José M. Effects of drought on photosynthesis in grapevines under field conditions:an evaluation of stomatal and mesophyll limitations[J]. Funct Plant Biol, 2002, 29(4): 461-471. |
| [25] | Colom M R, Vazzana C. Photosynthesis and PSIIfunctionality of drought-resistant and drought-sensitive weeping lovegrass plants[J]. Environ Experim Bot, 2003, 49(2): 135-144. |
| [26] | 赖齐贤, 包志毅, 朱祝军, 等. 干旱胁迫对转基因 (PSAG12-ipt) 非洲菊光合作用的影响[J]. 园艺学报, 2007, 34(1): 157-162. |
| [27] | 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003. |
| [28] | Demmig-Adams B, Adams W W III, Barker D H. Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J]. Physiol Plant, 1996, 98(2): 253-264. |
| [29] | Zhang S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J]. Chin Bull Bot, 1999, 16(4): 444-448. |
| [30] | Krause G H, Weis E. Chlorophyll fluorescence as a tool in plant physiologyII Interpretation of fluorescence signals[J]. Photosy Res, 1984, 5(2): 139-157. |
| [31] | Genty B E, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J]. Biochim Biophys Acta, 1989, 990(1): 87-92. |
| [32] | Van Kooten O, Snel J F H. The use of chlorophyll fluorescence nomeclature in plant stress physiology[J]. Photosyn Res, 1990, 25(3): 147-150. |
| [33] | Tang L J, Li B S, Tang C Q, et al. Geographical variation in the parameters of chlorophyll fluorescence induction kinetics of pinus armandi and its relations with the growth of tree height[J]. Acta Phytoecol Sini, 1997, 21(5): 474-479. |
| [34] | 惠红霞, 许 兴, 李前荣. 外源甜菜碱对盐胁迫下枸杞光合功能的改善[J]. 西北植物学报, 2003, 23(12): 2137-2142. |
| [35] | Powle S B. Photoinhibition of photosynthesis induced by visible light[J]. Rev Plant Physiol, 1984, 35(6): 15-44. |
| [36] | Ara E M, Virgin I, Andersson B. Photoinhibition and D1 protein degradation in peasacclimated to different growth irradiance[J]. Plant Physiol, 1993, 103(3): 835-843. |
| [37] | Everard J D, Gucc R, Kann S C, et al. Gas exchange and carbon partitioning in the leaves of celery (Aptium Graveolens L.) at various level of root zone salinity[J]. Plant Physiol, 1994, 106(1): 281-292. |
| [38] | Willekens H, Vancamp W, Lnze D, et al. Ozone, sulfurdioxide, and ozone ultraviolet-B have similar effect on mRNA accumulation of antioxidant genes in Nicotiana plumbaginifolia L.[J]. Plant Physiol, 1994, 106(3): 1007-1014. |
| [39] | Demmig B, Bjorkman O. Comparison of effect of excessive light on chlorophyll fluorescence (77k) and photon yield of O2 evolution in leaves of plant[J]. Planta, 1987, 171(2): 171-184. |
| [40] | Zhang S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance[J]. Chin Bull Bot, 1999, 16(4): 444-448. |
| [41] | Xu C C, Zhang J H. Effect of drought on chlorophyll fluorescence and xanthophyll cycle components in winter wheat leaves with different ages[J]. Acta Phytophysiol Sini, 1999, 25(1): 29-35. |
| [42] | Carrasco R M, Rodriguez J S, Perez P. Changes in chlorophyll fluorescence during the course of photoperiod and in response to drought in Casuarina equisetifolia Forst and Forst[J]. Photosynthetica, 2002, 40 (3): 363-368. |
| [43] | Havaux M, Strasser R J, Greppin H. Atheoretical and experimental analysis of the qP and qN coefficients of chlorophyll fluorescence quenching and their relation to photochemical land non photochemical event[J]. Photosyn Res, 1991, 27(1): 41-45. |
| [44] | Quick W P, Chaves M M, Wendler R, et al. The effect of water stress on photosynthetic carbon metabolism in fourspecies grown under field conditions[J]. Plant Cell Environ, 1992, 15(1): 25-35. |
| [45] | Lal A M, Ku S B, Edwards G E. Analysis of inhibition of photosynthesis due to water stress in the C3 species Hordeum vulgare and Vicia faba: electron transport, CO2 fixation and carboxylation capacity[J]. Photosyn Res, 1996, 49(1): 57-69. |
 2015, Vol. 46
2015, Vol. 46

