麻黄汤为张仲景《伤寒论》的名方,由麻黄、桂枝、杏仁、甘草4味中药组成,具有发汗解表、宣肺平喘之功效,主要用于呼吸道感染、支气管哮喘等症[1]。药理学研究证明麻黄中生物碱类成分是麻黄药理作用的代表性成分[2, 3],关于生物碱的提取分离、结构分析、定量测定[4]、药理研究等多见报道,因此,测定总生物碱的量对于控制其质量、确保疗效有重要意义。目前总生物碱的定量测定有重量法、酸碱滴定法、酸性染料比色法[5, 6, 7, 8],其中酸性染料比色法最为常见。
酸性染料比色法测定总生物碱传统上均以氯仿作为溶剂,萃取出水相中的生物碱再进行测定,而氯仿为易挥发的剧毒液体,对心、肝、肾有损害,甚至有致癌可能性,短时间或长期吸入其挥发性气体均可对操作者身体造成轻或重度的损害。传统萃取法多采用手动剧烈振摇法使生物碱在一定的pH介质中与酸性染料定量的结合形成有色络合物后采用分液漏斗对有机溶剂进行萃取、排气、静置、分层,其操作较为繁琐、难定量、易造成乳化现象,并需要操作者反复多次接触氯仿,增加操作者对氯仿的吸入量,且萃取法实验结果受分液漏斗振摇时间、静置分层时间、不同操作者手动振摇力度不一致等因素影响较大,因此造成实验重复性较差。
本实验对传统萃取法中的萃取、静置、分层等操作进行了改进,提出用涡旋法替代原用于提取总生物碱的萃取法的可行性,并通过对2种方法所测得的大鼠口服麻黄汤后血浆中总生物碱量及其药动学参数的比较和分析,验证涡旋法的科学性,为酸性染料比色法测定总生物碱提供改进方法,提高操作者的安全性和测试结果的准确性。
1 材料 1.1 仪器VXH-3微型旋涡混合器(上海跃进医疗器械厂);TDL80-2B台式离心机(上海安亭科学仪器厂);10~200、100~1 000 μL TopPette Pipettor移液器(上海恒奇仪器仪表有限公司);FA2004N电子天平(上海精密科学仪器有限公司);TU-1901双光束紫外可见分光光度计(上海分析仪器厂);KQ2200B型超声波清洗器(昆山超声仪器有限公司)。
1.2 药品与试剂麻黄汤各味中药购自安微协和成药业饮片有限公司,并由福建中医药大学中药鉴定教研室杨成梓副教授鉴定,分别为麻黄科植物草麻黄Ephedra sinica Stapf的草质茎、樟科植物肉桂Cinnamomum cassia Presl的干燥嫩枝、双子叶植物豆科甘草Glycyrrhiza uralensis Fisch的干燥根茎、蔷薇科植物杏Prunus armeniaca L. 的种仁;盐酸麻黄碱对照品(中国食品药品检定研究院,批号171242-200404,质量分数99.5%);溴甲酚绿、醋酸铵、醋酸、高氯酸、氢氧化钠、氯仿等均为分析纯。
1.3 动物健康雄性SD大鼠,清洁级,体质量180~200 g,上海斯莱克实验动物有限责任公司提供,许可证号SCXK(沪)2007-0005。
2 方法与结果 2.1 麻黄汤的制备[9]称取12倍麻黄汤处方量药材,即麻黄108 g、桂枝72 g、杏仁72 g、甘草21 g,加10倍量水,麻黄先煎20 min,再和余药共煎30 min,纱布粗滤去渣,浓缩至所需质量浓度(0.504 g/mL),即得。
2.2 对照品溶液的制备精密称取盐酸麻黄碱对照品5 mg,置25 mL量瓶中,加蒸馏水溶解并定容至刻度,作为对照品储备液(200 μg/mL)。分别精密吸取储备液0.2、0.4、0.6、0.8、1.0、1.2、1.6、2.0、2.4、4.0 mL于10 mL量瓶内,蒸馏水稀释并定容至刻度,配成质量浓度分别为4、8、12、16、20、24、32、40、48、80 μg/mL的对照品溶液。
2.3 溴甲酚绿酸性染料的配制[10]精密称取溴甲酚绿0.150 1 g,加pH值6.0的醋酸-醋酸铵缓冲溶液300 mL,摇匀,溶解,得0.05%溴甲酚绿缓冲溶液。
2.4 血浆样品的采集SD大鼠66只,随机分为11组,1组为对照组(ig生理盐水),另外10组为给药组,给药前禁食14 h,不禁水,给药组大鼠按5.04 g/kg剂量(10 mL/kg,相当于人临床等效剂量)分别ig给药,分别于给药后20、40、60、90、120、180、240、360、480、600 min[11]大鼠眼眶取血(每个时间点6只大鼠),放入EDTA采血管中,3 800 r/min离心10 min,取上层血浆部分,冷冻保存,备用。
2.5 酸性染料比色法中的萃取法 2.5.1 血浆样品的处理[12]取血浆0.5 mL,加6%高氯酸1.0 mL,旋涡混合器振荡2 min,以3 800 r/min离心10 min,吸取上清液置60 mL分液漏斗,加1 mol/L NaOH溶液0.8 mL,摇匀1 min,再加入CHCl3 5 mL,密塞,摇匀5 min,静置分层2 min,分取下层CHCl3液层,再加入pH 6.0溴甲酚绿缓冲溶液3 mL,充分振摇5 min,静置1 h,取氯仿层溶液在411 nm处测定吸光度(A)值。同时取0.5 mL空白血浆,同法操作,所得氯仿液作为参比,在411 nm处测定A值。
2.5.2 线性关系的考察取空白血浆各0.5 mL,分别加入4、8、12、16、20、40 μg/mL的对照品溶液各5 mL,按“2.5.1”项下方法,在411 nm处分别测定A值,以A值对质量浓度(C)进行线性回归,得回归方程A=0.017 1 C+0.235 5,r=0.985 5,表明以盐酸麻黄碱计,总生物碱在4~40 μg/mL与A值呈现良好线性关系。
2.5.3 精密度试验精密吸取大鼠空白血浆0.5 mL,加入对照品溶液配制成质量浓度为16 μg/mL的血浆样品,按“2.5.1”项下方法重复测定5次,结果RSD为0.77%(n=5),表明仪器精密度良好。
2.5.4 重复性试验取大鼠ig麻黄汤后1 h同1批血浆样品6份,按“2.5.1”项下方法测定,得总生物碱平均血药浓度为68.83 μg/mL,RSD为2.01%(n=6)。
2.5.5 方法回收率试验精密吸取大鼠空白血浆0.5 mL,加入对照品溶液配制成质量浓度为20 μg/mL的血浆样品6份,按“2.5.1”项下处理后进行分析,将麻黄总生物碱A值代入标准曲线,计算测得药物质量浓度,与加入量比较,考察样品的方法回收率,结果回收率为(95.63±1.84)%,RSD为1.92%。
2.6 酸性染料比色法中的涡旋法 2.6.1 血浆样品的处理取血浆0.5 mL,加6%高氯酸1.0 mL,旋涡混合器振荡2 min,以3 800 r/min离心10 min,吸取上清液置15 mL离心管,加1 mol/L NaOH溶液0.8 mL,涡旋1 min,再加入CHCl3 5 mL,密塞,涡旋5 min,以3 800 r/min离心2 min,精密吸取下层CHCl3液层,再加入pH 6.0溴甲酚绿缓冲溶液3 mL,涡旋5 min,静置10 min,取氯仿层溶液在411 nm处测定A值。同时取0.5 mL空白血浆,同法操作,所得氯仿液作为参比,在411 nm处测定A值。
2.6.2 线性关系的考察取空白血浆各0.5 mL,分别加入4、16、24、32、40、48、80 μg/mL的对照品溶液各5 mL,按“2.6.1”项下方法,在411 nm处分别测定A值,通过归一化,以A值对质量浓度(C)进行线性回归,得回归方程A=0.006 8 C+0.010 2,r=0.996 4,表明以盐酸麻黄碱计,总生物碱在4~80 μg/mL与吸光度呈现良好线性关系。
2.6.3 精密度试验精密吸取大鼠空白血浆0.5 mL,加入对照品溶液配制成质量浓度为40 μg/mL的血浆样品,按“2.6.1”项下方法重复5次测定A值,结果RSD为0.32%(n=5),表明仪器精密度良好。
2.6.4 重复性试验取大鼠口服麻黄汤后1.5 h的同一批血浆样品6份,按“2.6.1”项下方法测定A值,得总生物碱平均血药浓度为229.12 μg/mL,RSD为1.37%(n=6)。
2.6.5 方法回收率试验精密吸取大鼠空白血浆0.5 mL,加入对照品溶液配制成质量浓度为40 μg/mL的血浆样品6份,按“2.6.1”项下处理后进行分析,将麻黄总生物碱A值代入标准曲线,计算测得药物质量浓度,与加入量比较,考察样品的方法回收率,结果回收率为(111.55±0.29)%,RSD为0.26%。
2.7 总生物碱血药浓度的测定取采集时间为20、40、60、90、120、180、240、360、480、600 min的血浆样品,每个时间点、每种方法取3份样品,分别按萃取法和涡旋法对其中的总生物碱进行测定,结果见表 1。
| 表 1 萃取法和涡旋法测得麻黄汤总生物碱大鼠体内血药浓度( x±s , n=3) Table 1 In vivo blood concentration of total alkaloids from Mahuang Decoction in rats by vortex or extraction methods( x±s , n=3) |
将采集的所有血浆样品,分别按萃取法“2.5.1”项和涡旋法“2.6.1”项下方法进行测定,绘得平均血药浓度-时间曲线,见图 1。将所得的血药浓度-时间数据用3P97软件进行拟合,麻黄总生物碱的药动学参数见表 2。
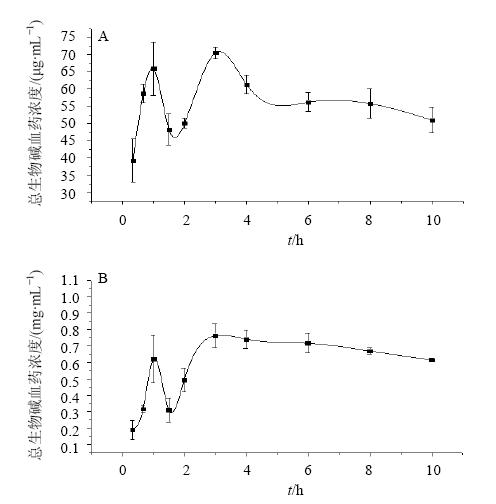 | 图 1 萃取法 (A) 和涡旋法 (B) 得到的麻黄总生物碱平均血药浓度-时间曲线Fig. 1 Mean blood concentration-time curves of total alkaloids from Mahuang Decoction by extraction method (A) and vortex method (B) |
| 表 2 麻黄总生物碱在大鼠体内的药动学参数 Table 2 In vivo pharmacokinetic parameters of total alkaloids from Mahuang Decoction in rats |
本实验主要通过考察涡旋法与传统萃取法对大鼠口服麻黄汤后血浆中总生物碱定量测定的影响,提出用涡旋法替代酸性染料比色法中原用于提取总生物碱的萃取法的可行性,并对2种方法优缺点进行比较,方法学考察均按照体外普通样品处理进行辅助验证,由表 1可知,从测得麻黄总生物碱的平均血药浓度上比较,2种方法差别较大,涡旋法为萃取法的5~12倍,表明涡旋法可最大限度提取总生物碱;萃取法和涡旋法的方法学确证结果显示RSD都是符合要求的,说明这2种方法皆可行,但萃取法中精密度、重复性、加样回收率的RSD均大于涡旋法,分别为涡旋法的2.41、1.47、7.38倍,因此涡旋法相比于萃取法具有明显优势。
酸性染料比色法中的传统萃取法影响因素较多,实验重复性较差,已有文献报道,同一样品相同时间萃取法的测定结果相差几倍甚至几十倍[13]。改进的涡旋法,在萃取方面,将实验转移至具塞离心管中进行,采用旋涡振荡器对络合物进行混合(力度一致),此改进避免由于人工手动振摇力度不一样从而引起的实验误差;在静置分层方面,采用离心机3 800 r/min离心2 min方法,而萃取法静置分层1 h,此改进大大减少氯仿静置分层的时间,同时解决氯仿充分振摇萃取时的乳化现象;在定量方面,采用移液枪对氯仿进行准确定量移取,此改进相对于萃取法排气放液进行定量更快捷、准确。在整个实验过程上,虽然氯仿用量没有减少,测定人员仍然直接面对比色皿中的氯仿溶液,但由于涡旋法大大缩短操作者与氯仿的接触时间及次数,且可以避免萃取法经常出现的漏液问题,从而减小氯仿对操作者的伤害,因此改进方法在安全性上有大大提高。
在前期多次反复的体内药动学研究中得出,大鼠受到的惊吓对体内代谢影响很大,因此本实验血浆样品的采集设10个给药组(即每个采血点1组,每组6只大鼠,一只大鼠只采一个时间点),分别于给药后大鼠眼眶取血,每个采血点取1.5~2 mL,此实验安排是为了避免在同一只大鼠由于需要完成10个血浆样品的采集而造成对大鼠的惊吓,同时避免由于大鼠失血过多而影响药物的体内代谢。
从所绘制的药-时曲线上看,在10 h药物并没有消除完全,因此拟合出的药动学参数并不是最佳结果,还需要增加采血时间点,相关后期研究正在进行中。血浆样品浓度在处理后的血浆样品中需要重新计算,理论上加入0.5 mL血浆被5 mL氯仿萃取完全,浓度稀释10倍。
综上所述,涡旋法具有快速、准确、稳定、重复性好、对操作者伤害小的特点,可最大限度获得酸性染料比色法中的总生物碱提取量,具有替代传统萃取法的科学性、现实性和必要性。
| [1] | 刘 鑫, 邹中兰, 梅全慧, 等. 干麻黄汤对慢性哮喘大鼠缺氧诱导因子-1α、血管内皮生长因子表达及气道重塑的影响[J]. 中国实验方剂学杂志, 2012, 18(8): 190-194. |
| [2] | 屈艳格, 陈 军, 王冬月, 等. 马钱子生物碱类成分经口给药后在大鼠体内的药动学研究[J]. 中草药, 2013, 44(8): 1008-1012. |
| [3] | 陈 勇, 沈少林, 陈怀侠, 等. HPLC-ESI-ITMSn 法鉴定麻黄碱及其大鼠体内主要代谢产物[J]. 药学学报, 2005, 40(9): 838-841. |
| [4] | 谢升谷, 祝 明. HPLC测定小儿清热止咳颗粒中盐酸麻黄碱和盐酸伪麻黄碱的含量[J]. 中国现代应用药学, 2010, 27(3): 255-257. |
| [5] | 周毅玲. 酸性染料比色法测定延胡索总生物碱的量[J]. 中草药, 2008, 39(8): 1257-1258. |
| [6] | 李文静, 徐 进, 景 霞, 等. 酸性染料比色法测定咳喘口服溶液中盐酸麻黄碱的含量方法改进[J]. 中国药房, 2013, 37(24): 3534-3636. |
| [7] | 张祖兵, 刘世伟, 杨 强, 等. 复方盐酸伪麻黄碱镶嵌缓释片的制备及其体外释放度的测定[J]. 华西药学杂志, 2005, 20(1): 18-20. |
| [8] | 索银科, 霍彬科. HPLC法测定咳喘清片中盐酸麻黄碱和盐酸伪麻黄碱[J]. 中草药, 2009, 40(增刊): 123-124. |
| [9] | 刘国清, 王 涛, 余林中, 等. 麻黄汤的发汗作用与M 受体的关系研究[J]. 中国药房, 2006, 17(16): 1210-1211. |
| [10] | 刘 悦, 邓沁涛, 张 帆. 不同产地哈萨克药材白喉乌头中总生物碱含量的分析[J]. 中国现代应用药学, 2012, 29(2): 126-128. |
| [11] | 贺 丰, 罗佳波, 陈飞龙, 等. 麻黄汤中麻黄碱、伪麻黄碱在人体药代动力学研究[J]. 中药药理与临床, 2005, 21(1): 1-3. |
| [12] | 贺 丰. GC-MS法研究麻黄汤中麻黄碱、伪麻黄碱的人体内过程[J]. 中药新药与临床药理, 2004, 15(5): 336-338. |
| [13] | 刘军凯, 雷泞菲, 吴虹霁, 等. 常见蔬菜中Vc含量的研究[J]. 广东微量元素科学, 2006, 13(4): 56-60. |
 2015, Vol. 46
2015, Vol. 46


