2. 中南林业科技大学生命科学与技术学院 生物技术与工程实验室, 湖南 长沙 410004;
3. 暨南大学药学院, 广东 广州 510632;
4. 广州中医药大学中药学院, 广东 广州 510006
2. Laboratory of Biotechnology and Engineering, College of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, China;
3. School of Pharmacy, Jinan University, Guangzhou 510632, China;
4. School of Chinese Materia Medica, Guangzhou University of Chinese Medicine, Guangzhou 510006, China
细辛Asari Radix et Rhizoma为马兜铃科植物北细辛Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag.、汉城细辛Asarum sieboldii Miq. var. seoulense Nakai或华细辛Asarum sieboldii Miq. 的干燥根和根茎[1],具有祛风散寒、祛风止痛、通窍、温肺化饮之功效。细辛化学成分主要含有萜类(挥发油的主要成分)、植物甾醇类、苯丙基及其苷类(如甲基丁香酚、黄樟醚等)、木脂素类(如细辛脂素)、生物碱及酰胺类(如马兜铃内酰胺)、有机酸类及其酯类(如马兜铃酸)等[2]。细辛除了有显著的临床功效外,同时还有小毒,“细辛不过钱,过钱命相连”的古训制约着细辛的临床应用,《中国药典》2010年版对其用量定为“1~3 g,散剂0.5~1 g”。据文献报道[3, 4, 5],细辛中主要的毒性成分马兜铃酸A与黄樟醚分别具有较强的肾毒性与致癌作用。可见,采用合适的方法尽可能地去除细辛中的毒性物质,提高细辛临床应用的安全性是细辛现代研究的必然趋势与必然要求。
有关细辛减毒的炮制方法研究报道中,主要以马兜铃酸A为评价指标进行炮制减毒,而同时考虑马兜铃酸A与黄樟醚2种毒性成分的减毒炮制方法未见报道。本实验借鉴传统中药炮制经验与文献方法,对细辛根采用10种炮制方法进行炮制,以马兜铃酸A和黄樟醚的量变化为评价指标评价不同炮制方法的减毒效果,探究细辛炮制减毒的方法,为细辛加工炮制和临床应用提供参考。
1 仪器与材料Agilent1200型高效液相色谱仪,美国安捷伦公司;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司。
细辛购于高桥药材大市场,经湖南中医药大学药学院中药鉴定教研室龚力民副教授鉴定为马兜铃科植物北细辛Asarum heterotropoides Fr. Schmidt var. mandshuricum (Maxim.) Kitag.;马兜铃酸A对照品,批号10281-201303,质量分数98%,购于南昌贝塔生物科技有限公司;黄樟醚对照品,批号201403,质量分数98%,购于四川香料厂;乙腈,色谱纯,美国Tedia公司;水为重蒸水,其他试剂均为分析纯。
2 方法与结果 2.1 炮制品的制备[6, 7] 2.1.1 酒制取细辛25 g,加入10 g黄酒拌匀,闷润,待黄酒被吸尽后,干燥,备用。
2.1.2 醋制取细辛25 g,加入20 g米醋拌匀,闷润,待米醋被吸尽后,干燥,备用。
2.1.3 蜜制取细辛25 g,加入6 g炼蜜拌匀,闷润,待蜜汁被吸尽后,干燥,备用。
2.1.4 碱制取细辛25 g,加入40倍0.01 mol/L的NaHCO3溶液浸泡3次,每次24 h,浸泡过的细辛干燥,备用。
2.1.5 碱醋制取细辛25 g,加入40倍0.01 mol/L的NaHCO3溶液浸泡3次,每次24 h,浸泡过的细辛置烘箱中干燥至干;将10 g米醋稀释2倍后,用醋将碱制后的细辛拌匀,闷制,润透,干燥,备用。
2.1.6 盐炙取细辛25 g,加入6 g粗盐,用适量清水(能够完全浸泡药材)浸泡,与药物拌匀,闷润5 min,置炒锅内用文火炒5 min,取出,冷却,干燥,备用。
2.1.7 姜炙取细辛25 g,加入生姜汁5 g,拌匀,充分闷润,待姜汗完全被吸尽后,再用文火炒干,取出,冷却,干燥,备用。
2.1.8 甘草制取细辛25 g,加入25 mL甘草汁拌匀,闷润,待甘草汁被吸尽后,干燥,备用。
2.1.9 炒焦取细辛25 g,置炒锅内用中火或武火炒,表面焦褐色,内部加深,焦香气,取出,冷却,备用。
2.1.10 米泔水制取细辛25 g,加入25 mL米泔水(第2次淘米水)拌匀,闷润,待米泔水被吸尽后,干燥,备用。
2.2 黄樟醚定量测定 2.2.1 供试品溶液的制备称取细辛生品及各炮制品粉末(过3号筛)约0.5 g,置于50 mL量瓶中,加入甲醇超声30 min,定容,摇匀,0.45 μm微孔滤膜滤过,即得供试品溶液。
2.2.2 对照品溶液的制备精密称取黄樟醚对照品42.3 mg,分别置100 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,再精密量取2.0 mL对照品溶液,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制成含黄樟醚84.6 μg/mL的对照品溶液。
2.2.3 色谱条件色谱柱为Agligent TC-C18柱(250 mm×4.6 mm,5 μm);体积流量1.0 mL/min;柱温30 ℃;检测波长285 nm;流动相为乙腈-0.2%醋酸水溶液,梯度洗脱程序:0~15 min,30%~35%乙腈;15~25 min,35%~42%乙腈;25~30 min,42%~45%乙腈;30~40 min,45%~90%乙腈;40~45 min;90%~30%乙腈。对照品及样品的色谱图见图 1。
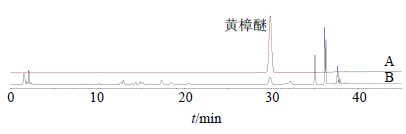 | 图 1 黄樟醚对照品 (A) 与酒制样品 (B) 的HPLC图Fig.1 HPLC of safrole reference substances (A) and wine-processed samples (B) |
精密吸取84.6 μg/mL的黄樟醚对照品储备溶液0.2、0.4、0.6、0.8、1.0 mL置于1.5 mL的EP管中,加甲醇使成1.0 mL,摇匀。分别吸取10 μL注入高效液相色谱仪,测定峰面积,以进样量为横坐标(X),峰面积为纵坐标(Y),进行线性回归,得回归方程Y=1.231 4 X-10.120,r=0.999 6,结果表明黄樟醚在169.2~846.0 μg有良好的线性关系。
2.2.5 精密度考察精密吸取同一供试品溶液(细辛生品),注入液相色谱仪,重复进样6次,按“2.2.3”项下色谱条件测定,黄樟醚峰面积的RSD为1.69%,表明仪器的精密度良好。
2.2.6 稳定性试验精密吸取同一供试品溶液(细辛生品)10 μL,注入液相色谱仪,分别于0、1、2、4、8、16、24 h检测,记录色谱图,黄樟醚峰面积的RSD为1.25%,表明供试品溶液于24 h内稳定。
2.2.7 重复性试验精密称取细辛粉末(北细辛生品)约0.5 g,共6份,按照“2.2.1”制备供试品溶液,精密吸取供试品溶液20 μL,分别注入液相色谱仪,记录色谱图,计算得黄樟醚质量分数的RSD为1.69%,表明该方法重复性好。
2.2.8 加样回收率试验取已测定黄樟醚量的细辛粉末(北细辛生品)约0.25 g,共6份,精密称定,准确加入适量黄樟醚对照品,照定量测定项下操作,测定其量,计算回收率,结果平均回收率为99.83%,RSD为1.67%。
2.2.9 生品与炮制品中黄樟醚的测定按照“2.2.1”项方法将生品与各炮制品制备成供试品溶液,在“2.2.3”项色谱条件下进行测定,计算各样品中黄樟醚的量以及各炮制品中黄樟醚去除率,结果见表 1。可知,黄樟醚的炮制去除效果的大小顺序为盐制>炒焦>米泔水制>碱制>甘草制>醋制>姜制>酒制>碱醋制>蜜制,其中盐制与炒焦对细辛中黄樟醚的去除率达到55%以上,可以有效减毒。
| 表 1 各炮制品中黄樟醚的量及其去除率比较 Table 1 Comparison on contents and removal rates of safrole among different processed products |
取细辛生品及各种炮制品粉末(过3号筛)约6 g,精密称定,置于具塞锥瓶中,加入150 mL甲醇(含2%甲酸)超声40 min,减压抽滤,滤液蒸干,回收甲醇,残渣用甲醇溶解,转移至10 mL量瓶中,定容,摇匀,0.45 μm微孔滤膜滤过,即得供试品溶液。
2.3.2 对照品溶液的制备精密称取马兜铃酸A对照品5.8 mg,置于10 mL的量瓶中,加入甲醇定容,摇匀,作为储备液备用。移取500 μL对照品储备液,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制成质量浓度为29 μg/mL的马兜铃酸A对照品溶液。
2.3.3 色谱条件检测波长316 nm;其余同“2.2.3”项。对照品及样品的色谱图见图 2。
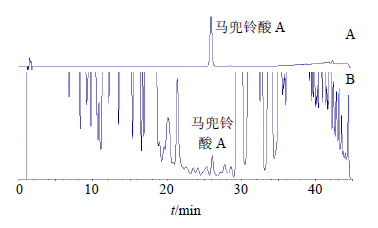 | 图 2 马兜铃酸A对照品 (A) 与酒制样品 (B) 的HPLC图Fig.2 HPLC of aristolochic acid A reference substance(A) and wine-processed sample (B) |
分别精密吸取29 μg/mL的马兜铃酸A对照品溶液40、80、120、160、200 μL置于1.5 mL的EP管中,加甲醇使成1.0 mL,摇匀。分别吸取10 μL注入高效液相色谱仪,测定峰面积,以进样量为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得回归方程为Y=2.382 8 X-3.360,r=0.999 6,结果表明马兜铃酸A进样量在11.6~58 ng有良好的线性关系。
2.3.5 精密度考察精密吸取同一供试品溶液(细辛生品),注入液相色谱仪,重复进样6次,按“2.3.3”项下色谱条件测定,马兜铃酸A的峰面积的RSD为1.19%,表明仪器的精密度良好。
2.3.6 稳定性试验精密吸取同一供试品溶液(细辛生品)10 μL,注入液相色谱仪,分别于0、1、2、4、8、16、24 h检测,记录色谱图,马兜铃酸A峰面积的RSD为1.17%,表明供试品溶液在24 h内稳定。
2.3.7 重复性试验精密称取约6.0 g北细辛生品粉末共6份,制备供试品溶液,精密吸取供试品溶液20 μL,分别注入液相色谱仪,记录色谱图,计算得马兜铃酸A质量分数的RSD为1.29%,表明该方法重复性好。
2.3.8 加样回收率试验取已测定马兜铃酸A量的细辛约3.0 g,共6份,精密称定,准确加入适量对照品,照定量测定项下操作,测定其量,计算回收率,结果平均回收率为101.43%,RSD为1.25%。
2.3.9 生品与炮制品中马兜铃酸A的测定按照“2.3.1”项下方法将生品与各炮制品制备成供试品溶液,在“2.3.3”项色谱条件下进行测定,计算各样品中马兜铃酸A的量以及各炮制品中马兜铃酸A去除率,结果见表 2。可知,马兜铃酸A的炮制去除效果的大小顺序为炒焦>碱醋制>盐制>碱制>醋制>米泔水制>甘草制>酒制>蜜制>姜制,其中炒焦对细辛中马兜铃酸A的去除率达到60%以上,可以有效减毒。
| 表 2 各炮制品中马兜铃酸A的量及其去除率比较 Table 2 Comparison on contents and removal rates of aristolochic acid A among different processed products |
文献报道[8]马兜铃酸A的UV检测波长有250、223、390 nm等。本课题组对细辛生品及炮制品测定时,发现250 nm的吸收峰较大,但同时基线噪音大、干扰大。而有文献报道[9]马兜铃酸A在316 nm处具有稳定、吸收强等特点,本实验选择316 nm时,马兜铃酸A附近的干扰较少,吸收较好,因而选择316 nm为马兜铃酸A检测波长。
马兜铃酸A的分析常用乙腈或甲醇与含少量酸的水作为流动相,乙腈的分离效果优于甲醇,在实验中,比较了乙腈-0.2%醋酸水溶液、乙腈-0.5%醋酸水溶液、乙腈-1%醋酸水溶液的分离效果,其中乙腈-0.2%醋酸水溶液分离效果较好。因此,选用乙腈-0.2%醋酸水溶液作为流动相进行梯度洗脱,并在本实验的色谱条件下,可将马兜铃酸A与黄樟醚很好地分离。由于马兜铃酸A的量很低,与黄樟醚的样品处理方法不同,因而没有在同一色谱条件下同时测定,而是采用分别测定的方法。
测定马兜铃酸A的样品处理中,溶剂考察了甲醇与含2%甲酸的甲醇,甲醇-2%甲酸溶液的提取效果较好,所含的马兜铃酸A的量较高,与文献报道一致。样品处理方面,由于样品中马兜铃酸A的量非常低,低于限量标准,参照《中国药典》2010年版方法测定时马兜铃酸A的量达不到定量限,而采用本实验的样品处理方法处理样品可以较好地测定马兜铃酸A的量,且方法学考察合格。
本实验首次探讨10种炮制方法对细辛中2种毒性成分影响,发现10种炮制方法均能降低细辛中毒性成分马兜铃酸A和黄樟醚的量,其中炒焦的炮制方法明显优于其他炮制方法。马兜铃酸A的量由1.08 μg/g(生品)降到0.39 μg/g(炒焦品),去除率达到63%;黄樟醚的量由3.72 mg/g(生品)降到1.65 mg/g(炒焦品),去除率达到56%。黄樟醚为较强的挥发性成分,在炒制过程中容易挥发散失而达到减毒的目的;而有关马兜铃酸A炒焦减毒的机制有待进一步研究。另外,课题组对马兜铃酸B的减毒效果也做了一定的研究,发现生品中马兜铃酸B的量很低,经炒焦炮制后未见到马兜铃酸B的色谱峰,表明炒焦炮制对毒性成分马兜铃酸B也有去除作用。由于炮制品中马兜铃酸B痕量而难达到检测限与定量限,所以未对其进行定量研究。有文献报道[10]炒焦能较好地保留有效成分甲基丁香酚和细辛脂素,可见,细辛采用炒焦炮制既可以去除毒性成分又能较好地保留有效成分,达到很好地减毒存效的效果。这为《本草纲目拾遗》中“去叶节炒焦”“北细辛烘干”和《圣济总录》中“去苗叶炒”的传统理论提供了炮制减毒的现代科学依据。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 杨春澍, 孙建宁, 黄建梅. 细辛属和八角属中药研究与应用[M]. 北京: 人民卫生出版社, 2006. |
| [3] | Zeng Y, Yang X, Wang J, et al. Aristolochic acid I induced autophagy extenuates cell apoptosis via ERK 1/2 pathway in renal tubular epithelial cells[J]. PLoS One, 2012, 7(1): e30312. |
| [4] | Jin M, Kijima A, Suzuki Y, et al. Comprehensive toxicity study of safrole using a medium-term animal model with gpt delta rats[J]. Toxicology, 2011, 290(2/3): 312-321. |
| [5] | 王潇晗, 张连学, 郜玉钢, 等. 含马兜铃酸中药减毒的研究进展[J]. 中草药, 2013, 44(22): 3241-3244. |
| [6] | 刘雅婧. 细辛中马兜铃酸的炮制脱毒研究[D]. 长春: 吉林农业大学, 2008. |
| [7] | 张春红, 曹 蕊, 李虔全, 等. 不同炮制方法对关木通减毒存效作用的比较[J]. 中国实验方剂学杂志, 2012, 18(10): 149-151. |
| [8] | 袁金斌. 马兜铃酸类物质的液相色谱联用技术及应用[D]. 长沙: 湖南大学, 2008. |
| [9] | Guo L, Yue H, Cai Z. A novel pre-column fluorescent derivatization method for the sensitive determination of aristolochic acids in medicinal herbs by high-performance liquid chromatography with fluorescence detection[J]. J Pharm Biomed Anal, 2010, 53(1): 37-42. |
| [10] | 黄 鲛, 易进海, 刘玉红, 等. 炒制对细辛中黄樟醚、甲基丁香酚和细辛脂素含量的影响[J]. 中国实验方剂学杂志, 2013, 19(19): 2709-27 |
 2015, Vol. 46
2015, Vol. 46


