环糊精能够在眼用处方中通过增溶作用来增加脂溶性药物的溶解度和稳定性,从而避免通过使用有机溶剂增加脂溶性药物在水中的溶解度,增强药物在眼部的生物利用度和稳定性[1]。β-环糊精(β- cyclodextrin,β-CD)直接作用于角膜上皮细胞,能够促进黏膜通透性,有望成为眼部给药的渗透促进剂。环糊精在水中溶解度较低(在室温下为18.5 g/L[2]),近年来对其衍生物的研究越来越多,羟丙基-β-环糊精(hydroxypropyl-β-CD,HP-β-CD)在水中的溶解度较高,因此相对于β-CD,HP-β-CD在眼用制剂中应用更多,其通过眼组织渗透进入细胞膜提取脂溶性物质,是一种耐受能力强、安全、刺激性低的新型眼用吸收促进剂[3, 4, 5]。
与中性HP-β-CD相比,磺丁基醚-β-环糊精(sulfobutyl-ether-β-CD,SBE-β-CD)带有负电荷,每个分子上结合有7个钠离子,在水中可以完全解离,形成较强的渗透压,能显著地提高药物的稳定性,并明显减少药物对眼部的刺激性[6]。这3种环糊精相比,SBE-β-CD作为滴眼剂的辅料不仅显著降低了药物对眼部的刺激性,而且能显著增加药物稳定性,应用于眼用制剂之中表现出良好潜力,有望成为高效且安全的渗透促进剂[7]。
姜黄素具有抗炎、抗氧化、抗纤维化、抗诱导凋亡的眼部药理作用[8],但由于姜黄素水溶性低,如何增加其眼部生物利用度是眼用制剂的重要任务。因此,本研究以姜黄素为模型药物,通过离体角膜扩散实验,研究3种环糊精对姜黄素角膜渗透性的影响,从而明确作为新型渗透促进剂的β-CD、HP-β-CD、SBE-β-CD是否具有良好的眼用促渗作用,为筛选新型眼用促渗剂提供生物药剂学依据。
1 仪器与材料YB-P6智能透皮实验仪,天津市鑫洲科技有限公司;SZCL-4B智能磁力加热搅拌器,巩义市予华仪器有限责任公司;改良Franz扩散池,上海锴凯科技贸易有限公司;Waters-e2695-HPLC系统,包括四元梯度泵,在线真空脱气机,自动进样器,柱温箱,2998光电二极管阵列检测器PDA,Empower 2色谱工作站;BT125D型分析天平,德国Sartarius公司。
姜黄素对照品,质量分数98%以上,批号0823- 9802,中国食品药品检定研究院。姜黄素提取物,质量分数95%以上,南京泽朗科技有限公司。β-CD,广东省郁南县永光味精实业有限公司;HP-β-CD,法国Roquette公司;SBE-β-CD,广东省郁南县永光味精实业有限公司;以上3种环糊精质量分数均在98%以上。聚山梨酯80,天津博迪化工股份有限公司;葡萄糖,北京索莱宝科技有限公司;氧化谷胱甘肽,北京索莱宝科技有限公司;氯化钠、氯化钾、磷酸二氢钠、碳酸氢钠、氯化钙、氯化镁,天津市化学试剂批发公司;其他试剂均为分析纯。
2 方法及结果 2.1 溶液的配制 2.1.1 对照品溶液的配制精密称取姜黄素对照品2.00 mg,置20 mL量瓶中,加甲醇溶解并稀释至刻度,得质量浓度为100 μg/mL的对照品储备液,稀释至10 μg/mL置4 ℃冰箱中保存备用。
2.1.2 扩散介质的配制2%聚山梨酯80-谷胱甘肽-碳酸氢钠林格溶液(GBR),此溶液由2部分溶液组成:I部分含有12.40 g/L氯化钠、0.72 g/L氯化钾、0.21 g/L磷酸二氢钠及4.91 g/L碳酸氢钠;II部分含有0.23 g/L氯化钙、0.32 g/L氯化镁、1.80 g/L葡萄糖及0.18 g/L氧化谷胱甘肽。上述2部分溶液均置于4℃冷藏保存,使用前等量混合。
2.1.3 样品溶液姜黄素角膜透过实验接收池中所得的接收液。
2.1.4 空白对照溶液角膜透过实验供给池为空白液时接收池中所得的溶液。
2.2 姜黄素的HPLC测定条件及专属性考察色谱柱Diamonsil C18(2)(200 mm×4.6 mm,5 μm),流动相为0.05%甲酸水溶液-甲醇(20∶80),体积流量1 mL/min,检测波长425 nm,进样量10 μL,柱温30 ℃。对照品、样品和空白对照的色谱图见图 1。
 | 图 1 姜黄素对照品 (A)、样品 (B) 和空白对照 (C) 的HPLC图Fig.1 HPLC of curcumin reference substance (A),sample (B),and blank control (C) |
药物的亲脂性是影响角膜透过性的一个重要因素。测定药物亲脂性常用的方法是测定其表观油水分配系数(P),其公式为P=(Cw1-Cw2)/Cw2,其中,Cw1为水相中原有药物质量浓度,Cw2为分配达平衡后水相中药物质量浓度。
实验采用经典的摇瓶法测定姜黄素的P,以正辛醇作为油相。精密量取用水饱和24 h后的正辛醇溶液2 mL置于西林瓶中,同时加入2 mL姜黄素饱和水溶液,置于37 ℃恒温水浴中持续振荡,48 h平衡后取样。将西林瓶中的混悬液置于离心管中,4 000 r/min保温离心10 min,取水层适量,稀释,通过0.45 μm微孔滤膜,进样HPLC测定,计算P值。角膜吸收理想药物的P值为100~1 000,即lgP为2.0~3.0的药物角膜透过性最好[9]。由实验结果(表 1)可知,姜黄素的P为436.000±0.111,lgP为2.638±0.019(n=3),由于姜黄素的水溶性很差,脂溶性较强,因此需要加入渗透促进剂增加药物溶解度,提高角膜透过性。
| 表 1 P值测定结果 Table 1 Analysis results of P value |
实验所用装置为改进的Franz立式扩散池,由2个等内径的供给池和接收池组成,有效扩散面积为0.50 cm2,容积4.5 mL。
2.4.2 扩散介质以2%聚山梨酯80-谷胱甘肽-碳酸氢钠林格溶液(GBR)(35.0±0.5)℃为扩散介质,配制方法同“2.1.2”项,文献报道该生理溶液可保存离体角膜达6 h[10]。
2.4.3 角膜渗透参数的计算离体角膜渗透参数由以下公式求得。

Qn为单位面积累积透过量,Cn为t时刻药物的质量浓度,Ci为t时刻前的质量浓度,V0为接收池中溶液体积(4.5 mL),V为取样体积(4.5 mL),Papp为表观渗透系数,C0为供给池初始药物质量浓度(1 mg/mL),A为有效扩散面积(0.5 cm2),ΔQ/Δt可由累积透过量-时间曲线稳态部分的斜率求得,Jss为稳态渗透速率
2.4.4 3种环糊精对姜黄素角膜透过率的影响取家兔,雌雄兼用,体质量在2~3 kg,自由饮食。实验时选用健康无眼疾的家兔,耳缘静脉注射空气致死,在死后20 min内用眼科剪刀和眼科镊子小心分离出角膜,除去巩膜、虹膜、睫状体等多余组织,用蒸馏水冲洗,吸干附着的水分。将新鲜离体角膜小心固定在渗透装置的供给池和接收池之间,在接收池中注满新鲜配制的2%聚山梨酯80-GBR溶液,在供给池中加入姜黄素质量浓度为1 mg/mL的不同质量分数的环糊精溶液0.5 mL,温度控制在(35±1)℃,同时供给池和接收池需密封,防止蒸发。实验开始后分别在40、80、120、160、200、240、280 min从接收池中取全量接收液,同时补充全量同温的2%聚山梨酯80-GBR溶液。用HPLC测定,采用SPSS 19.0软件对数据进行独立样本t检验,结果以x±s表示。不同质量分数的3种环糊精对姜黄素角膜渗透参数的影响见表 2,趋势图见图 2。
| 表 2 3种环糊精对姜黄素角膜渗透参数影响 (x±s,n=3) Table 2 Effects of three kinds of cyclodextrin on corneal permeability parameters of curcumin (x±s,n=3) |
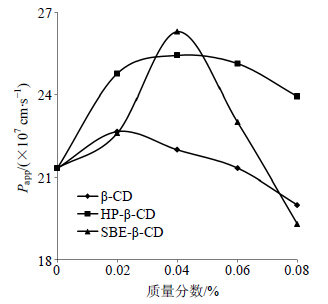 | 图 2 3种环糊精对姜黄素离体角膜透过率的影响Fig.2 Effect of three kinds of cyclodextrin on in vitro corneal permeability of curcumin |
结果表明当β-CD质量分数小于0.02%时,姜黄素的Papp随着质量分数的升高而增大。当β-CD的质量分数大于0.02%时,姜黄素的Papp随着质量分数的升高而减小,姜黄素的角膜Papp分别增加了1.06、1.03、1.00、0.95倍,与对照组比较无显著性差异(P>0.05)。β-CD分子在水中溶解度较低,因此增加药物角膜Papp并不明显。
当HP-β-CD质量分数小于0.04%时,姜黄素的Papp随着HP-β-CD质量分数的升高而增大。HP-β- CD质量分数为0.04%和0.06%时,姜黄素的Papp分别增加了1.19和1.17倍,与对照组相比均具有显著性差异(P<0.05),而质量分数为0.02%和0.08%时,姜黄素的角膜Papp增加1.16、1.12倍,与对照组相比无显著性差异(P>0.05)。HP-β-CD水溶性很高(室温下溶解度可达到80%以上[11]),在醇水溶液中溶解无结晶,在体内外环境中可以促使药物迅速释放[12],所以相比β-CD,HP-β-CD的促渗效果更加显著。
姜黄素的Papp随着SBE-β-CD质量分数的升高先增大后减小,SBE-β-CD质量分数为0.04%时,姜黄素的Papp增加了1.23倍,与对照组相比具有显著性差异(P<0.05),而质量分数为0.02%、0.06%、0.08%时,姜黄素的角膜Papp增加1.06、1.08、0.90倍,与对照组相比无显著性差异(P>0.05)。SBE- β-CD的药物角膜Papp增加倍数比HP-β-CD高。
2.4.5 角膜透过释药曲线以3种环糊精为渗透促进剂的姜黄素溶液角膜透过释药数据可用以下几种常用的数学模型进行拟合。
零级方程:Y=Kt
一级方程:ln(1-Y)=-Kt
Higuchi方程:Y=Kt1/2
Ritger-Peppas方程:lnY=Klnt+C
Weibull方程:lnln[1/(1-Y)]=Klnt-C
Y为t时间的累积释放率,t为取样时间,K为释药常数,C为释放速率常数
采用上述5种数学模型对姜黄素溶液角膜透过释放度进行拟合,结果见表 3。
| 表 3 数学模型方程拟合表 Table 3 Mathematical model equation fitting |
由释放曲线和数学拟合可知,以β-CD、HP-β-CD作为眼用渗透促进剂时,姜黄素溶液释放曲线符合一级释放方程(r=0.998 3、0.998 0),以SBE- β-CD作为眼用渗透促进剂时,姜黄素溶液释放曲线符合零级释放方程(r=0.997 8),药物零级释放即恒速释放。
β-CD通过增溶作用来增加水溶性差的药物在水中的溶解度,增强药物的生物利用度和稳定性,从而达到渗透促进的作用。HP-β-CD是β-CD的羟烷基化衍生物,优于β-CD的是HP-β-CD通过延长药物滞留时间促进药物渗透[9]。SBE-β-CD是β-CD葡萄糖单元的2、3、6位碳羰基以及1,4-丁烷磺内酯发生取代反应的产物。SBE-β-CD的分子结构中含有7个负离子和7个磺酸钠阳基团,水溶性极好,溶解形成的高浓度药液能够提高药物溶解度,从而促进药物释放[13]。有研究表明,SBE-β-CD作为眼用促渗剂不仅对眼部刺激性低,有良好的生物相容性[14],还能够使药物的释放过程更持久、更稳定、更安全。
2.5 3种环糊精对角膜水化值的影响角膜水化值(hydration level,HL)是体外评价物质对该组织刺激性的重要指标,本实验以此来考察该实验条件下对角膜是否有损伤。离体角膜透过实验结束后,将暴露于扩散介质的角膜区域剪下,称定质量(Ww);60 ℃干燥12 h后,再次称定质量(Wd)。角膜HL按下式计算。
HL=1-Wd/Ww
实验中几个实验组的角膜HL与新剥离角膜的HL比较略有升高,但均未超过83%的限度,不同质量分数的3种环糊精对角膜HL没有显著影响,表明实验过程中没有对角膜上皮细胞和内皮细胞造成损伤,实验组的样品均对角膜无明显刺激性,结果见表 4。
| 表 4 3种环糊精对角膜HL的影响 (x±s,n=3) Table 4 Effects of three kinds of cyclodextrin on corneal HL (x±s,n=3) |
环糊精是直链淀粉在由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的一系列环状低聚糖,通过增加难溶性药物的溶解度来促进药物的渗透,因此环糊精应用于眼用制剂安全无刺激,具有良好前景[15]。HP-β-CD是β-CD的一种羟烷基化衍生物,基本上保留了β-CD特性,增强药物的生物利用度,延长药物滞留时间来维持药物的释放[9, 16]。此外,还具有表面活性低,溶血活性低,水溶性很高,在醇水溶液中不结晶,在生物体内可以促使药物迅速释放等优点,适合用于眼部给药系统。目前,SBE-β- CD在注射药、口服药、鼻腔用药等方面已有较好的应用[17]。本实验通过3种环糊精的筛选,发现SBE-β-CD应用于眼部不仅有良好的增溶作用,还具有优良的生物相容性[7, 18],研究结果显示,SBE-β-CD作为眼用促渗剂不仅无眼部刺激性,而且按零级速率恒速释放,其疗效更为稳定。相比这3种环糊精,SBE-β-CD应用于眼用制剂之中表现出良好潜力,能够作为高效且安全的新型眼部促渗剂。
角膜水化程度对药物渗透作用有很大的影响,新鲜家兔角膜水化程度应维持在75%~80%为目标范围,但进行体外实验时并不能人为控制角膜HL在固定范围内,即使接受液为等渗缓冲液,随着时间的累积角膜的水化程度仍然会增加,随着水化程度和角膜厚度的增加,通过角膜扩散的药物量会随之减少[18]。采用GBR作为接受液可以使角膜维持在一个固定厚度,延长其生理能力,从而保证离子转运系统的正常运作。在体外评价中,角膜HL是物质对该组织刺激性的重要指标,超过83%即可判定角膜受到一定程度的损伤[19]。本实验中,渗透过的角膜水化平均值为81.7%,属于正常安全范围,表明制剂对角膜无明显刺激性,可作为新型的药物载体制剂对眼病发挥作用。
| [1] | 刘 睿. 眼用吸收促进剂通透性及其作用机制的研究进展[J]. 中成药, 2013, 35(7): 1531-1535. |
| [2] | 王 钊. β-环糊精衍生物包合齐墩果酸的生物利用度研究[D]. 西安: 第四军医大学, 2013. |
| [3] | 张 颖, 高永良. 环糊精及其衍生物在眼用制剂中的应用[J]. 国外医学: 药学分册, 2006, 33(2): 143-147. |
| [4] | 王丽娟, 车坷科, 朱照静. 羟丙基-β-环糊精对泊洛沙姆温敏凝胶形成的影响[J]. 中国药科大学学报, 2014, 45(1): 54-58. |
| [5] | 吴纯洁, 齐红艺, 黄春燕, 等. 羟丙基-β-环糊精对葛根素溶解性与角膜渗透性的影响[J]. 中国药学杂志, 2006, 41(20): 1565-1568. |
| [6] | Okimoto K, Tokunaga Y, Ibuki R, et al. Applicability of (SBE) 7m-beta-CD in controlled-porosity osmotic pump tablets (OPTs)[J]. Int J Pharm, 2004, 286(1/2): 81-88. |
| [7] | 张春红, 叶雪梅, 吴继禹. 磺丁基醚-β-环糊精在更昔洛韦滴眼液制备中的应用[J]. 中国药师, 2010, 13(5): 676-678. |
| [8] | 文 磊, 温耀春, 顾起宏. 天然药物在后发性白内障治疗的研究进展[J]. 实用防盲技术, 2011, 6(4): 178-180. |
| [9] | 陆 彬. 药物新剂型和新技术[M]. 第2版. 北京: 人民卫生出版社, 2005. |
| [10] | Liu R, Liu Z D, Zhang C G, et al. Gelucire44/14 as a novel absorption enhancer for drugs with different hydrophilicities: in vitro and in vivo improvement on transcorneal permeation[J]. J Pharm Sci, 2011, 100(8): 3186-3195. |
| [11] | 张小华. 甲砜霉素-羟丙基-β-环糊精包合物的制备, 鉴定与药代动力学研究[D]. 苏州: 苏州大学, 2009. |
| [12] | Kesavan K, Kant S, Singh P N, et al. Effect of hydroxypropyl-β-cyclodextrin on the ocular bioavailability of dexamethasone from a pH-induced mucoadhesive hydrogel[J]. Curr Eye Res, 2011, 36(10): 918-929. |
| [13] | 曹雅培, 何朝星, 曹德英. 以磺丁基醚-β-环糊精为渗透活性物质的盐酸氨溴索渗透泵片的制备[J]. 中国新药杂志, 2012, 21(18): 2212-2216. |
| [14] | 刘志东, 郭 宏, 李佳玮, 等. 羟丙基-β-环糊精对依诺沙星角膜透过性的影响[J]. 沈阳药科大学学报, 2004, 21(4): 250-252. |
| [15] | Zhang H, Chen M, He Z, et al. Molecular modeling-based inclusion mechanism and stability studies of doxycycline and hydroxypropyl-β-cyclodextrin complex for ophthalmic delivery[J]. AAPS Pharm Sci Tech, 2013, 14(1): 10-18. |
| [16] | 张卫敏, 任晓文, 徐为人, 等. 分子模拟技术在释药技术中的应用[J]. 药物评价研究, 2012, 35(2): 86-89. |
| [17] | 曹雅培, 王 静, 曹德英. 药用辅料磺丁基醚-β-环糊精在不同制剂中的应用进展[J]. 中国药房, 2012, 23(1): 79-82. |
| [18] | Tanito M, Hara K, Takai Y, et al. Topical dexamethasone-cyclodextrin microparticle eye drops for diabetic macular edema[J]. Invest Ophthalmol Vis Sci, 2011, 52(11): 7944-7948. |
| [19] | Delong M A, Sturdivant J M, Royalty S M. Beta-and gamma-amino-isoquinoline amide compounds and substituted benzamide compounds: US, 2014024920113/ 442263[P]. 2012-04-09. |
 2015, Vol. 46
2015, Vol. 46


