2. 沈阳药科大学, 辽宁 沈阳 110016
2. Shenyang Pharmaceutical University, Shenyang 110016, China
牛蒡Arctium lappa L. 为菊科(Compositae)牛蒡属Arctium L. 两年生草本植物,又名“恶实”、白肌人参或蒡翁菜等,其果实、根和叶均可作为药用,同时又是重要的经济作物,在我国各地均有分布。牛蒡子为《中国药典》2010年版收载常用中药,用于治疗风热感冒、咳嗽痰多、麻疹、风疹、咽喉肿痛等症[1]。目前国内外对牛蒡根的研究与应用尚局限,没有形成中药类的商品,也未收入药典,多作为牛蒡子的副产品而废弃不用。本课题组前期发现牛蒡根经乙醇提取后的醋酸乙酯萃取物对谷氨酸诱导的神经损伤具有较好的保护活性[2]。在此基础上,为了进一步探究牛蒡根醋酸乙酯萃取物的化学成分,对其进行系统提取分离,从中分离鉴定了8个咖啡酸类化合物,分别为1,5-O-dicaffeoyl-3-O- (4-malic acid methyl ester)-quinic acid(1)、3,5-二咖啡酰奎宁酸甲酯(3,5-O-dicaffeoyl-quinic acid methyl ester,2)、3,4-二咖啡酰奎宁酸甲酯(3,4-O-dicaffeoyl- quinic acid methylester,3)、4,5-二咖啡酰奎宁酸甲酯(4,5-O-dicaffeoyl-quinic acid methyl ester,4)、(2E)-1,4-dimethyl-2-[(4-hydroxyphenyl) methyl]-2- butenedioicacid(5)、绿原酸甲酯(chlorogenic acid methyl ester,6)、咖啡酸甲酯(caffeic acid mtheyl ester,7)、3,4,3′,4′-tetrahydroxy-δ-truxinate(8)。结构见图 1。其中化合物1为新化合物,化合物5为新天然产物,化合物2~4、6、7为首次从该植物中分离得到,化合物8为首次从该属植物中分离得到。体外活性测试发现,此类化合物均有不同程度的神经保护活性。其中化合物1、2、5活性较好,在15 μmol/L给药浓度下神经保护率分别达到48.86%、40.79%、39.31%。
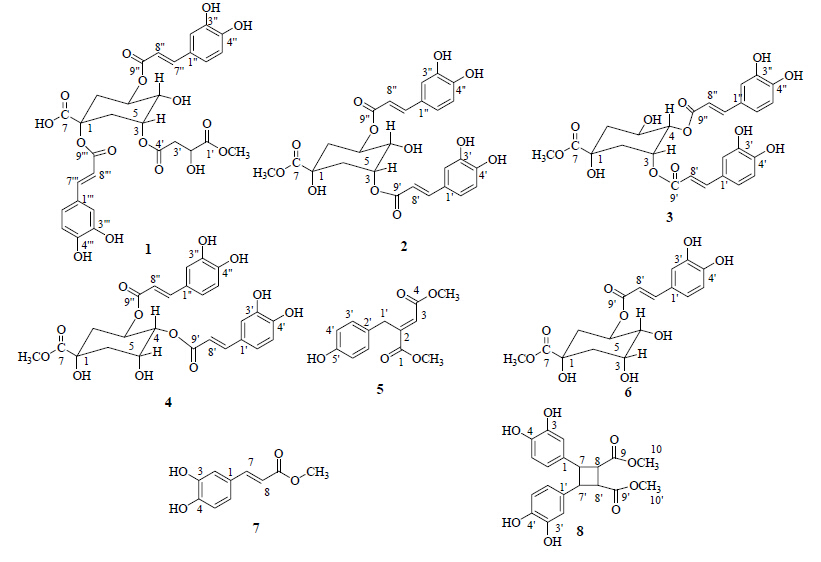 | 图 1 化合物1~8的结构式Fig.1 Structures of compounds 1—8 |
JASCO制备型高效液相色谱仪,加压泵PU-2087 Pump,紫外检测器SPD-10AV,日本分光株式会社;核磁共振光谱仪Bruker ARX-300,瑞士Bruker公司;EYELA-N1000、N1100旋转蒸发仪,日本东京理化;CO2培养箱,日本SANYO公司;水平层流洁净工作台,上海上净净化设备有限公司;倒置显微镜,日本OLYMPUS公司;低/高速台式离心机,上海安亭科学仪器厂;酶标仪,伯乐生命医学产品有限公司;紫外线分析灯,德国HERUENS公司;SHIMADZU AUW120D十万分之一分析天平,日本Shimadzu公司;HH-D4数显恒温水浴锅,丹瑞公司;制备反相色谱柱YMC-Pack Pro ODS-A C18(250 mm×10 mm,10 μm)、反相色谱硅胶ODS(50 μm),日本YMC公司;薄层色谱硅胶GF254及柱色谱硅胶(100~140、200~300目),青岛海洋化工厂;葡聚糖凝胶Sephadex LH-20,美国Amersham Biosciense公司;柱色谱MCI GEL CHP20p,日本YMC公司;色谱甲醇,天津四友公司;色谱乙腈,美国Fisher Scientific公司;DMEM培养液,美国Hyclone公司;胎牛血清,美国Hyclone公司;胰酶,美国Sigma公司;EDTA,美国Sino公司;台盼蓝,美国AmershamBiosciense公司;四甲基偶氮唑蓝(MTT),美国Sigma公司;重蒸水,实验室自制。
牛蒡根药材于2012年9月购自辽宁省沈阳市四方药店,经沈阳药科大学路金才教授鉴定为菊科牛蒡属植物牛蒡Arctium lappa L. 的干燥根,标本(BJP2012AL)保存于沈阳军区总医院药剂科标本室。
2 提取与分离干燥牛蒡根10.0 kg,粉碎,用100 L 55%乙醇浸泡12 h后,加热回流提取3次,第1次2 h,后2次各1 h,减压回收溶剂得浸膏。将该浸膏分散于水中,依次用石油醚(30~60 ℃)、二氯甲烷、醋酸乙酯和正丁醇溶剂各萃取3次。合并萃取液,减压回收溶剂后得石油醚部位6 g、二氯甲烷部位56 g、醋酸乙酯部位255 g和正丁醇部位874 g。
对醋酸乙酯部位(240 g)进行硅胶柱色谱分离,采用二氯甲烷-甲醇(100∶0→0∶100)梯度洗脱,得到15组分Fr. 1~15。对Fr. 12(25.5 g)进行ODS中低压柱色谱,采用甲醇-水(100∶0→0∶100)梯度洗脱,得到17个组分Fr. 12-1~12-17。对Fr. 12-9与Fr. 12-10合并后(1.15 g)进行MCI gel柱色谱,采用甲醇-水(100∶0→0∶100)梯度洗脱,得到11个组分。其中Fr. 12-9-9(0.20 g)经制备HPLC分离(41%甲醇-水,1.5 mL/min,210 nm),得到化合物1(97.0 mg);Fr. 12-9-8(0.16 g)经制备HPLC分离(41%甲醇-水,1.5 mL/min,210 nm),得到化合物7(12.0 mg)。
Fr. 12-14(2.2 g)经制备HPLC分离(45%甲醇-水,1.5 mL/min,210 nm),得到化合物2(238.0 mg)、4(19.0 mg)。Fr. 12-15(1.6 g)经Sephadex LH-20柱色谱分离,二氯甲烷-甲醇(50∶50)为洗脱剂,得到13个组分。其中组分Fr. 12-15-10(80 mg)经制备HPLC分离(46%甲醇-水,1.5 mL/min,210 nm),得到化合物2(13.0 mg)和化合物3(7.0 mg)。Fr. 12-8(4.6 g)经ODS开放柱色谱分离,采用甲醇-水(100∶0→0∶100)梯度洗脱,得到12个组分。其中组分Fr. 12-8-4(0.48 g)经制备HPLC分离(45%甲醇-水,1.5 mL/min,210 nm),得到化合物7(34.5 mg)、8(18.5 mg)。
Fr. 11(12.6 g)经AB-8大孔树脂柱色谱分离,采用乙醇-水(100∶0→0∶100)梯度洗脱,得到12个组分。其中组分Fr. 11-4(0.12 g)经制备HPLC分离(46%甲醇-水,1.5 mL/min,210 nm),得到化合物5(8.5 mg)。Fr. 13(9.8 g)经ODS常压柱色谱分离,采用甲醇-水(100∶0→0∶100)梯度洗脱,得到22个组分。其中组分Fr. 13-8(0.22 g)经制备HPLC分离(25%甲醇-水,1.5 mL/min,210 nm),得到化合物6(167.00 mg)。
3 结构鉴定
化合物1:白色无定形粉末(甲醇),365 nm下显蓝色荧光,三氯化铁反应显墨绿色。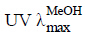 (nm): 330, 300, 243。HR-ESI-MS m/z: 645.148 3 [M-H]-,理论计算值为645.146 1,故确定其相对分子质量为646,分子式为C30H30O16。1H-NMR (600 MHz, CD3OD) 谱中,δ 7.62, 7.61 (各1H, d, J = 15.8 Hz), δ 6.36, 6.31 (各1H, d, J = 15.8 Hz) 为2组反式双键氢信号;δ 7.10, 7.07 (各1H, d, J = 1.9 Hz), δ 7.01, 6.97 (各1H, dd, J = 8.2, 1.9 Hz), δ 6.81, 6.79 (各1H, d, J = 8.2 Hz) 为2组ABX偶合的芳香氢信号;δ 3.56 (3H, s) 为甲氧基氢信号。13C-NMR (150 MHz, CD3OD) 谱中,结合氢谱可确定2个反式双键片段、2个酯羰基片段和2个1,2-二羟基-4-取代苯片段碳信号。HMBC谱中,2组反式双键氢信号δ 7.62, 7.61 (各1H, d, J = 15.8 Hz), δ 6.36, 6.31 (各1H, d, J = 15.8 Hz) 与δ 168.6, 167.7 (C-9″, 9′′′) 存在相关,提示双键一端与酯羰基相连;同时与δ 127.7, 127.6 (C-1″, 1′′′), δ 123.3, 123.1 (C-6″, 6′′′), δ 115.3, 115.2 (C-2″, 2′′′) 存在相关,提示双键另一端与1,2-二羟基-4-取代苯环相连。由此可知该分子含有2个咖啡酰基。HMBC谱中,δ 3.56 (3H, s, 1′-OCH3) 与δ 174.9 (C-1′) 相关;δ 4.47 (1H, m, H-2′) 与δ 40.3 (C-3′), δ 174.9 (C-1′), δ 171.3 (C-3′) 分别相关;δ 2.72 (2H, m, H-3′) 与δ 68.2 (C-2′), δ 174.9 (C-1′), δ 171.3 (C-3′) 分别相关。由此推测该分子中含有苹果酸甲酯。13C-NMR谱中,剩余7个碳为一组奎宁酸碳信号。低场区δ 5.43 (1H, m, H-5), δ 5.46 (1H, m, H-3) 提示奎宁酸3-OH和5-OH被取代。C-1位信号δ 80.5较奎宁酸母环向低场位移,结合前面推出的2个咖啡酰基和1个苹果酸甲酯,推测该化合物为1,3,5-三取代奎宁酸类化合物。HMBC谱中,δ 5.43 (1H, m, H-5) 与δ 168.6 (C-9″) 存在远程相关,提示1个咖啡酰基为C-5取代;δ 5.46 (1H, m, H-3) 与δ 171.6 (C-4′) 存在远程相关,提示苹果酸甲酯为C-3取代;则另1个咖啡酰基为C-1取代。将该化合物氢谱、碳谱数据与文献中报道的1,5-O-dicaffeoyl-3-O-(4-maloyl)-quinic acid[3]对比发现,仅多出1个甲氧基的碳氢信号外,其他数据基本一致。综上所述,鉴定化合物1为1,5-O-二咖啡酰-3-O-(4-苹果酸甲酯)-奎宁酸,经SciFinder查询确定该化合物是1个未见报道的新化合物,具体碳氢信号归属见表 1。
(nm): 330, 300, 243。HR-ESI-MS m/z: 645.148 3 [M-H]-,理论计算值为645.146 1,故确定其相对分子质量为646,分子式为C30H30O16。1H-NMR (600 MHz, CD3OD) 谱中,δ 7.62, 7.61 (各1H, d, J = 15.8 Hz), δ 6.36, 6.31 (各1H, d, J = 15.8 Hz) 为2组反式双键氢信号;δ 7.10, 7.07 (各1H, d, J = 1.9 Hz), δ 7.01, 6.97 (各1H, dd, J = 8.2, 1.9 Hz), δ 6.81, 6.79 (各1H, d, J = 8.2 Hz) 为2组ABX偶合的芳香氢信号;δ 3.56 (3H, s) 为甲氧基氢信号。13C-NMR (150 MHz, CD3OD) 谱中,结合氢谱可确定2个反式双键片段、2个酯羰基片段和2个1,2-二羟基-4-取代苯片段碳信号。HMBC谱中,2组反式双键氢信号δ 7.62, 7.61 (各1H, d, J = 15.8 Hz), δ 6.36, 6.31 (各1H, d, J = 15.8 Hz) 与δ 168.6, 167.7 (C-9″, 9′′′) 存在相关,提示双键一端与酯羰基相连;同时与δ 127.7, 127.6 (C-1″, 1′′′), δ 123.3, 123.1 (C-6″, 6′′′), δ 115.3, 115.2 (C-2″, 2′′′) 存在相关,提示双键另一端与1,2-二羟基-4-取代苯环相连。由此可知该分子含有2个咖啡酰基。HMBC谱中,δ 3.56 (3H, s, 1′-OCH3) 与δ 174.9 (C-1′) 相关;δ 4.47 (1H, m, H-2′) 与δ 40.3 (C-3′), δ 174.9 (C-1′), δ 171.3 (C-3′) 分别相关;δ 2.72 (2H, m, H-3′) 与δ 68.2 (C-2′), δ 174.9 (C-1′), δ 171.3 (C-3′) 分别相关。由此推测该分子中含有苹果酸甲酯。13C-NMR谱中,剩余7个碳为一组奎宁酸碳信号。低场区δ 5.43 (1H, m, H-5), δ 5.46 (1H, m, H-3) 提示奎宁酸3-OH和5-OH被取代。C-1位信号δ 80.5较奎宁酸母环向低场位移,结合前面推出的2个咖啡酰基和1个苹果酸甲酯,推测该化合物为1,3,5-三取代奎宁酸类化合物。HMBC谱中,δ 5.43 (1H, m, H-5) 与δ 168.6 (C-9″) 存在远程相关,提示1个咖啡酰基为C-5取代;δ 5.46 (1H, m, H-3) 与δ 171.6 (C-4′) 存在远程相关,提示苹果酸甲酯为C-3取代;则另1个咖啡酰基为C-1取代。将该化合物氢谱、碳谱数据与文献中报道的1,5-O-dicaffeoyl-3-O-(4-maloyl)-quinic acid[3]对比发现,仅多出1个甲氧基的碳氢信号外,其他数据基本一致。综上所述,鉴定化合物1为1,5-O-二咖啡酰-3-O-(4-苹果酸甲酯)-奎宁酸,经SciFinder查询确定该化合物是1个未见报道的新化合物,具体碳氢信号归属见表 1。
| 表 1 化合物1的1H-NMR和13C-NMR数据 Table 1 1H-NMR and 13C-NMR data of compound 1 |
化合物2:淡黄色无定形粉末(甲醇),365 nm下显蓝色荧光,三氯化铁反应显墨绿色。1H-NMR (600 MHz, CD3OD) δ: 7.61, 7.54 (各1H, d, J = 15.6 Hz, H-7′, 7″), 7.06 (2H, brs, H-2′, 2″), 6.96 (2H, d, J = 7.8 Hz, H-5′, 5″), 6.78 (2H, m, H-6′, 6″), 6.34, 6.21 (各1H, d, J = 15.6 Hz, H-8′, 8″), 5.39 (1H, m, H-5), 5.30 (1H, m, H-3), 3.97 (1H, m, H-4), 3.68 (3H, s, 7-OCH3), 2.32 (2H, m, H-2ex, 6ex), 2.15 (2H, m, H-2ax, 6ax);13C-NMR (150 MHz, CD3OD) δ: 175.6 (C-7), 168.7, 168.0 (C-9′, 9″), 149.8, 149.6 (C-4′, 4″), 147.4, 147.1 (C-7′, 7″), 146.9, 146.8 (C-3′, 3″), 127.9, 127.6 (C-1′, 1″), 123.1, 123.0 (C-6′, 6″), 116.6, 116.5 (C-5′, 5″), 115.5, 114.9 (C-8′, 8″), 115.0, 115.0 (C-2′, 2″), 74.6 (C-1), 72.2 (C-5), 72.0 (C-3), 69.7 (C-4), 53.0 (7-OCH3), 36.7 (C-6), 35.6 (C-2)。以上数据与文献报道基本一致[4],故鉴定化合物2为3,5-二咖啡酰奎宁酸甲酯。
化合物3:淡黄色无定形粉末(甲醇),365 nm下显蓝色荧光,三氯化铁反应显墨绿色。1H-NMR (600 MHz, CD3OD) δ: 7.61, 7.51 (各1H, d, J = 15.6 Hz, H-7′, 7″), 7.04, 7.01 (2H, brs, H-2′, 2″), 6.93 (2H, m, H-5′, 5″), 6.76 (2H, brs, H-6′, 6″), 6.31, 6.18 (各1H, d, J = 15.6 Hz, H-8′, 8″), 5.53 (1H, m, H-3), 5.15 (1H, m, H-4), 4.34 (1H, m, H-5), 3.72 (3H, s, 7-OCH3), 2.34 (1H, m, H-6ax), 2.26 (1H, m, H-2ex), 2.26 (1H, m, H-2ax), 2.80 (1H, dd, J = 13.8, 6.0 Hz, H-6ex);13C-NMR (150 MHz, CD3OD)δ: 175.2 (C-7), 168.5, 168.0 (C-9′, 9″), 149.8, 149.7 (C-4′, 4″), 147.7, 147.6 (C-7′, 7″), 146.8, 146.8 (C-3′, 3″), 127.7, 127.5 (C-1′, 1″), 123.1, 123.1 (C-6′, 6″), 116.5, 116.5 (C-5′, 5″), 115.2, 115.2 (C-2′, 2″), 114.7, 114.6 (C-8′, 8″), 75.8 (C-1), 74.9 (C-4), 69.1 (C-3), 68.6 (C-5), 53.1 (7-OCH3), 38.6 (C-2), 38.4 (C-6)。以上数据与文献报道基本一致[5],故鉴定化合物3为3,4-二咖啡酰奎宁酸甲酯。
化合物4:淡黄色无定形粉末(甲醇),365 nm下显蓝色荧光,三氯化铁反应显墨绿色。1H-NMR (600 MHz, CD3OD) δ: 7.59, 7.50 (各1H, d, J = 15.6 Hz, H-7′, 7″), 7.02, 7.00 (各1H, d, J = 2.0 Hz, H-2′, 2″), 6.92, 6.90 (各1H, dd, J = 8.0, 2.0 Hz, H-5′, 5″), 6.78, 6.76 (各1H, d, J = 8.0 Hz, H-6′, 6″), 6.29, 6.16 (各1H, d, J = 15.6 Hz, H-8′, 8″), 5.53 (1H, m, H-5), 5.10 (1H, dd, J = 8.0, 2.8 Hz, H-4), 4.34 (1H, m, H-3), 3.72 (3H, s, 7-OCH3), 2.23~2.34 (2H, m, H-6), 1.95~2.23 (2H, m, H-2);13C-NMR (150 MHz, CD3OD) δ: 175.2 (C-7), 168.5, 168.0 (C-9′, 9″), 149.8, 149.7 (C-4′, 4″), 147.7, 147.7 (C-7′, 7″), 146.8, 146.8 (C-3′, 3″), 127.7, 127.5 (C-1′, 1″), 123.1, 123.1 (C-6′, 6″), 116.5, 116.5 (C-5′, 5″), 115.2, 115.2 (C-8′, 8″), 114.7, 114.6 (C-2′, 2″), 75.8 (C-1), 74.6 (C-4), 69.1 (C-5), 68.6 (C-3), 53.1 (7-OCH3), 38.6 (C-6), 38.4 (C-2)。以上数据与文献报道基本一致[6],故鉴定化合物4为4,5-二咖啡酰奎宁酸甲酯。
化合物5:棕色粉末(甲醇),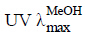 (nm): 203。HR-ESI-MS m/z: 249.080 7 [M-H]-,理论计算值为249.076 8,故确定其相对分子质量为250,分子式为C13H14O5。1H NMR (600 MHz, CD3OD) δ: 7.00 (2H, d, J = 8.5 Hz, H-3′, 7′), 6.73 (2H, d, J = 8.5 Hz, H-4′, 6′), 5.76 (1H, t, J = 1.5 Hz, H-3), 3.57 (1H, d, J = 1.2 Hz, H-1′), 3.69 (3H, s, 1-OCH3), 3.68 (3H, s, 4-OCH3);13C-NMR (150 MHz, CD3OD)δ: 170.5 (C-1), 167.1 (C-4), 157.7 (C-5′), 151.6 (C-2), 131.4 (C-3′, 7′), 127.6 (C-2′), 121.4 (C-3), 115.5 (C-4′, 6′), 52.7 (1-OCH3), 52.3 (4-OCH3), 40.3 (C-1′)。NOESY谱中,δ 5.76 (1H, t, J = 1.5 Hz, H-3) 与δ 3.69 (3H, s, 1-OCH3) 相关,提示C-2与C-3是反式双键。以上数据与文献报道基本一致[7],故鉴定化合物5为 (2E)-1,4-dimethyl-2-[(4-hydroxyphenyl) methyl]-2- butenedioic acid,经SciFinder查询发现,化合物5为新天然产物。
(nm): 203。HR-ESI-MS m/z: 249.080 7 [M-H]-,理论计算值为249.076 8,故确定其相对分子质量为250,分子式为C13H14O5。1H NMR (600 MHz, CD3OD) δ: 7.00 (2H, d, J = 8.5 Hz, H-3′, 7′), 6.73 (2H, d, J = 8.5 Hz, H-4′, 6′), 5.76 (1H, t, J = 1.5 Hz, H-3), 3.57 (1H, d, J = 1.2 Hz, H-1′), 3.69 (3H, s, 1-OCH3), 3.68 (3H, s, 4-OCH3);13C-NMR (150 MHz, CD3OD)δ: 170.5 (C-1), 167.1 (C-4), 157.7 (C-5′), 151.6 (C-2), 131.4 (C-3′, 7′), 127.6 (C-2′), 121.4 (C-3), 115.5 (C-4′, 6′), 52.7 (1-OCH3), 52.3 (4-OCH3), 40.3 (C-1′)。NOESY谱中,δ 5.76 (1H, t, J = 1.5 Hz, H-3) 与δ 3.69 (3H, s, 1-OCH3) 相关,提示C-2与C-3是反式双键。以上数据与文献报道基本一致[7],故鉴定化合物5为 (2E)-1,4-dimethyl-2-[(4-hydroxyphenyl) methyl]-2- butenedioic acid,经SciFinder查询发现,化合物5为新天然产物。
化合物6:淡黄色无定形粉末(甲醇),365 nm下显蓝色荧光,三氯化铁反应显墨绿色。1H-NMR (400 MHz, CD3OD) δ: 7.53 (1H, d, J = 16.0 Hz, H-7′), 7.02 (1H, d, J = 1.6 Hz, H-2′), 6.94 (1H, dd, J = 8.0, 1.6 Hz, H-6′), 6.79 (1H, d, J = 8.0 Hz, H-5′), 6.22 (1H, d, J = 16.0 Hz, H-8′), 5.29 (1H, m, H-5), 4.15 (1H, m, H-3), 3.75 (1H, m, H-4), 3.67 (3H, s, 7-OCH3), 2.21 (2H, m, H-2ex, 6ex), 2.01 (2H, m, H-2ax, 6ax);13C-NMR (100 MHz, CD3OD) δ: 175.4 (C-7), 168.3 (C-9′), 149.5 (C-4′), 147.1 (C-7′), 146.7 (C-3′), 127.5 (C-1′), 123.0 (C-6′), 116.5 (C-5′), 115.1 (C-8′), 115.0 (C-2′), 75.8 (C-1), 72.6 (C-3), 72.0 (C-4), 70.4 (C-5), 53.0 (7-OCH3), 37.9 (C-6), 37.8 (C-2)。以上数据与文献报道基本一致[8, 9],故鉴定化合物6为绿原酸甲酯。
化合物7:棕色粉末(甲醇)。1H-NMR (400 MHz, CD3OD) δ: 7.54 (1H, d, J = 15.9 Hz, H-7), 7.03 (1H, d, J = 1.6 Hz, H-2), 6.94 (1H, dd, J = 8.2, 1.6 Hz, H-6), 6.77 (1H, d, J = 8.2 Hz, H-5), 6.26 (1H, d, J = 15.9 Hz, H-8), 3.75 (3H, s, 9-OCH3)。以上数据与文献报道基本一致[8],故鉴定化合物7为咖啡酸甲酯。
化合物8:淡黄色油状物(甲醇)。1H-NMR (400 MHz, CD3OD) δ: 6.70 (2H, d, J = 8.0 Hz, H-5, 5′), 6.69 (2H, d, J = 2.2 Hz, H-2, 2′), 6.58 (2H, dd, J = 8.0, 2.2 Hz, H-6, 6′), 3.71 (6H, s H-10, 10′), 3.39 (2H, m, H-7, 7′), 3.29 (2H, m, H-8, 8′);13C-NMR (100 MHz, CD3OD) δ: 174.8 (C-9, 9′), 146.4 (C-3, 3′), 145.5 (C-4, 4′), 134.2 (C-1, 1′), 119.2 (C-6, 6′), 116.4 (C-5, 5′), 114.9 (C-2, 2′), 52.6 (C-10, 10′), 45.9 (C-8, 8′)。以上数据与文献报道基本一致[10],故鉴定化合物8为3,4,3′,4′-tetrahydroxy-δ-truxinate。
4 体外神经保护活性测试采用谷氨酸诱导神经母细胞瘤SH-SY5Y细胞株损伤模型,以MTT法对化合物1~8进行神经保护活性测定。取对数生长期的SH-SY5Y细胞,接种于96孔培养板中,细胞密度为1×105个/mL,每孔加入100 μL,置于培养箱中培养24 h。然后分别给予化合物1~8使其终浓度为5、10和15 μmol/L,每个浓度6个复孔,置于培养箱中培养4 h后,再给予100 μmol/L谷氨酸损伤培养24 h。最后每孔再加入MTT(5 mg/mL)20 μL,培养箱中孵育4 h。弃去上清,每孔加入150 μL DMSO震荡10 min,在490 nm处测定吸光度(A)值。按照下列公式计算神经保护率。
神经保护率=(A给药-A损伤)/(A空白-A损伤)
MTT测试结果(表 2)表明化合物1~8在5、10和15 μmol/L给药浓度下均表现不同程度的神经保护活性且具有较好的剂量依赖性。其中化合物1、2、5活性较好,在10 μmol/L给药浓度下神经保护率分别为33.41%、19.21%、22.27%;而在15 μmol/L给药浓度下神经保护率可分别达到48.86%、40.79%、39.31%。上述结论与本课题组前期发现牛蒡根经乙醇提取后的醋酸乙酯萃取物对谷氨酸诱导的神经损伤具有较好保护活性的结论相一致[2],因此推测牛蒡根中神经保护活性物质可能与咖啡酸类化合物及其类似物有关。
| 表 2 化合物1~8的神经保护活性测定结果 Table 2 Neuroprotective activity of compounds 1—8 |
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | Tian X, Sui S, Huang J, et al. Neuroprotective effects of Arctium lappa L. rootsagainst glutamate-induced oxidativestress byinhibiting phosphorylation of p38, JNK and ERK 1/2 MAPKs in PC12 cells[J]. Environ Toxicol Pharmacol, 2014, 38(1): 189-198. |
| [3] | Zhou X W, Liu D, Liu Y, et al. Isolation and characterization of two new phenolic acids from cultured cells of Saussurea involucrate[J]. Phytochem Lett, 2014, 7(1): 133-136. |
| [4] | Kim S H, Jang Y P, Sung S H, et al. Hepatoprotective dibenzylbutyrolactone lignans of Torreya nucifera against CCl4-induced toxicity in primary cultured rat hepatocytes[J]. Biol Pharm Bull, 2003, 26(8): 1202-1205. |
| [5] | 翁裕馨, 陈湘宏, 刘占厚, 等. 细毡毛忍冬叶绿原酸类化学成分研究[J]. 安徽农业科学, 2011, 39(27): 16566-16568. |
| [6] | Maha A E, Ei-Lakany A M, Abdel-Kader M S, et al. New quinic acid derivatives from hepatoprotective Inula crithmoides root extract[J]. Helv Chim Acta, 2012, 95(1): 61-66. |
| [7] | Toshima H, Saito M, Yoshihara T. Total syntheses of all four stereoisomers of piscidic acid via catalytic asymmetric dihydroxylation of (Z)-and (E)-trisubstituted olefins[J]. Biosci Biotechnol Biochem, 1999, 63(11): 1934-1941. |
| [8] | Chang S W, Kim K H, Lee I K, et al. Phytochemical constituents of Bistorta manshuriensis[J]. Nat Prod Sci, 2009, 15(4): 234-240. |
| [9] | 汤 丹, 李会军, 钱正明, 等. 黄褐毛忍冬花蕾咖啡酰奎宁酸类成分研究[J]. 中国药学杂志, 2007, 42(20): 1537-1539. |
| [10] | Deng Y, Chin Y W, Chai H B, et al. Phytochemical and bioactivity studies on constituents of the leaves of Vitex quinata[J]. Phytochem Lett, 2011, 3(4): 213-217. |
 2015, Vol. 46
2015, Vol. 46


