人参花和西洋参花分别为五加科人参属植物人参Panax ginseng C. A. Mey和西洋参Panax quinquefolius L. 的干燥花序。花蕾未开放时采收,晒干。人参长至4年才开始开花,每棵人参每年仅开一朵伞形花序(40~50朵小花),所以其产量很少,弥足珍贵,素有“绿色黄金”之称。由于花不是人参和西洋参的传统药用部位,过去对人参和西洋参的研究多集中在其根部,花也仅作为保健品,用于冲泡代茶饮、炖汤等。现代医学研究不断加深对人参和西洋参花的研究,发现花中的皂苷类成分量远远高于根部,花的药用价值也正日益引起国内外的重视[1]。
人参花和西洋参花一般在6月份花蕾未开放时采收。初加工方法是人参花和西洋参花的药材生产过程中关键问题,直接影响到药材的产量、品质以及深度开发。收获后多采用常规晒干的方法,此方法存在易污染、耗时长、受环境天气影响较大等弊端,若药材量大,极易导致药材霉变、有效成分损失、药性改变等问题[2]。本实验采用中药材常用的干燥方法对新鲜人参花和西洋参花药材进行了研究,以人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd及其相对应的丙二酰基人参皂苷(m-Rg1、m-Re、m-Rb1、m-Rc、m-Rb2、m-Rb3、m-Rd)共14种人参皂苷的质量分数为考察指标,进而对干燥方法进行比较分析,以期为完善人参花和西洋参花药材采收后的加工方法提供科学依据。
1 仪器与材料Agilent 1260高效液相色谱仪(四元泵、进样器、柱温箱、DAD检测器,美国安捷伦科技公司)。数显式电热鼓风干燥箱101-2A型(上海阳光实验仪器有限公司);WS70-1型红外线快速干燥器(功率500 W,电压220 V,上海锦屏仪器仪表有限公司);WD 900型微波炉(输出功率900 W,额定微波功率2 450 MHz,顺德格兰仕电器厂有限公司);Sarturius-CP2250十万分之一电子天平(北京赛多利斯天平有限公司);KQ 5200E型数控超声清洗机(昆山市超声仪器有限公司);冻干机(安阳市冰川制冷设备有限公司)。
乙腈(色谱纯,天津康科德富宇精细化工有限公司,批号130906),磷酸为色谱纯,水为娃哈哈纯净水,其他试剂均为分析纯。
对照品人参皂苷Rg1(批号110703-201027)、人参皂苷Re(批号 110754-200822)、人参皂苷Rb1(批号 110704-201122)、人参皂苷Rd(批号 111818-201302)购于中国食品药品检定研究院,对照品人参皂苷Rc(批号 131116,质量分数95.5%)、人参皂苷Rb2对照品(批号 131029,质量分数96.5%)、人参皂苷Rb3对照品(批号 131112,质量分数93.5%)购于成都普菲德生物科技有限公司。
新鲜的人参花采自辽宁省桓仁县,新鲜的西洋参花采自吉林省通化市,经沈阳药科大学中药学院路金才教授鉴定为五加科人参属植物人参Panax ginseng C. A. Mey和西洋参Panax quinquefolius L.的花序。
2 方法与结果 2.1 干燥品制备 2.1.1 晒干取新鲜样品置阳光下晒干至恒定质量,得晒干样品。
2.1.2 冷冻干燥取新鲜样品预先进行降温冻结成固体,然后放进冻干机中,24 h后取出,得冻干样品。
2.1.3 微波干燥取西洋参花新鲜样品至玻璃盛器中,在微波炉(功率900 W)中干燥,每隔30 s取出称质量,干至恒定质量,得微波干燥样品。
2.1.4 红外干燥取西洋参花新鲜样品至玻璃盛器中,在红外干燥箱(功率500 W)中干燥,每隔5 min取出称质量,干至恒定质量,得红外干燥样品。
2.1.5 烘箱烘干取新鲜样品置烘箱内烘干,温度分别为40、60、80、100、120、140 ℃,干至恒定质量,得烘干样品。
每种干燥方法用人参花或西洋参花鲜品约为10 g,平行3份,考察鲜品和干燥至恒定质量的成品水分的变化。鉴于西洋参花在红外干燥和微波干燥下并不够理想,故人参花只对烘干和冷冻干燥方法进行了考察。另外,人参花140 ℃烘干品由于炭化严重,故没有对其140 ℃干燥品进行考察。
2.2 折干率和含水量测定 2.2.1 折干率根据样品鲜质量和干燥恒定质量计算折干率(干质量/鲜质量),结果见表 1。
| 表 1 不同干燥方法下干燥时间、样品的折干率和含水量 Table 1 Drying time, drying rate, and moisture by different drying methods |
按《中国药典》2015年版一部附录IX H进行,结果见表 1。
2.3 HPLC 法测定 14 种人参皂苷的量 2.3.1 色谱条件色谱柱为Thermo Hypersil-Keystone C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱程序:0~12 min,21% A;12~19 min,21%~25% A;19~24 min,25%~30% A;24~56 min,30%~35% A;56~60 min,35%~50% A;检测波长为203 nm;体积流量为1.0 mL/min;柱温为30 ℃;进样量为10 μL。根据前期研究[3],确定各丙二酰基人参皂苷的峰位置,对照品及样品溶液的HPLC色谱图见图 1。
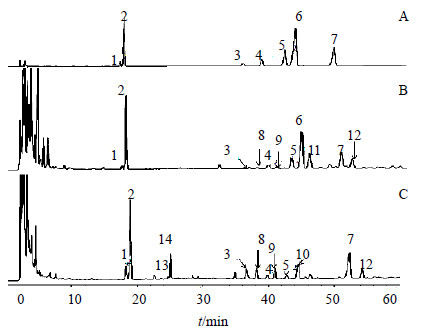 |
1~7-分别为人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3和Rd;8~14-分别为m-Rb1、m-Rc、m-Rb2、m-Rb3、m-Rd、m-Rg1和m-Re 1~7-ginsenosides Rg1, Re, Rb1, Rc, Rb2, Rb3 and Rd; 8~12-m-Rb1, m-Rc, m-Rb2, m-Rb3, m-Rd, m-Rg1 and m-Re 图 1 混合对照品 (A) 与西洋参花样品 (B) 和人参花样品(C) 的HPLC色谱图Fig.1 HPLC of reference substances (A) and samples of FPQ (B) and FPG (C)/span> |
精密称取对照品人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd适量,加甲醇配成质量浓度分别为2.60、2.62、0.44、0.64、1.80、5.76、2.08 mg/mL的混合对照品储备液,摇匀,即得。
2.3.3 供试品溶液的制备取人参花或西洋参花干燥样品粉末约1.0 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇-水20 mL,称定质量,超声处理30 min(40 kHz,200 W),再称定质量,用70%甲醇-水补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3.4 线性关系考察精密量取“2.3.2”项下的混合对照品储备液0.10、0.20、0.50、1.00 mL,分别置 2 mL量瓶中,加甲醇稀释至刻度,摇匀,与混合对照品储备液一并为系列对照品溶液,按“2.3.1”项下色谱条件进样,记录色谱图,以峰面积为纵坐标(Y),溶液质量浓度为横坐标(X),绘制标准曲线。得到人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd的回归方程分别为Y=1 870 X-2.848,R2=0.999 3,线性范围0.130~2.600 mg/mL;Y=1 784 X-12.54,R2=0.999 8,线性范围0.131~2.620 mg/mL;Y=1 524 X-1.206,R2=0.999 1,线性范围0.011~0.440 mg/mL;Y=1 561 X-4.239,R2=0.999 3,线性范围0.032~0.640 mg/mL;Y=1 628 X-5.693,R2=0.999 4,线性范围0.090~1.800 mg/mL;Y=1 508 X-13.6,R2=0.999 8,线性范围0.288~5.760 mg/mL;Y=1 872 X-13.05,R2=0.999 3,线性范围0.104~2.080 mg/mL。结果表明,人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd在相应质量浓度范围内线性关系良好。
2.3.5 精密度考察取西洋参花晒干样品粉末,以“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件连续进样6次,记录色谱图。计算人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3和Rd峰面积的RSD值分别为4.25%、2.10%、2.77%、1.86%、2.92%、2.27%、2.29%,结果表明仪器精密度良好。
2.3.6 稳定性考察取西洋参花晒干样品粉末,以“2.3.3”项下方法制备供试品溶液,按“2.3.1”项下色谱条件分别于第0、2、4、6、12、24 h进样分析,分别计算人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd峰面积的RSD值分别为4.86%、2.03%、3.92%、2.40%、3.55%、4.90%、3.47%,结果表明样品稳定性良好。
2.3.7 重复性考察取西洋参花晒干样品粉末,按“2.3.3”项下供试品溶液的制备方法平行制备6份样品溶液,按“2.3.1”项下色谱条件进行分析,计算人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd质量分数的RSD值分别为1.99%、2.85%、2.68%、0.61%、1.61%、4.05%、0.71%,结果表明方法重复性良好。
2.3.8 加样回收率试验称取已测定的西洋参花晒干样品9份,每份0.5 g。每3份为1组,向每组中加入80%、100%、120% 3个水平的人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd对照品,然后按“2.3.3”项下供试品制备方法制备以上样品。按色谱条件进行分析,计算得人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd的加样回收率分别为99.72%、102.47%、97.92%、98.40%、98.63%、96.23%、99.36%;RSD分别为0.23%、0.44%、0.55%、1.21%、0.56%、1.54%、0.89%。
2.3.9 样品测定分别取人参花和西洋参花干燥样品粉末约1.0 g,精密称定,以“2.3.3”项下方法制备供试品溶液。分别精密吸取对照品溶液与供试品溶液各5 μL,注入液相色谱仪,以外标一点法计算样品中Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd及其相对应的丙二酰基人参皂苷(m-Rg1、m-Re、m-Rb1、m-Rc、m-Rb2、m-Rb3和m-Rd)的量,其中丙二酰基人参皂苷的量采用一测多评法[3]进行测定,其量依照人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd方法进行计算。各组分量按样品干燥品计,并计算其他干燥品相对于晒干品的人参皂苷量的变化率[变化率=(其他干燥品皂苷量-晒干品皂苷量)/晒干品皂苷量]。结果见表 2、3。
| 表 2 不同干燥方法处理的样品中14种人参皂苷的量 Table 2 Contents of 14 kinds of ginsenosides by different drying methods |
| 表 3 不同干燥方法处理的样品皂苷质量分数相对晒干品的变化率 Table 3 Variable rates of contents of ginsenosides by different drying methods |
人参花与西洋参花的主要成分都是人参皂苷,在前期工作中,本实验室利用HPLC-MS对人参花和西洋参花的皂苷类成分进行了指认,发现其中人参皂苷多与其相对应的丙二酰基人参皂苷成对出现。丙二酰基人参皂苷同样具有生物活性和药效价值,具有治疗糖尿病[4]、保护神经系统等作用[5, 6],且这类成分是人参加工过程中含量变化较大的一类成分。为了可以全面考察干燥方法对人参皂苷类成分的影响,在本实验中选人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd及其相对应的丙二酰基人参皂苷(m-Rg1、m-Re、m-Rb1、m-Rc、m-Rb2、m-Rb3、m-Rd)作为测定的指标。
丙二酰基人参皂苷类成分非常不稳定,对照品不易取得。本实验参考相关文献采用一测多评法的方法进行测定[3]。理论上2个成分之间的结构越相似,所得的相对校正因子数值更接近于1.0[7]。所以在本实验中拟定人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd与其相对应的丙二酰基人参皂苷(m-Rg1、m-Re、m-Rb1、m-Rc、m-Rb2、m-Rb3、m-Rd)的相对校正因子为1,则m-Rg1、m-Re、m-Rb1、m-Rc、m-Rb2、m-Rb3和m-Rd的量可以依照人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd的方法进行计算。
3.1.2 供试品溶液制备方法 本实验考察了提取方法(回流提取法、超声提取法),提取溶剂(100%、70%、40%甲醇,100%、70%、40%乙醇),提取时间(30、40、50、70 min),溶剂量(20、30、50、60 mL),以人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd及其相对应的丙二酰基人参皂苷量为指标,最终确定最佳提取条件为70%甲醇-水溶液20 mL超声提取0.5 h。 3.1.3 耐用性试验对不同品牌的色谱柱(Thermo Hypersil-Keystone C18柱(250 mm×4.6 mm,5 μm)、Kromasil C18柱(100 mm×4.6 mm,5 μm)),流动相比例上下浮动20%,体积流量0.8~1.2 mL/min,柱温(25~40 ℃)进行考察。各色谱条件下,系统适应性各项指标均符合要求,人参皂苷Rg1、Re、Rb1、Rc、Rb2、Rb3、Rd及其相对应的丙二酰基人参皂苷RSD均符合定量要求,因此所建立的方法具有较好的耐用性。
3.2 不同干燥方法对人参花和西洋参花人参皂苷量的影响在花类药材新鲜品的初加工中常采用杀青的方法来保持药材的色泽和形态。人参花的初加工也有采用高温蒸制后晾干的方法[8],所以本实验中烘干干燥方法除了选择常规的干燥温度(40、60、80 ℃),还对高温(100、120、140 ℃)条件进行了考察。
从实验的结果来看,不同干燥方法中,干燥温度对人参花和西洋参花的成分影响很大。西洋参花中人参皂苷在40 ℃烘干的条件下量要比微波干燥、红外干燥和冷冻干燥的量高,人参花中人参皂苷在40 ℃烘干的条件下量要比冷冻干燥的量高,但质量分数差异不大,随着温度的升高质量分数有降低的趋势,在达到140 ℃高温时,丙二酰基人参皂苷的量明显下降,变化率高达−65.12%。有研究表明丙二酰基人参皂苷的酰基键不稳定,在高温的条件下发生水解脱去了丙二酸,生成相应的人参皂苷[9]。但在实验数据中丙二酰基人参皂苷的减少量与相应的人参皂苷的变化量并没有明显的对等关系,且这14种皂苷的总量也都有下降的趋势。这有可能是因为原人参二醇型皂苷(人参皂苷Rb1、Rb2、Rb3、Rc、Rd等)的C-20位高温时脱糖基水解生成人参皂苷Rg3[10, 11, 12];原人参三醇型皂苷(如人参皂苷Re、Rg1)的C-20位在高温过程中脱糖基水解生成人参皂苷Rg2和F4,同时,人参皂苷Re在高温过程中还会水解脱去C-20位的葡萄糖和C-3位末端的鼠李糖,生成人参皂苷Rh1[13]。可见40 ℃烘干可使人参花和西洋参花中原有人参皂苷量保持在最高水平,而高温处理则可促使其转化为稀有皂苷,因此在实际生产中可根据需要选择合适的干燥方法。
| [1] | 丁 阳. 欧州学者历时20年研究发现: 人参花蕾药用价值远超参根[J]. 白云医药, 2005(1): 32-32. |
| [2] | 曾 珍, 王 晶, 贾凌云, 等. 不同干燥和炮制方法对北柴胡皂苷类化合物的影响[J]. 沈阳药科大学学报, 2012, 29(8): 650-655. |
| [3] | 李 冀, 项 峥, 窦德强. 一测多评法测定几种人参产品中人参皂苷的含量[J]. 人参研究, 2012, 24(4): 2-7. |
| [4] | Liu Z, Wang L J, Li X, et al . Hypoglycemic effects of malonyl-ginsenosides extracted from roots of Panax ginseng on streptozotocin-induced diabetic mice[J]. Phytothe Res, 2009, 23(10): 1426-1430. |
| [5] | Nishiyama N, Cho S I, Kitagawa I, et al . Malonyl-ginsenoside Rb1 potentiates nerve growth factor (NGF)-induced neurite outgrowth of cultured chick embryonic dorsal root ganglia[J]. Biol Pharm Bull, 1994, 17(4): 509-513. |
| [6] | Abe K, Cho S I, Kitagawa I, et al . Differential effects of ginsenoside Rb1 and malonyl-ginsenoside Rb1 on long-term potentiation in the dentate gyrus of rats[J]. Brain Res, 1994, 649(1): 7-11. |
| [7] | 朱晶晶, 王智民, 匡艳辉, 等. 一测多评法同步测定人参和三七药材中多种人参皂苷的含量[J]. 药学学报, 2009, 43(12): 1211-1216. |
| [8] | Tung N H, Cho K, Kim J A, et al . Dammarane-type glycosides from the steamed flower-buds of Panax ginseng[J]. Bull Korean Chem Soc, 2010, 31: 1381-1384. |
| [9] | 孙光芝, 刘 志, 李向高, 等. 鲜人参中2种丙二酰基人参皂苷的分离鉴定[J]. 分析化学, 2005, 33(12): 1783-1786. |
| [10] | 汤明辉. 人参皂苷Rg3的制备及其微乳药物传递系统的研究[D]. 南京: 中国药科大学, 2003. |
| [11] | 李孟璇, 孙 林, 孟兆青, 等. 人参白术药对配伍前后化学成分变化研究[J]. 中草药, 2014, 45(24): 3549-3552. |
| [12] | 蔡宝昌, 秦昆明, 吴 皓, 等. 中药炮制过程化学机理研究[J]. 化学进展, 2012, 24(4): 637-649. |
| [13] | Lee S M, Shon H J, Choi C S, et al . Ginsenosides from heat processed ginseng[J]. Chem Pharm Bull, 2009, 57(1): 92-94. |
 2015, Vol. 46
2015, Vol. 46


