北沙参为伞形科植物珊瑚菜Glehnia littoralis Fr. Schmidt ex Miq. 的干燥根,主要分布于山东、辽宁、河北、江苏、浙江、广东、福建、台湾等地,生长于沿海沙地。北沙参作为传统中药在临床上广泛使用,具有养阴清肺、益胃生津之功效,用于肺热燥咳、劳嗽痰血、胃阴不足、热病津伤、咽干口渴等症[1]。野生珊瑚菜资源稀少,加上海滨沙滩不断开发,生境遭受破坏,其种群数量急剧减少。1999年,珊瑚菜被列为国家II级重点保护野生植物[2]。北沙参主要含香豆素类、聚炔类、糖苷、挥发油等化学成分[3],其中聚炔类成分Falcarindiol具有很强的抗革兰氏阳性菌活性[4]。
植物内生真菌是生活史中的某一段时期生活在植物组织内,对植物组织没有引起明显病害症状的真菌。内生真菌能够对植物生长发育进行积极调控,具有促生抗逆等重要生物学功能,并可以产生与宿主相同或相似的生理活性物质[5]。来源于药用植物的许多内生真菌都具有抗菌活性,所产生的抗菌活性物质种类繁多[6]。本实验以北沙参为材料,筛选内生真菌的抗菌活性,为北沙参内生真菌资源开发奠定理论基础。
1 材料北沙参于2011年9月采自山东省烟台海滨,由廊坊师范学院侯晓强副教授鉴定为伞形科植物珊瑚菜Glehnia littoralis Fr. Schmidt ex Miq. 的根。
大肠杆菌Escherichia coli(1.797)、金黄色葡萄球菌Staphylococcus aureus(1.2465)和白色假丝酵母菌Candida albicans(2.3990)购自中国普通微生物菌种保藏中心。
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL,自然pH。察氏培养基:硝酸钠3 g,磷酸氢二钾1 g,硫酸镁0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,蒸馏水1 000 mL,自然pH。牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15 g,pH 7.0~7.2。酵母培养基:葡萄糖10 g,蛋白胨10 g,酵母提取物5 g,琼脂15 g,蒸馏水1 000 mL,自然pH。
2 方法 2.1 内生真菌的分离与纯化采用植物组织分离法分离北沙参内生真菌。从5株北沙参健康植株上随机选取根、茎、叶,清水洗净,切成1 cm左右小段。70%乙醇浸泡30 s,无菌水洗涤1次,3% NaClO浸泡消毒,根、茎、叶消毒时间分别为4、3、1 min,无菌水洗涤3次。无菌条件下,将材料剪成0.2 cm小段,置于PDA培养基上,25 ℃黑暗培养。待植物材料长出真菌菌丝,挑取菌丝先端接种至PDA培养基上,25 ℃黑暗培养6~7 d,根据内生真菌的菌落形态和显微形态特征,对内生真菌进行纯化。
2.2 内生真菌的发酵液制备内生真菌接种于PDA培养基平板上,25 ℃黑暗培养7 d,用直径6 mm打孔器在菌落边缘打孔,挑取5块菌盘接种于装有100 mL察氏培养基的锥形瓶中,160 r/min、25 ℃黑暗培养10 d。离心分离去除菌丝体,发酵液用真空冷冻干燥机浓缩至1/10体积,备用。
2.3 抑菌实验大肠杆菌和金黄色葡萄球菌分别接种至液体牛肉膏蛋白胨培养基,37 ℃、200 r/min黑暗培养24 h。白色假丝酵母菌接种至液体酵母培养基,25 ℃、160 r/min黑暗培养48 h。用生理盐水分别对各指示菌菌液进行梯度稀释,稀释至浓度为1×106~1×107个/mL。
采用牛津杯扩散法[7]进行抑菌实验。分别取稀释的指示菌菌液0.1 mL均匀涂布在相应的固体培养基平板上,大肠杆菌和金黄色葡萄球菌分别涂布于牛肉膏蛋白胨培养基上,白色假丝酵母菌涂布于酵母培养基上。在涂布指示菌的平板上放置3~5只牛津杯,其中1只牛津杯中加入100 μL浓缩10倍的察氏培养基作为阴性对照,另1只牛津杯中加入100 μL抗生素溶液作为阳性对照(大肠杆菌和金黄色葡萄球菌平板以4 U/mL硫酸庆大霉素为阳性对照;白色假丝酵母菌平板以0.2 mg/mL氟康唑为阳性对照),其余牛津杯中分别加入不同内生真菌发酵液的浓缩液100 μL。指示菌平板4 ℃放置24 h后,置于相应的培养条件下培养(大肠杆菌和金黄色葡萄球菌平板37 ℃黑暗培养24 h,白色假丝酵母菌平板25 ℃黑暗培养48 h),平行实验重复3次,分别测定抑菌圈直径。
2.4 抑菌活性内生真菌的鉴定具有抑菌活性的内生真菌,依据rDNA的内部转录间隔区(ITS)序列进行分子鉴定。内生真菌基因组DNA采用柱式真菌基因组DNA抽提试剂盒(上海生工生物有限公司)提取,用通用引物ITS1:(5’-TCCGTAGGTGAACCTGCGG-3’),ITS4:(5’-TCCTCCGCTTATTGATATGC-3’)扩增ITS1 5.8 S的全序列[8]。PCR反应体系50 μL:1×PCR 缓冲液,MgCl2 3 mmol/L,4种dNTP各200 mmol/L,上下游引物各0.3 μmol/L,Taq酶2.0 U,DNA模板2 μL。反应程序:94 ℃预变性3 min,进入循环,94 ℃变性l min,55 ℃复性45 s,72 ℃延伸1 min,共35个循环,72 ℃延伸8 min。PCR产物送上海生工测序。将不同真菌的ITS序列在GenBank中进行BLAST分析,寻找与查询序列相似性大于95%的rDNA ITS序列[9],利用ClustalX 2.0.11软件[10]进行全序列比对,用MEGA 5.0软件[11]进行聚类分析,构建最大邻接树。根据聚类结果,对内生真菌进行分子鉴定。
3 结果与分析 3.1 北沙参内生真菌的分离从5株北沙参材料中共分离得到内生真菌69株,其中从根中分离得到30株,占分离菌株数的43.5%;茎中分离得到22株,占分离菌株数的31.9%;叶中分离得到17株,占分离菌株数的24.6%。可见北沙参中存在着丰富的内生真菌。
3.2 内生真菌的抑菌活性北沙参内生真菌中,有19株真菌至少对1种指示菌具有抑菌活性,活性菌株占内生真菌总数的27.5%,有2株真菌同时对大肠杆菌和金黄色葡萄球菌有抑菌活性,有1株真菌同时对金黄色葡萄球菌和白色假丝酵母菌有抑菌活性。
北沙参内生真菌中有4株真菌对大肠杆菌有不同程度的抑制作用,分别为02-S-12、02-S-21、02-R-3、02-R-9,其中菌株02-R-3的发酵浓缩液对大肠杆菌的抑菌效果最好,抑菌圈直径达(32.92±0.34) mm(图 1-A),其抑菌圈直径与4 U/mL硫酸庆大霉素抑菌圈直径比值(d/D)达1.07(表 1)。
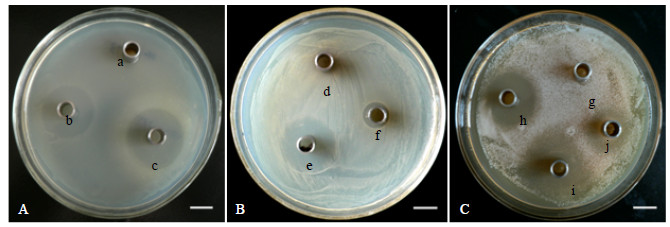 |
A-大肠杆菌 B-金黄色葡萄球菌 C-白色假丝酵母菌 a、d、g-培养基10倍浓缩液 b、e-4 U/mL硫酸庆大霉素 h-0.2 mg/mL氟康唑 c-02-R-3发酵浓缩液 f-02-L-10发酵浓缩液 i-02-S-2发酵浓缩液 j-02-S-22发酵浓缩液 A-E. coli B-S. aureus C-C. albicans a, d, g-concentrated solution of 10 times of medium b, e-gentamycin sulfate (4 U/mL) h-fluconazole (0.2 mg/mL) c-concentrated solution of 02-R-3 f-concentrated solution of 02-L-10 i-concentrated solution of 02-S-2 j-concentrated solution of 02-S-22 图 1 内生真菌发酵液的抑菌圈Fig.1 Antimicrobial effects of endophytic fungal fermented liquid |
| 表 1 北沙参内生真菌发酵浓缩液对大肠杆菌的抑菌作用 Table 1 Antibacterial effects of endophytic fungal fermented liquid on E. coli |
有15株内生真菌(02-L-8、02-L-10、02-L-11、02-L-15、02-L-21、02-L-22、02-S-3、02-S-10、02-S-12、02-S-15、02-S-21、02-S-22、02-S-32、02-R-5、02-R-11)发酵液对金黄色葡萄球菌表现出不同程度的抑菌活性,部分内生真菌的抑菌圈见图 1-B。内生真菌对金黄色葡萄球菌抑制作用结果见表 2。其中02-L-22的发酵浓缩液抑菌效果最佳,其发酵浓缩液抑菌圈直径与对照4 U/mL硫酸庆大霉素抑菌圈d/D值达0.65。
| 表 2 北沙参内生真菌发酵浓缩液对金黄色葡萄球菌的抑菌作用 Table 2 Antibacterial effects of endophytic fungal fermented liquid on S. aureus |
有3株内生真菌的对白色假丝酵母菌有不同程度的抑制作用,菌株分别为02-S-2、02-S-22、02-S-23(图 1-C)。内生真菌对白色假丝酵母菌的抑菌效果见表 3,其中02-S-2对白色假丝酵母菌的抑菌效果最好,抑菌圈直径为(31.5±0.41)mm,其发酵浓缩液抑菌圈直径与对照0.2 mg/mL氟康唑抑菌圈d/D值为1.27。
| 表 3 北沙参内生真菌发酵浓缩液对白色假丝酵母菌的抑菌作用 Table 3 Antimicrobial effects of endophytic fungal fermented liquid on C. albicans |
菌株02-S-12和02-S-21同时对大肠杆菌和金黄色葡萄球菌有抑菌活性,其对大肠杆菌的d/D值分别为0.30和0.91;对金黄色葡萄球菌的d/D值分别为0.23和0.40。菌株02-S-22同时对金黄色葡萄球菌和白色假丝酵母菌有抑菌活性,其d/D值分别为0.41和0.81。
3.3 内生真菌的鉴定对抑菌活性菌株ITS序列和与其相似性大于95%的已知真菌的ITS序列进行BLAST分析,构建最大邻接树,获得与待测菌株聚在同一分支且相似性最大的已知真菌,结果见表 4。根据相似性≥99%,可以鉴定到种;相似性在95%~99%,可以鉴定到属,而相似性<95%,只能鉴定到科的序列相似性原则[12],19株活性菌株与匹配菌株相似性均≥99%,可鉴定到种,其分类地位与匹配菌株一致(表 4),但菌株02-R-3的匹配菌株只鉴定到属,因而菌株02-R-3只能鉴定到属为Leptosphaeriasp.。19株抑菌活性菌株经分类鉴定,归于4个目,5个科,7个属,8个种。在这些内生真菌中,归属于同一个种的不同菌株的抑菌谱及抑菌作用存在差异,如C. destructivum、C. gloeosporioides和A. alternata。可能是内生真菌种下亚种的分化或株系间存在的差异,导致次生代谢产物种类及产量的不同。Mapperson等[13]在光黑壳属Preussia Fuckel内生真菌抗菌活性研究中发现,P. isomera的不同菌株的抑菌谱及抑菌作用也存在差异。
| 表 4 聚类分析获得的与抑菌活性内生真菌相似性最大的菌株 Table 4 Endophytic fungi and their closest relatives from GenBank |
以大肠杆菌、金黄色葡萄球菌和白色假丝酵母菌为指示菌,研究北沙参内生真菌发酵液的抑菌活性。内生真菌发酵液的抑菌圈直径大小可以反映出抑菌活性的高低,但研究中发现,同一浓度的抗生素溶液在同一种指示菌的不同平板上的抑菌圈大小存在差异。内生真菌发酵液抑菌活性测定时,在每个指示菌平板上,以内生真菌发酵培养基作为阴性对照,以抗生素作为阳性对照,以内生真菌发酵液的抑菌圈直径与抗生素抑菌圈直径的比值作为衡量内生真菌抑菌活性的指标,更能准确地反映内生真菌发酵液抑菌活性的强弱。
植物内生真菌是新天然产物及活性物质发现的重要来源,本研究从北沙参中获得了19株具有抑菌活性的内生真菌,经分类鉴定归于4个目,5个科,7个属,8个种。部分活性内生真菌的同种或同属内生真菌已有抗菌活性化合物的报道,黄花蒿内生真菌C. gloeosporicoides 产生的colletotric acid对真菌具有很强的抑制作用[14];Zhou等[15]从红树植物Brguiera sexangulaLour.内生真菌Stemphylium sp. 中获得的2种新的具有抑菌活性的α吡喃酮衍生物Infectopyrones A、B;Strongman等[16]从红树内生真菌Leptosphaeria oraemaris Linder. 中发现一种具有抗菌活性的倍半萜culmorin。交链孢属Alternaria(Nees)内生真菌能够产生多种抑菌活性物质,如从黄精分离的交链孢属真菌可产生三萜皂苷[17],从Dendronephthya hemprichi Klunzinger分离的真菌A. alternata可产生7种萘骈-γ-吡酮(naphtho-γ-pyrone)类衍生物[18];从Terminalia chebula Retz.分离的真菌A. alternata可产生altenusin[19]。由此可见,北沙参抑菌活性内生真菌具有产生多种抑菌活性物质的潜力,其中A. alternata也可能产生与北沙参聚炔类抑菌成分相类似的抑菌化合物。内生真菌产生化合物的种类,可能与宿主植物协同进化有关。Kim等[20]发现寄生植物菟丝子和寄主植物之间存在RNA的自由交换,进而影响各自的生长过程。内生真菌生活在植物体内,二者之间也可能存在着RNA的交换,从而影响二者的次生代谢过程,这或许是不同产地药材道地性差异的原因之一。因此,研究北沙参内生真菌的抑菌活性,有助于从药用植物北沙参内生真菌中寻找新的抑菌活性物质,有助于了解内生真菌和北沙参在次生代谢方面的相互影响,对于北沙参药材质量评价具有一定的指导意义。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 国家重点保护野生植物名录(第1批)[M]. 北京: 国家林业局、农业部, 1999. |
| [3] | 辛 华, 丁雨龙. 北沙参的生物学与化学成分的研究进展[J]. 中草药, 2008, 39(8): 1275-1277. |
| [4] | Yuan Z, Tezuka Y, Fan W, et al. Constituent of the underground parts of Glehnia littoralis[J]. Chem Pharm Bull, 2002, 50(1): 73-77. |
| [5] | 毕江涛, 何 萍, 吕 雯, 等. 桃儿七内生真菌分离及其抑菌活性初步研究[J]. 中草药, 2013, 43(12): 1667-1672. |
| [6] | 施琦渊, 陈晓梅, 郭顺星. 植物内生真菌来源的抗菌活性物质研究进展[J]. 中国药学杂志, 2007, 42(11): 804-807. |
| [7] | 邵 颖, 陈宏伟, 柴文波, 等. 蛹拟青霉发酵液中抑菌活性成分的分离纯化[J]. 食品科学, 2012, 33(23): 116-120. |
| [8] | PCR Protocols: a Guide to Methods and Applications[M]. New York: Academic Press, 1990. |
| [9] | Sánchez M S, Bills G F, Zabalgogeazcoa I. Diversity and structure of the fungal endophytic assemblages from two sympatric coastal grasses[J]. Fungal Divers, 2008, 33(1): 87-100. |
| [10] | Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2. 0[J]. Bioinformatics, 2007, 23(21): 2947-2948. |
| [11] | Tamura K, Peterson D, Peterson N, et al. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Mol Biol Evol, 2011, 28(10): 2731-2739. |
| [12] | Landeweert R, Leeflang P, Kuyper T W, et al. Molecular identification of ectomycorrhizal mycelium in soil horizons[J]. Appl Environ Microbiol, 2003, 69(1): 327-333. |
| [13] | Mapperson R R, Kotiw M, Davis R A, et al. The diversity and antimicrobial activity of Preussia sp. endophytes isolated from Australian dry rainforests[J]. Curr Microbiol, 2014, 68(1): 30-37. |
| [14] | Lu H, Zou W X, Meng J C, et al. New bioactive metabolites produced by Colletotrichum sp., an endophytic fungus in Artemisia annua[J]. Plant Sci, 2000, 151(1): 67-73. |
| [15] | Zhou X M, Zheng C J, Song X P, et al. Antibacterial α-pyrone derivatives from a mangrove-derived fungus Stemphylium sp. 33231 from the South China Sea[J]. J Antibiot (Tokyo), 2014, 7(5): 401-403. |
| [16] | Strongman D B. A culmorin by marine fungi Leptosphaeria oraemaris[J]. J Bot Mar, 1986, 30(1): 21-25. |
| [17] | 李艳玲, 王德才, 史仁玖, 等. 泰山黄精内生真菌的分离鉴定及抑菌活性研究[J]. 中草药, 2013, 44(11): 1490-1494. |
| [18] | Shaaban M, Shaaban K A, Abdel-Aziz M S. Seven naphtho-γ-pyrones from the marine-derived fungus Alternaria alternata: structure elucidation and biological properties[J]. Org Med Chem Lett, 2012, 2(1): 6-13. |
| [19] | Phaopongthai J, Wiyakrutta S, Meksuriyen D, et al. Azole-synergistic anti-candidal activity of altenusin, a biphenyl metabolite of the endophytic fungus Alternaria alternata isolated from Terminalia chebula Retz[J]. J Microbiol, 2013, 51(6): 821-828. |
| [20] | Kim G, LeBlanc M L, Wafula E K, et al. Plant science. Genomic-scale exchange of mRNA between a parasitic plant and its hosts[J]. Science, 2014, 345(6198): 808-811. |
 2015, Vol. 46
2015, Vol. 46

