2. 沈阳师范大学粮食学院, 辽宁 沈阳 110034
2. College of Grain Science and Technology, Shenyang Normal University, Shenyang 110034, China
黄柏和黄连对小鼠机体代谢影响的比较研究天山雪莲Saussureainvolucrata(Kar. et Kir.)Sch. -Bip.是我国稀有的传统名贵药材,具有补肾活血、强筋骨、温肾助阳等功效[1]。由于天山雪莲野生资源十分有限,其人工培育意义重大。李燕[2]采用植物细胞培养的方法,选取天山雪莲离体组织通过脱分化形成的愈伤组织作为继代种子,给予一定条件进行继代培养而获得较大愈伤组织团块,其化学成分与野生天山雪莲成分相似,有效成分主要为黄酮类化合物和多糖。但关于天山雪莲愈伤组织的药理作用研究尚未见报道。
成骨细胞是承担骨重建的一类重要细胞,对维持正常骨转换具有重要意义[3]。老年骨质疏松症主要病理机制是成骨细胞的骨形成能力下降,从而导致骨量低下、骨微结构损害、骨脆性增加,甚至发生骨折[4, 5, 6]。用于骨质疏松研究的模型包括动物模型和细胞模型,与动物模型比较,细胞模型由于样品均一、可控性强、重复性好、通量高等特点,广泛应用于药物筛选、活性评价等诸多研究;目前,用于骨质疏松研究的主要细胞系有小鼠胚胎成骨细胞MC3T3-E1、大鼠成骨肉瘤细胞UMR-106、ROS17/2.8和人成骨肉瘤细胞HOS TE85、MG-63、SaOS-2等,用于考察成骨细胞增殖、分化能力以及功能表达。
MG-63来源于人成骨肉瘤细胞,不仅具有成骨细胞的特点,容易培养,而且与人成骨细胞同源性更高。因而,本实验以MG-63为对象,探讨天山雪莲愈伤组织提取物(extract from callus of Saussureainvolucrate, ESI)对成骨细胞增殖、发育的影响及作用机制,在细胞水平上为天山雪莲在抗骨质疏松的药效学方面提供实验及理论依据,为ESI的应用及开发提供参考。
1 材料 1.1 细胞株人成骨肉瘤细胞MG-63(KG231)购于南京凯基生物科技发展有限公司。
1.2 试剂DMEM培养基、胰蛋白酶、胎牛血清(FBS),美国Gibco-BRL生命技术有限公司;噻唑蓝(MTT),美国Invitrogen有限公司;西吡氯铵(CPC)、茜素红-S(ARS)、二甲基亚砜(DMSO),美国Sigma-Aldrich公司;碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、4-羟脯氨酸(Hyp)试剂盒,南京建成生物技术有限公司;抗坏血酸、β-甘油磷酸钠,北京索莱宝科技有限公司;Trizol试剂、琼脂糖,美国Invitrogen有限公司;Reverse Transcriptase M-MLV(RNase H),2641Q,宝生物工程(大连)有限公司;各种引物合成、实时荧光定量PCR(RT-PCR)中使用的酶,华大基因;p38特异性抑制剂SB203580,碧云天生物技术研究所。
1.3 药物ESI由大连普瑞康生物技术有限公司提供。提取方法:雪莲培养物干燥粉末中加入30%乙醇溶液,固液比为1∶15,超声提取,温度为85℃,每次提取60min,连续提取2次,合并2次所得液体,60℃减压浓缩获得实验样品。以芦丁作为对照品,分光光度计法检测500nm波长下吸光度值,计算总黄酮质量浓度,结果ESI中含总黄酮为6.1%,ESI使用时用培养基稀释。
1.4 仪器SX-500高压蒸气灭菌锅,日本TOMY公司;垂直层流洁净工作台,上海净化设备有限公司;MAXI dry lyo真空冷冻干燥机,丹麦Heto公司;Hera cell 150二氧化碳培养箱,美国Thermo公司;IX71荧光显微镜,日本Olympus公司;Biofuge Stratos冷冻离心机,美国Thermo公司;Varioskan Flash全波长扫描荧光酶标仪,美国Thermo公司;TakaraTP-600PCR仪,宝生物工程(大连)有限公司;全自动凝胶成像系统,Syngene公司;PVDF膜,美国Millipore公司。
2 方法 2.1 细胞培养MG-63细胞用含10% FBS的DMEM培养基,在5% CO2、37 ℃细胞培养箱培养。待细胞完全融合时,加入磷酸缓冲液(PBS)清洗1~2遍,用0.25%胰酶消化,细胞开始出现皱缩,细胞间隙明显即可倒掉胰酶,加入培养基吹打。以1∶3传代比继续在25 cm2培养瓶中培养。3~4 d传代1次,传代1~2次后即可用于后续实验。
2.2 MTT法测定细胞增殖取对数生长期、生长状态良好的MG-63细胞,以每孔5 000个接种于96孔板中。培养24h后,给药组加入ESI(总黄酮质量浓度分别为15.625、31.25、62.5、125、250、500 μg/mL),对照组加入等体积的培养基。药物作用48 h后弃去培养基,加入100 μL MTT溶液(0.5 mg/mL)37 ℃孵育4 h。小心吸弃上清液,每孔加入150 μL DMSO溶解紫色结晶甲瓒,混匀。使用酶标仪检测570 nm波长处的吸光度(A)值,以630 nm波长下A值作为参照。
2.3 LDH活性测定MG-63细胞以每孔5 000个接种于96孔板,24 h后给药组加入ESI(总黄酮质量浓度分别为31.25、62.5、125 μg/mL),对照组加入等体积的培养基。继续培养48 h,取上清液,测定LDH释放量,检测步骤严格按照LDH试剂盒说明书操作。
2.4 ALP活性测定MG-63细胞以每孔4×105个接种于6 cm培养板,待细胞融合度达到80%时加入ESI(分组及给药情况同“2.3”项)。培养48 h后收集细胞,PBS洗2遍,加入细胞裂解液涡旋破碎细胞,14000 r/min、4 ℃离心15 min,取上清液,即为总蛋白,置于冰上,严格按照ALP试剂盒说明书操作测定ALP活性,检测波长为520 nm。
2.5 I型胶原蛋白水平测定细胞处理及分组给药同“2.4”项。培养3 d后收集细胞。每个处理组加入1 mL 6 mol/L HCl,110 ℃水解2.5 h后,真空冷冻干燥。用蒸馏水重新溶解细胞水解产物,按照Hyp检测试剂盒说明书测定Hyp水平。以此来反映成骨细胞中I型胶原蛋白的水平。
2.6 ARS染色鉴定骨矿化MG-63细胞以每孔2×105个接种于6孔板,待细胞融合度达到80%时,矿化组和给药组均加入含50 μmol/L抗坏血酸和10 mmol/L β-甘油磷酸钠的DMEM培养基继续培养,给药操作同“2.3”项,对照组加入等体积的培养基。每2天换液,每天观察细胞状态。18 d后倒置显微镜观察可看到细胞融合成片,并且有较多不透明的灶点,即为矿化结节。用PBS洗2遍,95%乙醇固定细胞10 min,蒸馏水浸洗。洗净后,加入ARS-tris-HCl(40 mmol/L,pH 4.2),37 ℃染色30~60 min。加入蒸馏水清洗2~3遍,将未结合的染料洗掉后室温下干燥,倒置显微镜下观察照相。用10% CPC溶液溶解结合的ARS,测定其在550 nm下A值,以定量钙沉积情况[7, 8, 9]。
2.7 RT-PCR检测骨保护素(OPG)和核因子-κB活化因子受体配体(RANKL)mRNA表达将MG-63细胞以每孔4×105个接种于6cm培养板,24 h后加入相应浓度ESI(分组及给药情况同“2.3”项)。48 h后消化收集细胞。使用Trizol法提取总RNA,使用Reverse Transcriptase M-MLV(RNase H)将RNA逆转录合成cDNA。PCR扩增引物序列及反应条件:OPG上游引物为5’-GCTAACCTCACCTTCGAG-3’,下游引物为5’-TGATTGGACCTGGTTACC-3’;RANKL上游引物为5’-GCCAGTGGGAGATGTTAG-3’,下游引物为5’-TTAGCTGCAAGTTTTCCC-3’;GAPDH上游引物为5’-TACATTTTGCTGATGACTGG-3’,下游引物为5’-TGAATGGTAGGAGCTTGACT-3’。PCR扩增反应条件:94 ℃预变性5 min后进入循环;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,循环35次;最后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳,DNA条带的单位面积灰度用凝胶成像仪测定,使用Image J软件分析电泳条带灰度,目的基因mRNA水平以与参照基因GAPDH的灰度比值表示。
2.8 Western blotting检测OPG和RANKL蛋白表达将MG-63细胞以每孔8×105个接种于10 cm培养板,融合达80%,给药组加入ESI(总黄酮质量浓度为31.25、62.5 μg/mL),对照组加入等体积的培养基。48 h后胰酶消化收集细胞,加入细胞裂解液提取总蛋白,BCA法测定蛋白浓度,提取液中加入5×SDS上样缓冲液,煮沸变性5 min,制备变性聚丙烯凝胶,浓缩胶5%,分离胶12%,上样,每孔含80~100 μg蛋白。转膜,将膜浸泡在5%脱脂牛奶中,37 ℃封闭2 h;加一抗溶液,4 ℃孵育过夜,第2天37 ℃室温热孵1 h,用TBST液洗3次,每次10 min;加入对应的荧光二抗,室温孵育40 min,用TBST液避光洗3次,每次15 min,压片10 min,显影5 min,定影5 min。Image J软件分析图片中条带灰度值。实验重复3次。
2.9 SB203580对ESI作用的影响分别按照“2.2”“2.4”~“2.8”项方法接种培养细胞,培养24 h后弃培养基,对照组加入新鲜培养基,SB203580组和ESI+SB203580组加入10 μmol/L SB203580,作用2 h后,ESI加药组和ESI+SB203580组均加入ESI(总黄酮质量浓度62.5 μg/mL)继续培养。分别按照“2.2”“2.4”~“2.8”项方法检测各项指标。
2.10 数据处理及统计分析所得数据以x±s表示,采用SPSS17.0统计软件One-way ANOVA方差分析,组间比较采用t检验。
3 结果 3.1 MG-63细胞增殖和LDH活性如图 1所示,ESI总黄酮质量浓度低于125 μg/mL对MG-63细胞没有细胞毒性,在31.25、62.5μg/mL能够显著促进MG-63细胞增殖(P<0.01)。LDH活性测定结果表明,31.25、62.5 μg/mL的ESI能够显著降低MG-63细胞LDH活性(P<0.01),分别为对照组的(90.40±3.30)%和(68.42±3.57)%,保护了细胞膜的完整性。而125 μg/mL的ESI显著升高LDH活性,表明高质量浓度ESI对MG-63细胞膜具有破坏作用(P<0.01)。
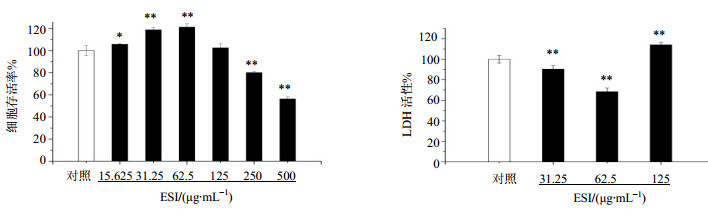 |
与对照组比较:*P<0.05 **P<0.01 *P<0.05**P<0.01 vs control group 图 1 ESI对MG-63细胞增殖和LDH活性的影响(x±s,n=3)Fig.1 Effect of ESIon proliferation and LDH activity ofMG-63 cells (x±s,n=3) |
ALP作为成骨细胞分化的标志酶,其活性可以反映成骨细胞的活性和状态。31.25、62.5 μg/mL的ESI作用于MG-63细胞48 h后,ALP活性分别为对照组的(141.05±8.28)%和(164.02±11.67)%,均显著高于对照组(P<0.01)。结果见图 2。
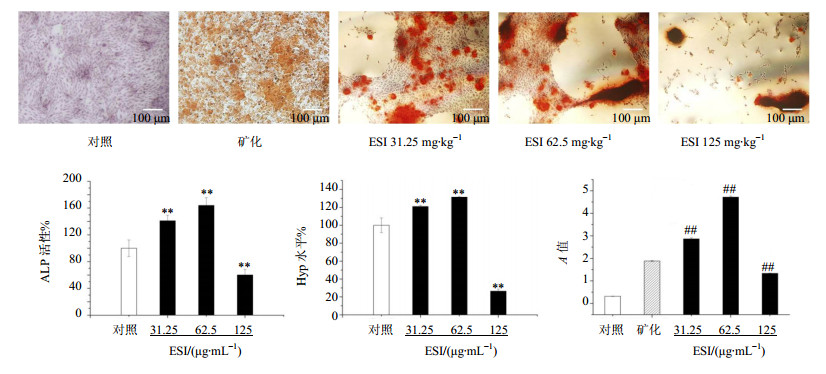 |
与对照组比较:**P<0.01;与矿化组比较:##P<0.01 **P<0.01 vs control group;##P<0.01vsmineralization group 图 2 ESI对MG-63细胞分化和矿化的影响(x±s,n=3)Fig.2 Effect of ESI on differentiation and mineralization of MG-63 cells (x±s,n=3) |
I型胶原蛋白和钙的沉积均是影响骨基质矿化的重要因素。Hyp在胶原蛋白中占13.4%,而在弹性蛋白中质量分数极少,其他蛋白中均不存在。因此采用Hyp水平来反映胶原蛋白的水平。药物作用MG-63细胞72 h后,Hyp分别为对照组的(121.04±1.20)%和(131.53±0.77)%,表明ESI处理MG-63细胞后,I型胶原蛋白水平均显著高于对照组(P<0.01)。结果见图 2。
加入抗坏血酸和β-甘油磷酸钠的矿化培养基培养细胞18 d后,倒置相差显微镜观察,矿化组与ESI组(31.25、62.5、125 μg/mL)均形成较多不透明的结节。ARS染色后不透明结节呈红色圆形或不规则形状,中心颜色较深。与矿化组比较,ESI组形成的矿化结节更多,ARS染色后红色更鲜亮,表明ESI组增加了钙化区域。加入10% CPC洗脱ARS染色液后,酶标仪检测A值结果显示,31.25、62.5 μg/mL的ESI处理组A值明显高于矿化组(P<0.01),表明其形成更多的ARS和钙的复合物,形成更多钙的沉积,促进矿化基质的形成。结果见图 2。
如图 2所示,125 μg/mL浓度的ESI处理MG-63细胞也形成矿化结节,但由于ESI对MG-63细胞的毒性作用,抑制了ALP活性、胶原蛋白形成和钙沉积(P<0.01)。
3.3 MG-63细胞OPG和RANKLmRNA的表达差异RT-PCR结果见图 3,31.25、62.5、125 μg/mL ESI上调MG-63细胞OPG mRNA的表达(P<0.05、0.01),并且均显著下调了RANKL mRNA的表达(P<0.01)。表明ESI促进MG-63细胞分化和矿化的机制之一是调控OPG和RANKL基因表达。
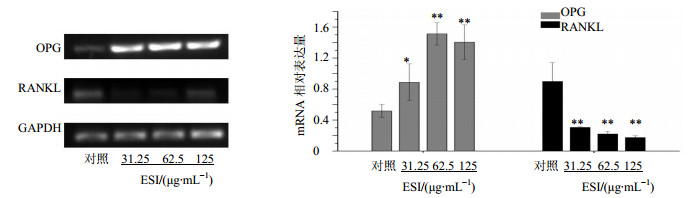 |
与对照组比较:*P<0.05 **P<0.01 *P< 0.05**P< 0.01 vs control group 图 3 ESI对MG-63细胞OPG和RANKL mRNA表达的影响(x±s,n = 3)Fig.3 Effect of ESI on expression of OPG and RANKL mRNA in MG-63 cells(x±s,n = 3) |
如图 4所示,与对照组相比,31.25、62.5 μg/mL的ESI能够显著提高OPG与RANKL的比值(P<0.01),其中62.5 μg/mL ESI对OPG/RANKL值的影响较大,进一步证明ESI对MG-63细胞分化的促进作用与OPG和RANKL基因的表达有关。
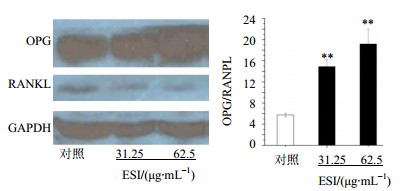 |
与对照组比较:**P<0.01 **P< 0.01 vs control group 图 4 ESI对MG-63细胞OPG和RANKL蛋白表达的影响(x±s,n = 3)Fig.4 Effect of ESI on expression of OPG and RANKL proteinin MG-63 cells(x±s, n = 3) |
经过p38特异性抑制剂SB203580干预处理,如图 5所示,MG-63细胞增殖、分化和矿化均无明显变化,与对照组比较差异不显著(P>0.05)。与对照组相比,加入ESI(62.5 μg/mL)明显增强了MG-63细胞增殖、ALP活性、Hyp水平以及矿化沉积程度(P<0.01);与ESI组比较,ESI+SB203580组明显抑制了ESI对MG-63细胞的增殖分化的诱导作用,降低了ALP活性和Hyp水平,并阻滞了矿化结节的形成(P<0.01)。
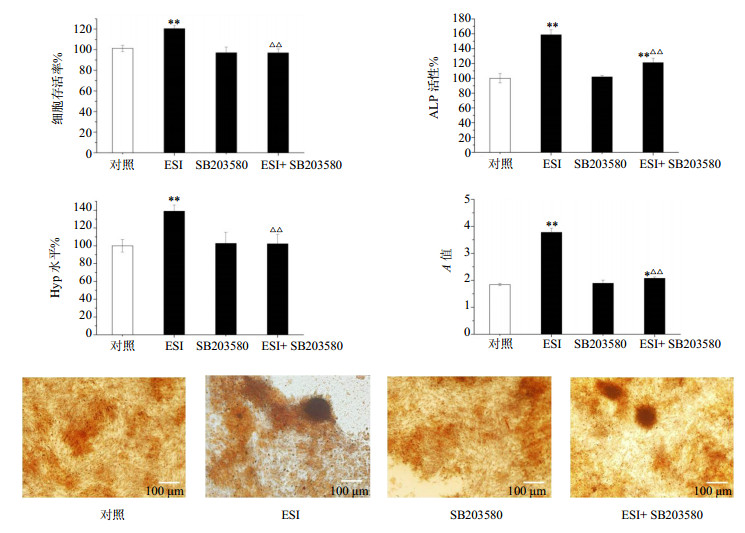 |
与对照组比较:*P<0.05 **P<0.01;与ESI组比较:△△P<0.01 *P< 0.05**P< 0.01 vs control group; △△P< 0.01 vsESI group 图 5 ESI和SB203580对MG-63细胞增殖、分化和矿化的影响(x±s,n = 3)Fig.5 Effect of ESI and SB203580 on proliferation, differentiation,and mineralization of MG-63cells(x±s±s,n = 3) |
与ESI单独处理组相比较,在mRNA水平上,SB203580与ESI共同作用,下调了OPG mRNA的表达(P<0.01),上调了RANKL mRNA的表达(P<0.05);在蛋白水平上,共同处理组抑制OPG蛋白的高表达,促进了RANKL的表达,从而显著降低了OPG/RANKL值(P<0.01),结果见图 6。
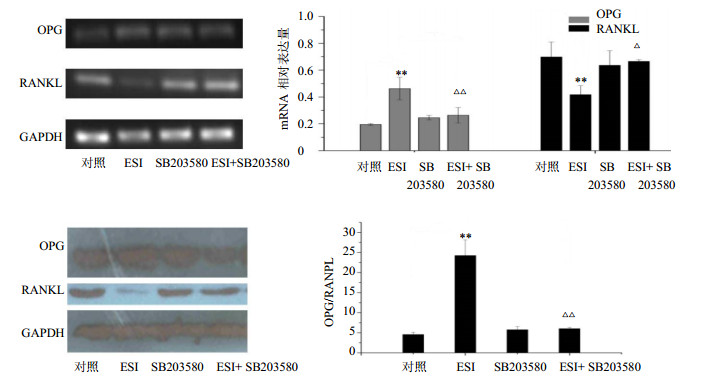 |
与对照组比较:**P<0.01;与ESI组比较:△P<0.05 △△P<0.01 **P< 0.01 vs control group;△P< 0.05△△P< 0.01 vsESI group 图 6 ESI和SB203580对MG-63细胞OPG和RANKL mRNA及蛋白表达的影响(x±s,n = 3)Fig.6 Effect of ESIand SB203580 on mRNA and protein expression of OPG and RANKL in MG-63 cells(x±s,n = 3) |
综上,细胞增殖、ALP活性、I型胶原蛋白水平、矿化水平以及OPG、RANKL基因表达多个方面表明p38特异性抑制剂SB203580能够抑制ESI对成骨细胞MG-63分化的促进作用,说明ESI对MG-63细胞的影响与p38 MAPK通路有关。
4 讨论世界卫生组织将骨健康系列问题疾病列为继心脑血管疾病、癌症、糖尿病“三大杀手”外对人体危害最广泛的问题。健康的骨骼通过持续的骨重塑来维持,而这一动态平衡由介导骨吸收的破骨细胞和介导骨形成的成骨细胞调节[10, 11]。但是由于绝经后雌激素缺乏、年龄增长或者疾病、药物等原因,导致骨形成和骨吸收之间的动态平衡被打破。除了适当的药物治疗之外,早期的骨骼强壮的维护和钙质的积累才是预防骨骼病变的更有效措施。
成骨细胞通过自身增殖、分化,诱导和调节细胞外基质矿化,并控制骨重建过程。在骨形成过程中,成骨细胞经历了成骨细胞增殖、细胞外基质成熟、细胞外基质矿化和成骨细胞凋亡4个阶段。MTT和LDH活性检测结果表明ESI在低于125 μg/mL时对体外成骨样细胞没有毒性,且在31.25 μg/mL和62.50 μg/mL时具有显著促进细胞增殖的保护作用。成骨细胞增殖晚期,开始出现分化,ALP是成骨细胞分化的早期指标[12],ALP能够水解有机磷酸酯,使局部PO43−浓度升高,启动钙化[10]。实验发现ESI可显著提高成骨细胞ALP活性。
在骨形成阶段,成熟的成骨细胞合成和分泌I型胶原蛋白和各种非胶原蛋白,如骨钙素(OCN)、骨桥蛋白(OPN)和骨唾液酸蛋白(BSP)。实验结果表明,ESI能够提高MG-63细胞的Hyp水平,即提高I型胶原蛋白的水平,胶原蛋白水平的提高,能够使骨骼具有韧性和弹性,吸收外界能量;同时它所形成的空间三维网状结构是矿化的前提[13];ARS染色实验结果也证明,ESI能够促进矿化结节的形成,即促进钙的积累;这一结果表明ESI可增加骨强度,帮助提高骨峰值,降低发生骨折的可能性。
此外,成骨细胞还分泌OPG、RANKL等细胞因子,将破骨细胞的骨吸收偶联起来,调节破骨细胞的分化和活性,在骨吸收过程中也起关键性作用[14, 15, 16, 17]。ESI通过上调OPG的表达,降低RANKL的表达来影响MG-63细胞的分化和矿化。
成骨细胞的生长和分化由受体酪氨酸激酶介导,许多细胞外信号调节该激酶,其中大多数是激活Ras丝裂原活化蛋白激酶(MAPKs)级联反应[18]。p38 MAPK是MAPK信号转导途径的通道之一,p38 MAPK是由各种环境刺激和因子引起的细胞反应所激活,它能调节成骨细胞中OPG和/或RANKL的表达[19]。本实验用特异性阻断剂SB203580阻断p38MAPK信号转导通路,发现对ESI介导的成骨样细胞的增殖分化的促进作用以及对OPG/RANKL表达的上调作用均有明显抑制,表明ESI促进成骨样细胞增殖、分化,促进骨形成可通过p38 MAPK通路介导。由于阻断p38 MAPK通路并不能完全抑制ESI促进成骨样细胞的分化作用,因此,ESI可能依赖ERK、c-Jun N端激酶JNK等通路影响成骨细胞,将有待于进一步研究。
综上所述,ESI在细胞水平上能够促进人成骨样细胞MG-63增殖分化以及骨基质的形成,表现出抗骨质疏松作用,但是在细胞水平上,还可通过成骨细胞和破骨细胞共培养模型,或三维培养模型进一步评价。将ESI作用于去势大鼠,发现其能够增加去势大鼠骨钙浓度,显著增加骨密度[20],但是,抗骨质疏松的功效评价仍需要整体水平的动物模型实验,包括原发性、继发性及基因重组骨质疏松动模型等,进一步探究其抗骨质疏松的临床意义。
| [1] | 中国药典[S]. 一部. 2010. |
| [2] | 李燕. 天山雪莲全草及其细胞培养物化学成分的研究[D]. 北京:中国协和医科大学, 2006. |
| [3] | Lo Y C, Chang Y H, Wei B L, et al. Betulinic acid stimulates the differentiation and mineralization of osteoblastic MC3T3-E1 cells:involvement of BMP/Runx2 and β-catenin signals[J]. Agric Food Chem, 2010, 58(11):6643-6649. |
| [4] | Jiang S D, Yang Y H, Chen J W, et al. Isolated osteoblasts from spinal cord-injured rats respond less to mechanical loading as compared with those from hindlimbimmobilized rats[J]. Spinal Cord Med, 2013, 36(3):220-224. |
| [5] | Niu Y B, Li Y H, Kong X H, et al. The beneficial effect of Radix dipsaci total saponins on bone metabolism in vitro and in vivo and the possible mechanisms of action[J]. Osteoporos Int, 2012, 23(11):2649-2660. |
| [6] | Lewiecki E M. New targets for intervention in the treatment of postmenopausal osteoporosis[J]. Nat Rev Rheumatol, 2011, 7(11):631-638. |
| [7] | 樊秦, 赵文君, 李应东. 华中五味子含药血清对成骨细胞增殖分化的影响[J]. 中国实验方剂学杂志, 2009, 15(2):33-35. |
| [8] | Miyamoto S, Miyamoto Y, Shibata Y, et al. In situ quasi-static and dynamic nanoindentation tests on calcified nodules formed by osteoblasts:Implication of glucocorticoids responsible for osteoblast calcification[J]. Acta Biomaterialia, 2015, 12(15):216-226. |
| [9] | Cho Y E, Alcantara E H, Kuinaran S, et al. Red yeast rice stimulates osteoblast proliferation and increases alkaline phosphatase activity in MC3T3-E1 cells[J]. Nutr Res, 2010, 30(7):501-510. |
| [10] | Harada S, Rodan G A. Control of osteoblast function and regulation of bone mass[J]. Nature, 2003, 423(6937):349-355. |
| [11] | Li B, Ling Chau J F, Wang X, et al. Bisphosphonates, specific inhibitors of osteoclast function and a class of drugs for osteoporosis therapy[J]. Cell Biochem, 2011, 112(5):1229-1242. |
| [12] | Lee H S, Jung E Y, Bae S H, et al. Stimulation of osteoblastic differentiation and mineralization in MC3T3-E1 cells by yeast hydrolysate[J]. Phytother Res, 2011, 25(5):716-723. |
| [13] | Saito M, Marumo K, Kida Y, et al. Changes in the contents of enzymatic immature, mature, and non-enzymatic senescent cross-links of collagen after once-weekly treatment with human parathyroid hormone (1-34) for 18 months contribute to improvement of bone strength in ovariectomized monkeys[J]. Osteoporos Int, 2011, 22(8):2373-2383. |
| [14] | Li F, Yang Y, Zhu P, et al. Echinacoside promotes bone regeneration by increasing OPG/RANKL ratio in MC3T3-E1 cells[J]. Fitoterapia, 2012, 83(8):1443-1450. |
| [15] | 仲蕾蕾, 杨冰, 黄晓斌, 等. OPG/RANKL/RANK系统在成骨细胞和破骨细胞相互调节中的作用[J]. 中国骨质疏松杂志, 2011, 17(11):1010-1013. |
| [16] | Kearns A E, Khosla S, Kostenuik P J. Receptor activator of nuclear factor kappaB ligand and osteoprotegerin regulation of bone remodeling in health and disease[J]. Endocr Rev, 2008, 29(2):155-192. |
| [17] | Silvestrini G, Ballanti P, Sebastiani M, et al. OPG and RANKL mRNA and protein expressions in the primary and secondary metaphyseal trabecular bone of PTH-treated rats are independent of that of SOST[J]. J Mol Hist, 2008, 39(2):237-242. |
| [18] | 王慧, 李玉坤. 成骨细胞分化调控因子研究进展[J]. 国际骨科学杂志, 2011, 32(6):377-379. |
| [19] | Luo X H, Guo L J, Xie H, et al. Adiponectin stimulates RANKL and inhibits OPG expression in human osteoblasts through the MAPK signaling pathway[J]. J Bone Min Res, 2006, 21(10):1648-1656. |
| [20] | 王怡薇, 刘雅萍, 张献, 等. 雪莲细胞培养物对卵巢切除大鼠骨密度的影响[J]. 国际中医中药杂志, 2014, 36(9):824-826. |
 2015, Vol. 46
2015, Vol. 46


