2. 四川省中医药科学院, 四川 成都 610041;
3. 北京以岭药业有限公司, 北京 102600
2. Sichuan Academy of Chinese Medicine Sciences, Chengdu 610041, China;
3. Beijing Yiling Pharmaceutical Co., Ltd., Beijing 102600, China
马甲子Paliurus ramosissimus (Lour.) Poir. 系鼠李科(Rhamnaceae)马甲子属Paliurus Mill. 植物,又名铁篱笆、铜钱树。在我国长江流域以南各省均有分布,多生于丘陵林边灌丛中或荒山草地上。其根、果实、叶均可供药用,根能除寒活血、解热消肿,治疗跌打损伤及心腹疼痛;果实能化瘀止血、活血止痛,我国台湾省民间用于治疗牙痛和腹痛[1];叶能治疗无名肿痛,民间多用于治痈疮溃疡等。也有报道证实马甲子醇提物具有镇咳祛痰的功效[2]。国内外目前还未见有关马甲子活性成分的报道。本实验从马甲子中提取出2个单体化合物,分别为白桦脂酸(betulinic acid,1)和2α,27-二反式对羟基肉桂酰氧基白桦脂酸[2α,27-di (E-p-hydroxy cinnamoyloxy)-betulinic acid,2]。其中化合物2为新化合物,命名为马甲子素,属于白桦脂酸型五环三萜类化合物。化合物1和2均为首次从本植物中发现。化合物2表现出显著的体外抗肿瘤活性,对HepG-2细胞和HeLa细胞的IC50分别为20.34、14.83 μmol/L。
1 材料与仪器柱色谱硅胶(100~200、300~400目)和薄层色谱硅胶(青岛海洋化工厂产品);Bruker Avance 600 核磁共振仪(瑞士Bruker公司);VG-7070质谱仪(英国VG公司);制备液相色谱系统(安捷伦1200系列);YMC-Pack ODS-A C18柱;Sartorius BS210S电子天平(北京赛多利斯天平有限公司);Mettler Toledo超越系列专业型XS分析天平(梅特勒-托利多有限公司);XMTD-8222真空干燥箱(上海精宏实验设备有限公司);FZ102粉碎机(北京中兴伟业仪器有限公司);安捷伦1200高效液相色谱仪(美国安捷伦公司),试剂均为分析纯。DMEM培养基、胎牛血清(Hyclone公司,美国);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、青霉素、链霉素(Amresco公司,美国);胰蛋白酶(Gibco公司,美国);人肝癌细胞HepG-2、人宫颈癌细胞HeLa(四川大学华西药学院靶向药物及释药系统教育部重点实验室提供);Thermo Forma系列CO2培养箱(Sanyo,日本);Model-550型酶联免疫检测仪(Bio-Rad,美国);SW-CJ-2D型超净工作台(苏州市净化设备总厂);倒置显微镜(型号Fx-35DX,Nikon);离心机(型号TGL-16G,上海医用分析仪器厂)。
实验用马甲子(多年生)于2013年7月采自四川省双流县牧马山,经四川省中医药科学院舒光明研究员鉴定为鼠李科马甲子属植物马甲子Paliurus ramosissimus (Lour.) Poir.。
2 方法 2.1 提取与分离[3, 4]取马甲子3 kg,粉碎后,用95%乙醇10倍量浸泡3 d后,收集浸提液,减压浓缩得浸膏225 g,浸膏用20%乙醇液3 L进行超声溶解,用醋酸乙酯萃取,得到醋酸乙酯提取物(72.4 g),再经硅胶柱色谱分离,石油醚-醋酸乙酯系统(20∶1、15∶1、5∶1、3∶1、1∶1)依次洗脱,得到5个组分Fr. A~E。取一半量的Fr. E(石油醚-醋酸乙酯1∶1)洗脱组分,经反复硅胶柱色谱,二氯甲烷-甲醇(15∶1)、石油醚-醋酸乙酯(4∶1)洗脱,TLC检查,收集主要流分浓缩后重结晶,用石油醚溶解后有白色絮状结晶生成,减压干燥得化合物2(99.8 mg);取另一半量的Fr. E洗脱组分,经硅胶柱色谱分离,再用制备液相色谱进一步纯化(YMC-Pack ODS-A C18柱,流动相为3%醋酸水溶液-乙腈),得化合物1(65.1 mg)。
2.2 抗肿瘤活性检测按文献方法[5]复苏HepG-2和HeLa细胞,常规培养。取对数生长期细胞,用含10%胎牛血清(FBS)的DMEM培养基配制1×105个/mL单细胞悬液,接种于96孔板中,置37 ℃、5% CO2培养箱培养至细胞贴壁后,加入不同浓度的化合物2,终浓度分别为108、81、54、22、16、10 μmol/L,设阳性对照(0.025 mg/mL 5-Fu注射液,天津金耀氨基酸有限公司,批号1405221)、阴性对照(含0.75%异丙基的DMEM培养基)、空白对照组(含10%FBS的DMEM培养基),复孔4个,继续培养48 h。吸去上清液,用含0.5 mg/mL MTT的无血清DMEM孵育3 h后,弃上清液,每孔加入150 μL DMSO,在酶标仪上于490 nm处检测吸光度(A)值。实验重复3次。按下列公式计算细胞生长抑制率。
抑制率=1-(A实验-A空白对照)/(A阴性对照-A空白对照)
3 结果 3.1 结构鉴定化合物1:白色针状晶体(甲醇),mp 292~294 ℃,[α]23D +12.1° (c 0.582, MeOH)。由HR-ESI-MS得到分子式为C30H48O3(m/z 455.261 5 [M-H]−,计算值455.352 5)。1H-NMR (600 MHz, DMSO-d6) δ: 4.61 (1H, brs, H-29a), 4.47 (1H, brs, H-29b), 3.19 (1H, dd, J = 11.4, 4.8 Hz, H-3α), 0.96 (3H, s, H-23), 0.75 (3H, s, H-24), 0.94 (3H, s, H-25), 0.82 (3H, s, H-26), 0.98 (3H, s, H-27), 1.69 (3H, s, H-30);13C-NMR (150MHz, DMSO-d6) 数据见表 1。以上数据与文献报道一致[4],故鉴定化合物1为白桦脂酸。
| 表 1 化合物1和2的1H-NMR(600 MHz)和13C-NMR(150 MHz)数据 (DMSO-d6) Table 1 1H-NMR (600 MHz) and 13C-NMR (150 MHz) data of compounds 1 and 2(DMSO-d6) |
化合物2:土黄色粉末状固体(甲醇),mp 205~208 ℃,[α]23D +14.3° (c 0.472, MeOH),由HR-ESI- MS得到分子式为C48H60O9(m/z 779.417 3 [M-H]−,计算值为779.415 9)。IR光谱显示分子含有羟基(3 450 cm−1)和羰基(1 732 cm−1)等官能团。13C-NMR谱数据显示该化合物有48个碳,由1H-NMR谱数据(表 1)显示的芳氢和烯氢质子信号δ 7.55 (2H, d, J = 7.7 Hz, H-2′, 6′), 6.80 (2H, d, J = 7.7 Hz, H-3′, 5′), 7.54 (1H, d, J = 16.1 Hz, H-α), 6.30 (1H, d, J = 16.1 Hz, H-β), 7.55 (2H, d, J = 7.7 Hz, H-2″, 6″), 6.80 (2H, d, J = 7.7 Hz, H-3″, 5″), 7.54 (1H, d, J = 15.8 Hz, H-α′), 6.38 (1H, d, J = 15.8 Hz, H-β′) 以及13C-NMR谱中的18个sp2杂化碳吸收信号,可以推测存在2个苯丙烯酸基,再根据化学位移值δ 159.8和159.6,推测苯环的对位可能各有1个OH取代,可知化合物2中含有2个对羟基肉桂酰氧基结构单元[6];再由H-α和H-β的耦合常数J = 16.1 Hz与H-α′和H-β′的耦合常数J = 15.8 Hz可知2个对羟基肉桂酰氧基结构单元中双键的构型均为反式[7]。13C-NMR谱中余下的30个碳信号包括6×CH3、11×CH2、6×CH、7×C,且出现δ 177.2 (C) 以及δ 150.0 (C), 109.7 (CH2) 和19.0 (CH3) 等白桦脂酸型三萜的特征峰,可确定化合物2为白桦脂酸衍生物。通过和白桦脂酸的结构对比可看出,C-2和C-27位的化学位移变为δ 72.2 (d) 和62.1 (t),表明C-2位和C-27位有氧取代。在HMBC谱中(图 1),可见H-2和C-3、C-γ相关,H-3和C-23、C-24相关,H-27和C-8、C-13、C-γ′相关,H-29和C-19相关,H-30和C-19、C-29相关,则确定2个对羟基肉桂酰氧基结构单元连接在C-2位和C-27位。由H-2和H-3的耦合常数J = 5.5 Hz和13C-NMR谱数据δ 72.2 (C-2) 和78.1 (C-3),说明H-2的构型为β型,则推测化合物2为2α,27-二反式对羟基肉桂酰氧基取代的白桦脂酸。化合物2的1H-NMR谱数据:δ 4.90 (1H, m, H-2), 3.09 (1H, dd, J = 5.5, 5.5 Hz, H-3), 2.96 (1H, m, H-19), 4.51 (1H, d, J = 12.8 Hz, H-27), 4.47 (1H, d, J = 12.8 Hz, H-27), 4.70 (1H, brs, H-29), 4.58 (1H, brs, H-29), 0.73 (3H, s, H-23), 0.91 (3H, s, H-24), 0.92 (3H, s, H-25), 0.92 (3H, s, H-26), 1.69 (3H, s, H-30) 验证了上述推论。化合物2的结构见图 1。
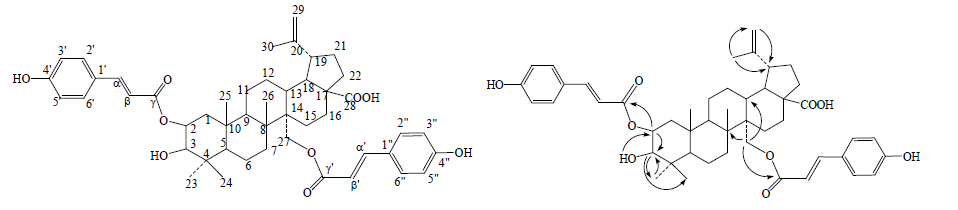 | 图 1 化合物2的结构及主要HMBC相关Fig.1 Structures and key HMBC correlation of compound 2 |
对HepG-2和HeLa细胞的MTT实验结果表明(图 2),化合物2有一定的抗肿瘤活性。其对人肝癌HepG-2细胞和人宫颈癌HeLa细胞的IC50分别为20.34和14.83 μmol/L。
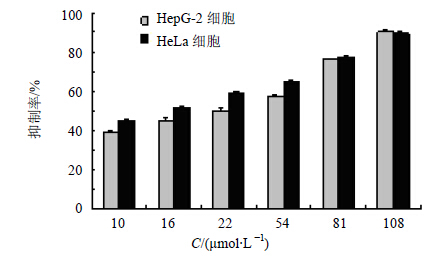 | 图 2 不同浓度化合物2对HepG-2和HeLa细胞增殖的抑制率Fig.2 Inhibition of compound 2 at different concentration on proliferation of HepG-2 and HeLa cells |
化合物1(白桦脂酸)为抗肿瘤的有效活性单体,可选择性地抑制黑色素瘤细胞的生长,主要作用机制是诱导细胞凋亡,其对HIV-1型感染也有抑制作用,另外近期的研究表明白桦脂酸对肿瘤细胞具有广谱性的细胞毒性,如对成神经细胞瘤、神经胶质瘤、恶性脑瘤、卵巢癌、宫颈癌、肺癌等恶性肿瘤以及已经对阿霉素产生抗性的肿瘤细胞都表现出很好的活性,而对正常细胞基本没有损伤[8, 9, 10, 11]。化合物2是属于白桦脂酸型的五环三萜类化合物,其也具有一定的抗肿瘤活性。本课题组在实验中发现马甲子醇提物的抗肿瘤活性要大于化合物1和化合物2单独作用时的抗肿瘤活性,推断两者可能存在协同作用。马甲子中有效成分的抗肿瘤作用及其机制值得进一步研究。
| [1] | 丁磊, 张东明. 铁篱笆果化学成分研究[J]. 中国中药杂志, 2006, 31(24):2049-2051. |
| [2] | 韦国峰, 覃道光, 黄志文. 马甲子镇咳祛痰作用及化学成分的提取分离[J]. 右江民族医学学报, 1998, 20(2):1-3. |
| [3] | 刘展眉, 何沽萍, 钟雪莲. 用清洁方法从洗树果中提取白桦脂酸等有效成分[J]. 环境科学与技术, 2008, 31(1):139-141. |
| [4] | 李万华, 李琴, 栗巧云. 皂角刺中5个白桦脂酸型三萜的分离及抗菌[J]. 西北大学学报, 2008, 38(6):937-942. |
| [5] | 司徒镇强, 吴军正. 细胞培养[M]. 西安:世界图书出版公司, 2007. |
| [6] | 吴立军, 相婷, 刘铁汉, 等. 3β-反式对羟基肉桂酰氧基-2α-羟基齐墩果酸的NMR研究[J]. 中草药, 1998, 29(6):367-369. |
| [7] | 刘江, 王海峰, 曲佳琳, 等. 甘茶花的化学成分研究[J]. 中草药, 2014, 45(3):208-313. |
| [8] | 徐军, 杨晋萍, 钱辰旭. 白桦脂酸的研究进展[J]. 生命科学, 2011, 23(5):503-510. |
| [9] | Xu T, Pang Q Y, Zhou D, et al. Proteomic Investigation into betulinic acid-induced apoptosis of human cervical cancer HeLa cells[J]. PLoS One, 2014, 9(8):1-11. |
| [10] | 张园, 张信文, 陈光英. 五环三萜类化合物抗肿瘤作用的研究进展[J]. 海南师范大学学报:自然科学版, 2011, 24(1):92-95. |
| [11] | 李万华, 李琴, 王小刚, 等. 皂角刺中五个白桦脂酸型三萜抗HIV活性研究[J]. 西北大学学报, 2007, 37(3):401-403. |
 2015, Vol. 46
2015, Vol. 46


