2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
白附子为天南星科犁头尖属植物独角莲Typhonium giganteum Engl. 的干燥块茎,又名禹白附、奶白附、鸡心白附;其味辛,性温,有毒;归胃、肝经;有祛风痰、定惊搐、解毒散结、止痛之功效。白附子内服治疗中风痰壅、口眼歪斜、语言謇涩、痰厥头痛、偏正头痛、惊风癫痫、破伤风;外用可治瘰疠痰核、毒蛇咬伤。其主产于河南、陕西、四川、湖北等地,以河南禹州产者为道地药材。白附子生品一般外用,制品多为内服。本文通过对国内外文献研究与分析,对白附子的本草考证及药典沿革、化学成分、药理毒理作用、炮制工艺、质量控制等方面进行了较全面的综述,为合理开发白附子药用价值提供参考。
1 本草考证及药典沿革白附子始载于《名医别录》,列为下品。《唐本草》云:“此物,本出高丽,今出凉州,巴西,形似天雄”。《海药本草》:“苗与附子相似”。《本草纲目》谓:“白附子乃阳明经药,因与附子相似故得此名。根正如草乌头之大小者,长寸许,干者皱皮有节”。清代《本草从新》谓:“根如草乌之小者,皱纹有节,炮用。”显然,自唐代到清代期间药用白附子是以毛茛科的黄花乌头即关白附为主流[1]。而由明•李中立《本草原始》附图所示根形呈长方形或长卵形,中部稍缢缩,形如蚕茧,具环纹,并图注“色白”,此似为今药材禹白附;且今河南为此主产地,最早使用并为河南杞县的李中立所录。
由以上考证可知明末将今药材禹白附、关白附并称白附子入药[2]。从功效上看,关白附和禹白附都有长期临床应用历史,都具有本草所说白附子疗效,功效略有异同。关白附因含次乌头碱,毒性较大,又甚燥烈,功偏祛寒湿、止疼痛,适用于中风偏正头痛、风湿痹、中风口眼歪斜等;禹白附祛风痰、熄风止痉功能强,适用于破伤风抽搐及中风痰壅,半身不遂之证[3]。20世纪50年代《中药志》收录的白附子为天南星科植物独角莲的干燥块茎。《中国药典》1963年版关白附、禹白附单独列出,《中国药典》1977年版收录白附子,且白附子药名下加用括弧标出禹白附,同时又另外列有“关白附”,而《中国药典》1985年版白附子药名下仍加用括弧标出禹白附,关白附不再收录。之后历版药典只单列白附子,不再加用括弧标出禹白附。综上所述,禹白附逐渐取代关白附作为白附子正品成为主流。
2 化学成分 2.1 苷类化合物陈雪松[4]从白附子的乙醇提取物中分离鉴定出23个化合物,其中10个为首次从犁头尖属植物中发现的脑苷类化合物(1~10),4种为新化合物,分别命名为白附子脑苷A(1)、白附子脑苷B(2)、白附子脑苷C(3)、白附子脑苷D(4)。白附子中其他苷类化合物有芸苔甾醇苷(11)、胡萝卜苷(12)、松柏苷(13)、乙基松柏苷(14)、松脂素- 4-O-β-D-葡萄糖苷(15)、棕榈酰半乳糖甘油酯(16)、胡萝卜苷-6′-O-棕榈酸酯(17)等[4, 5, 6, 7]。近年来,从白附子中分离得到的苷类成分结构见表 1和图 1。
| 表 1 白附子中苷类化学成分 Table 1 Glycosides from Typhonii Rhizoma |
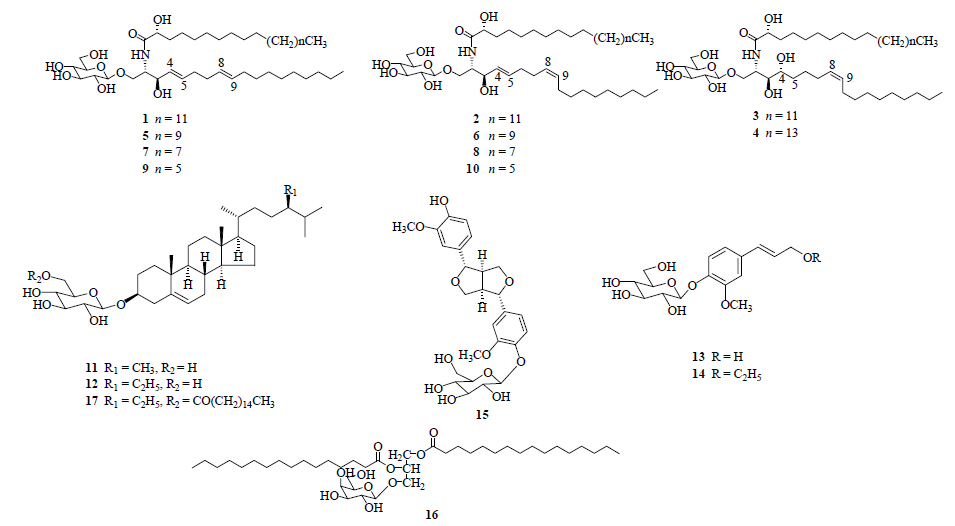 | 图 1 白附子中苷类化学成分的结构Fig.1 Structures of glycosides from Typhonii Rhizoma |
李娟等[8]通过GC-MS从独角莲块茎中分离出7种脂肪酸:辛烷酸、7-十六碳烯酸、十六烷酸、9,12-十八碳二烯酸、十八烷酸、十六烷二酸、10,13-二十碳二烯酸。陈雪松[4]从白附子的低极性部位分离出天师酸、桂皮酸、琥珀酸等。白附子还含有油酸、亚油酸等有机酸,以及亚麻脂、甘油脂等多种脂类。
2.3 挥发油成分李静等[9]用水蒸气蒸馏法从白附子鲜品中提取挥发油,并通过GC-MS分离鉴定出31种挥发油成分,其中脂肪族化合物占12.52%,芳香族占13.83%,倍半萜类仅0.65%,且有毒的含氮化合物N-苯基-苯胺量最高,占总量的47.35%,认为挥发油可能是其毒性成分。彭广等[10]从独角莲块茎微粉中分离鉴定出31个化合物,其中相对质量分数大于2.0%的化合物分别确定为己醛、2-庚醇、1-辛烯-3-醇、樟脑、2-正戊基呋喃、菲、异丁基邻苯二酸酯、乙酸龙脑酯、3,8-二甲基-5-(1-甲基亚乙基)-1,2,3,4,5,6,7,8-八氢薁-6-酮、芫妥醇。除己醛和壬醛外其余29个挥发性成分均为首次从该植物中得到。张婷婷等[11]从白附子生品中共分离鉴定出43个化合物,从制品中共分离鉴定出34个化合物;其中共有成分15个;且生品和制品中的主要成分、量的差异明显;不同条件放置后生品、制品的挥发油成分发生明显变化。
2.4 微量元素毛淑杰[12]在独角莲块茎中共测定了15种元素,其中宏量元素K、Na、Ca、Mg、P 5种,人体必需元素Fe、Cu、Mn、Mo、Sn、Sr 6种。经过炮制后独角莲的微量元素的量均有变化,其中Mg、Mn量减少,Al、Fe、Sr量增加,Fe的增加量最明显。独角莲中仅含一种有害元素Pb且量较低。孙淑芬等[13]对独角莲中6种元素的量进行测定,发现与抗癌药黄芩、鳖甲相比,独角莲Cu的量较低,Fe的量高于鳖甲低于黄芩,利于肿瘤治疗的Zn、Mn的量比黄芩和鳖甲多且Ca的量丰富。
2.5 其他成分孙启良等[14]采用氨基酸自动分析仪测定出独角莲块茎中除色氨酸、天冬酰胺、谷氨酰胺外,含有17种常见的氨基酸。从白附子分离出的化学成分还有尿苷、腺苷、2-氨基腺苷、尿嘧啶、肌苷、鸟苷、胸苷、次黄嘌呤、黄嘌呤、胆碱、核黄素(18)、烟酸、2,6-二氨基-9-β-D-呋喃核糖基嘌呤(19)、butyl- 2-(6-oxo-6,9-dihydro-1H-purin-2-ylamino) propanoate(20)以及蔗糖、白附子凝集素、草酸钙、α-棕榈精(21)、甘露醇、核糖醇、内消旋肌醇、β-谷甾醇(22)、β-谷甾醇-3-O-棕榈酸酯(23)、对乙酰氨基酚、(22E,4R)-麦角甾-5α,8α-环二氧-6,22-二烯-3β-醇(24)、环 (酪氨酰-亮氨酰)(25)、5-2′-甲基丙基乙内酰脲(26)、5-4′-羟基苄基乙内酰脲(27)、5-苄基乙内酰脲(28)、5-羟甲基糠醛、双 [5-甲酰基糠基] 醚、松脂素(29)、新橄榄脂素(30)、落叶松脂醇(31)等化合物[5, 6, 7, 15, 16, 17]。白附子中分离得到的其他成分结构见表 2和图 2。
| 表 2 白附子中其他化学成分 Table 2 Other chemical constituents from Typhonii Rhizoma |
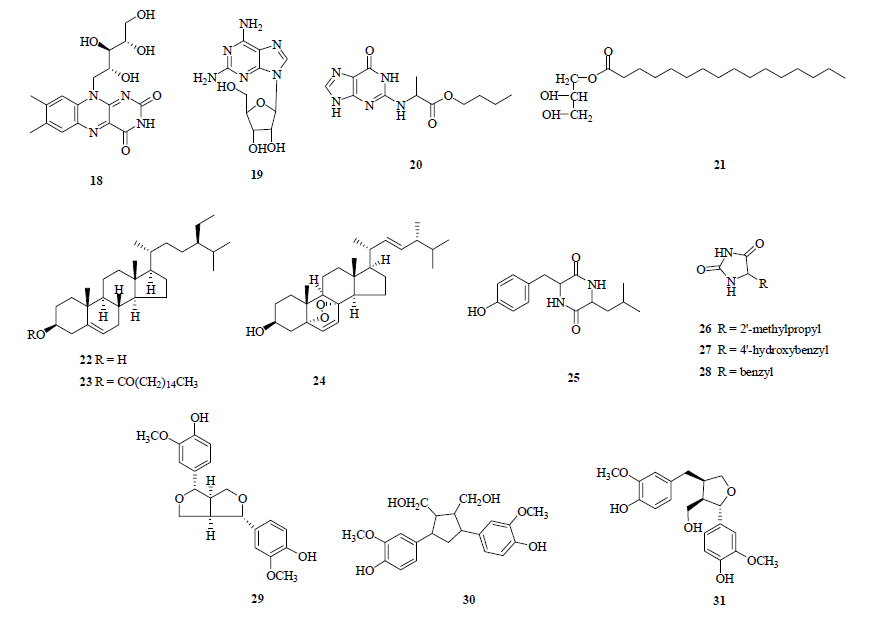 | 图 2 白附子中其他化学成分结构Fig.2 Structures of other chemical constituents from Typhonii Rhizoma |
研究表明白附子具有显著抗肿瘤活性,能够降低肿瘤细胞增殖率,减低肿瘤细胞的侵袭性,恢复机体免疫功能,对肿瘤细胞有细胞毒作用。孙淑芬等[18]研究表明白附子水煎剂对小鼠S180实体瘤有明显抑制作用,抑瘤率在30%以上,并且能够延长艾氏腹水癌荷瘤小鼠的生存期,显著增加荷瘤小鼠淋巴细胞转化率,增强免疫功能。王颖[19]研究发现白附子能够提高小鼠过氧化氢酶、超氧化物歧化酶(SOD)及核糖核酸酶活力,抑制机体产生有害的超氧阴离子羟自由基,从而阻止脂质过氧化物损害机体以达到抗肿瘤的目的。朱耀寰等[20]以肝癌腹水型细胞系HcaF25/CL16A3造模,研究表明白附子水煎剂可提高荷瘤小鼠脾指数,显著降低瘤质量,明显下调瘤组织p53基因的表达。梅蕾[21]也通过动物实验证实白附子混悬液可以通过调节肿瘤组织中突变型p53和PCNA基因的表达,从而引起肿瘤细胞凋亡,起到抗肿瘤的作用。王世强等[22]研究发现独角莲根茎水提物对HeLa、HL60、SPC、SHSY5Y细胞的生长具有抑制作用,且在一定浓度范围内具有时间和剂量依赖性。日本学者发现白附子水提物能在体外刺激人体淋巴细胞增生,增强细胞毒T淋巴细胞、免疫球蛋白(Ig)和白介素(IL)-1的活性,而不增强N细胞杀伤活性,可用于治疗癌症[23]。
3.2 抗炎和抑菌作用吴连英等[24]研究表明白附子对大鼠蛋清性酵母性关节肿及甲醛性关节肿具有明显或不同程度的抑制作用,且对棉球肉芽肿增生和渗出亦有明显的抑制作用,其抗炎作用与免疫器官胸腺、脾脏关系不大。吴国娟等[25]研究发现白附子水提物对奶牛乳房炎中的嗜热链球菌、乳房链球菌、产气荚膜梭菌表现中敏。蒋丹等[26]研究表明白附子醇提物对金黄色葡萄球菌、大肠杆菌、绿脓杆菌亦有明显的抑菌作用,其最低抑菌质量浓度为2.5 g/mL。
3.3 镇静、抗惊厥作用吴连英等[27]对白附子不同制品的镇静、抗惊厥作用进行比较,结果表明白附子水浸液口服给药未显示镇静作用,ip给药则表现出明显的镇静作用,且有明显的协同戊巴比妥钠催眠的作用,生品与不同制品之间未表现出差异性;用白附子水浸液治疗戊四唑硝酸士的宁导致的小鼠强直性惊厥虽能够推迟小鼠的惊厥出现时间和死亡时间,但未能减少惊厥和死亡小鼠数量。不论生品还是炮制品均未见有对咖啡因导致的惊厥有效。
3.4 免疫调节作用单保恩等[28]研究发现白附子水提取物可显著刺激小鼠脾和人淋巴细胞增殖,增强其功能如T细胞的细胞毒活性和NK细胞活性,刺激单核细胞产生细胞因子如肿瘤坏死因子和IL-1等,并增强单核细胞对肿瘤细胞的吞噬功能,其有效成分为糖蛋白,说明其临床可用于调节免疫功能和治疗肿瘤等疾病。孙文平等[29]以制白附子水溶性多糖为抗原,给予小鼠免疫刺激,结果表明白附子水溶性多糖能刺激小鼠产生特异性IgG类抗体及非特异性交叉抗体,说明白附子多糖是非特异广谱免疫调节剂。
3.5 美容作用白附子常作为中药复方的主药治疗黄褐斑等色素增加性皮肤病[30]。雷铁池等[31]研究表明白附子乙醇提取物对酪氨酸酶活性和黑色素生成量呈剂量依赖性抑制,且对前者的抑制率与熊果苷无统计学差异。穆燕等[32]研究表明20%乙醇粗提物对酪氨酸酶活性的抑制作用最强,抑制率可达到96.35%。
3.6 祛痰白附子被中医列为止咳化痰药,据报道,给小鼠ip制白附子提取物各40、60 g/kg,对小鼠均有显著祛痰作用。作用机制可能是由于其所含皂苷能刺激胃黏膜或咽喉黏膜,反射性地引起轻度恶心,促进呼吸道腺体分泌增加,从而稀释痰液,便于咯出,发挥祛痰作用[33]。
3.7 其他作用刘洁等[34]通过比较生、制白附子对胰蛋白酶活性作用的研究,发现白附子生、制品对胰蛋白酶均有不同程度的抑制作用。Gao等[35]研究发现白附子脑苷脂对小鼠肺动脉平滑肌Ca2+激活Cl−通道(CaCCs)的调节具有显著抑制作用,可作为研究CaCCs功能的工具药。过量的谷氨酸释放以及随后的N-甲基-D-天门冬氨基酸受体(NMDAR)Ca2+内流是导致中风后神经细胞退化和死亡的主要病理因素。Zhang等[36]研究表明白附子脑苷脂可酰化BKCa通道的STREX域,从而激活BKCa通道,抑制谷氨酸的释放,因此,白附子脑苷脂可开发为治疗缺血性脑卒中药物。刘先琼等[37]研究发现白附子凝集素具有促炎作用。此外,白附子还有降胆固醇、促血球凝集、溶血、催吐、止痛、抗氧化、抗HIV病毒、抗破伤风毒素等作用。
4 毒性研究白附子临床中毒表现为口咽及胃肠道刺激症状,四肢发麻、头晕心慌、视物模糊、出汗、面色苍白甚至意识丧失,曾有服用30 g生白附子中毒致死的报道[38]。动物实验表明白附子的毒性作用主要表现为对眼结膜、胃黏膜及皮肤的局部刺激作用。孙力等[39]研究发现生白附子混悬液ig给药具有毒性作用,且随给药剂量的增大和给药时间的延长其毒性明显增大,其半数致死量为3 430.0 mg/kg,主要致死原因初步认为是消化道毒副作用,以胃肠胀气为主要表现,且部分肠管液化黏连,腹部皮肤呈淡绿色。朱涛等[40]研究发现白附子中所含的草酸钙针晶为其主要刺激性毒性成分。葛秀允[41]、刘先琼等[42]研究也表明白附子针晶具有很强的刺激性毒性,该针晶锐利的针尖、凹槽及倒刺结构是其刺激性的物质基础;毒针晶蛋白,尤其是白附子毒针晶中含有的白附子凝集素蛋白,能够增强白附子的刺激性毒性。此外,吴连英等[43]给予小鼠ip 15 g/kg白附子生品冷浸液(相当于口服用量125倍),发现可引起半数以上小鼠死亡。综上所述,白附子中毒性成分可能为毒针晶及其蛋白或其他未知毒性成分。
5 炮制研究 5.1 炮制沿革和减毒技术研究白附子有小毒,中医临床内服多以炮制品入药。白附子的炮制方法始载于宋代《太平圣惠方》,历代炮制方法有姜制、矾制、姜矾煮制、矾姜豆腐制、矾姜黑豆甘草制、矾皂角黑豆制及矾皂角甘草制等[44]。现今的炮制方法中,矾制、姜矾煮制沿用最广。《中国药典》2010年版收载白附子姜矾煮制法。近年超微粉碎广泛用于中药材,程立平等[45]研究表明白附子超微粉碎药材能够明显减轻白附子刺激性且原成分基本保存不变。李先瑞等[46]采用小鼠急性毒性、兔眼结膜刺激、镇静等动物实验,比较了白附子生品、药典法炮制品、超微粉碎制品的药理作用,结果发现不同样品的毒性、刺激性由强到弱为白附子生品>药典法炮制品>超微粉碎制品,超微粉碎制品药效作用与生品、药典法炮制品基本一致。肖碧英等[47]进一步研究表明超微粉碎使白附子粉末中草酸钙针晶碎断,数目减少。超微粉碎粉末草酸钙针晶碎片较常规粉碎粉可减少1/8~1/2。扫描电镜观察超微粉碎白附子的草酸钙针晶晶体出现纵向断裂,晶体呈扁的长方体,见不到草酸钙针晶圆柱体和针尖。以上实验表明,通过超微粉碎技术可破坏白附子针晶引起刺激性的特殊结构,从而大大降低其毒性。
5.2 炮制对化学成分的影响白附子炮制后其化学成分有一定程度的变化,且不同的炮制方法对化学成分量的变化影响亦不同。炮制对白附子水溶性成分有一定的影响,而对脂溶性成分影响不明显。王毅等[48]对白附子不同制品中铝离子进行测定,表明不同制品中的铝离子基本产生于炮制过程。铝离子具有一定的毒性,容易在大脑中蓄积,应该对其量加以控制或采用其他新技术如超微粉碎技术避免外源性铝离子的引入。
6 质量控制研究白附子是《中国药典》收载品种,《中国药典》2010年版一部增加了白附子饮片的质量标准,但是标准尚无定量测定项。以β-谷甾醇作为对照品鉴别药材,β-谷甾醇广泛存在于很多植物中,应选择专属性强的化合物或者是多指标成分对白附子进行质量控制。
6.1 鉴别在定性鉴别方面,性状鉴定、显微特征及TLC鉴定作为法定方法依然占据主导地位。近年来,张红伟[49]采用紫外谱线组法比较了白附子生、制品不同溶剂部位紫外图谱峰位及峰值的变化,结果表明紫外谱线组法可用于鉴别白附子生品与制品。在指纹图谱鉴别研究方面,王媛等[50]采用HPLC对比分析不同产地、不同来源、不同规格、不同储存年限的白附子样品,确定了白附子的指纹图谱,结果表明不同贮存年限的样品指纹图谱具有明显的差异,贮存时间长甚至虫蛀样品的7个特征峰不明显甚至消失,说明样品有机酸的量随着时间延长而降低。不同规格、不同农户栽培的白附子之间无明显的差异,以个大椭圆型质量最佳,7个特征峰最明显,峰面积最大。该指纹图谱可代表白附子的指纹特征,可区别不同贮存年限的样品,可用于白附子的鉴别。
6.2 定量分析蔡中琴等[51]建立了白附子中桂皮酸的RP-HPLC测定方法,测定不同产地、不同采收期白附子药材中桂皮酸的量。张振凌等[52]采用HPLC测定白附子桂皮酸的量,比较炮制前后白附子中桂皮酸量的变化,为白附子饮片质量标准的制定提供了参考。刘博等[53]建立了HPLC测定白附子中草酸钙针晶的方法,为白附子中刺激性毒性物质草酸钙针晶的定量和控制奠定了基础。
7 结语白附子具有悠久的民间用药历史,广泛用于治疗恶疮、无名肿毒等症,且疗效显著。现阶段,有关白附子化学成分的提取、分离鉴定及药理作用的研究颇多,但对其药效、药理作用和毒性与化学成分关系,以及炮制后药理作用与成分变化的关系尚不明确。此外,白附子的药理作用研究仅限于水提物或醇提物,故有必要采用活性、毒性跟踪的技术手段,结合现代分离分析技术确定白附子的活性、毒性物质基础,由此建立有效剂量、有毒剂量等质量控制标准,为白附子临床应用提供指导。
| [1] | 谢宗万. 论中药品种在历代本草中的变迁与发展[J]. 中医杂志, 1985(6):72-75. |
| [2] | 王玠, 谢宗万, 章国镇. 《本草原始》八种药物的考证[J]. 中药材, 1990, 13(5):40-42. |
| [3] | 韩飞, 韩亮, 陈学忠. 白附子的来源及功用商榷[J]. 四川中医, 1996, 14(7):16. |
| [4] | 陈雪松. 中药白附子和娑罗子的化学成分研究及白附子脑苷A的全合成[D]. 北京:中国协和医科大学, 2002. |
| [5] | 艾凤伟, 张嵩, 李艳凤, 等. 白附子的化学成分研究[J]. 中草药, 2010, 41(2):201-203. |
| [6] | 吴荻, 董雷, 尹建元, 等. 禹白附抗肿瘤活性成分研究(II)[J]. 特产研究, 2012(3):52-53. |
| [7] | 柳开文, 濮社班, 徐德然, 等. 白附子的化学成分研究[A]//全国第9届天然药物资源学术研讨会[C]. 广州:中国自然资源学会天然药物资源专业委员会, 2010. |
| [8] | 李娟, 李静, 卫永第. 独角莲块茎花中脂肪酸成分分析[J]. 人参研究, 1997(1):38-39. |
| [9] | 李静, 卫永第, 陈玮, 等. 独角莲块茎挥发油化学成分的研究[J]. 吉林农业大学学报, 1996, 18(2):32-34. |
| [10] | 彭广, 刘建华, 汪凯莎, 等. 独角莲微粉挥发性成分研究[J]. 天然产物研究与开发, 2010, 22(6):1045-1047. |
| [11] | 张婷婷, 陈晓珍, 罗应刚. 禹白附生品和制品挥发油成分及稳定性[J]. 中国中药杂志, 2011, 36(10):1337-1341. |
| [12] | 毛淑杰. 白附子生品及炮制品微量元素的含量测定[J]. 中药饮片, 1991(2):30-31. |
| [13] | 孙淑芬, 曾艳, 秦岩, 等. 独角莲中6种元素测定[J]. 微量元素与健康研究, 1998, 15(2):82. |
| [14] | 孙启良, 卫永第, 杨伟超. 独角莲各部位氨基酸的含量分析[J]. 白求恩医科大学学报, 1995, 21(4):364-365. |
| [15] | Chen X S, Chen D H, Si J Y, et al. Chemical constituents of Typhonium giganteum Engl.[J]. J Asian Nat Prod Res, 2001, 3(4):277-283. |
| [16] | 石宝俊, 姜洪芳, 赵伯涛, 等. 独角莲水溶性成分研究[J]. 中国野生植物资源, 2010, 29(6):38-39. |
| [17] | 张红伟, 张振凌, 刘博. 白附子炮制后新增成分的分离和结构鉴定[J]. 时珍国医国药, 2010, 21(5):1197-1198. |
| [18] | 孙淑芬, 曾艳, 赵维诚. 独角莲抑制恶性肿瘤的实验研究[J]. 中医研究, 1998, 11(6):10-12. |
| [19] | 王颖. 白附子抗肿瘤活性及机理研究[D]. 长春:吉林大学, 2002. |
| [20] | 朱耀寰, 迟相林. 白附子抗肿瘤作用研究[J]. 中药药理与临床, 2006, 22(3/4):122-123. |
| [21] | 梅蕾. 白附子对荷瘤小鼠基因表达的影响及对环磷酰胺增效减毒作用的研究[D]. 哈尔滨:黑龙江中医药大学, 2008. |
| [22] | 王世强, 马丽红, 杨玉红, 等. 独角莲体外抗肿瘤实验研究[J]. 辽宁中医药大学学报, 2012, 14(3):218-221. |
| [23] | Shan B E, Yoshida Y, Suqiura T. Stimulating activity of Chinese medicinal herbs on human lymphocytes in vitro[J]. Int J Immunopharmacol, 1999, 21(3):149-159. |
| [24] | 吴连英, 仝燕, 毛淑杰, 等. 白附子不同炮制品抗炎作用比较研究[J]. 中国中药杂志, 1992, 17(6):339-342. |
| [25] | 吴国娟, 张中文, 李焕荣, 等. 中草药对奶牛乳房炎6种致病菌的抑菌效果观察[J]. 北京农学院学报, 2003, 18(3):195-198. |
| [26] | 蒋丹, 王关林. 22种中草药抑菌活性的研究[J]. 辽宁高职学报, 2003, 5(4):140-141. |
| [27] | 吴连英, 毛淑杰, 程丽萍, 等. 白附子不同炮制品镇静、抗惊厥作用比较研究[J]. 中国中药杂志, 1992, 17(5):275-278. |
| [28] | 单保恩, 张金艳, 李巧霞, 等. 白附子对人T细胞和单核细胞的调节活性[J]. 中国中西医结合杂志, 2001, 21(10):768-772. |
| [29] | 孙文平, 李发胜, 侯殿东, 等. 当归、白术、制白附子多糖对小鼠免疫调节作用的影响[J]. 中国中医药信息杂志, 2008, 15(7):37-38. |
| [30] | 翁丽丽. 中医治疗黄褐斑研究进展[J]. 中华中医药杂志, 2005, 20(12):741-743. |
| [31] | 雷铁池, 朱文元, 夏名玉, 等. 中药对黑色素生物合成的影响研究[J]. 中草药, 1999, 30(5):333-339. |
| [32] | 穆燕, 魏海柳, 李琳, 等. 白附子酪氨酸酶活性抑制成分的提取与分离[J]. 食品工业科技, 2012, 33(11):247-249. |
| [33] | 胡长效, 朱静, 孙晓静. 独角莲的化学成分及药理作用研究进展[J]. 农业与技术, 2007, 27(2):50-54. |
| [34] | 刘洁, 卢长庆, 王玥琦. 白附子炮制前后显微与化学比较[J]. 中成药, 1990, 12(2):18-19. |
| [35] | Gao S B, Wang C M, Chen X S, et al. Cerebrosides of baifuzi, a novel potential blocker of calcium-activated chloride channels in rat pulmonary artery smooth muscle cells[J]. Cell Biol Int, 2007, 31(9):908-915. |
| [36] | Zhang Y J, Zhou L, Zou J, et al. Palmitoylation of STREX domain confers cerebroside sensitivity to the BKCa channel[J]. Biochim Biophys Acta, 2014, 1838(10):2451-2459. |
| [37] | 刘先琼, 吴皓, 郁红礼, 等. 白附子凝集素的促炎作用及与居留细胞等的相关性研究[J]. 中华中医药杂志, 2012, 27(4):1011-1015. |
| [38] | 倪姗姗, 戚其华, 马慧慧, 等. 急性白附子中毒1例报道[J]. 中国民间疗法, 2014, 22(6):59. |
| [39] | 孙力, 胡艳文, 于晓红. 生白附子混悬液经口给药的急性毒性实验研究[J]. 中国中医药科技, 2010, 17(5):437. |
| [40] | 朱涛, 吴皓, 张琳, 等. 禹白附刺激性毒性成分的初步研究[J]. 南京中医药大学学报, 2008, 24(2):97-100. |
| [41] | 葛秀允. 天南星科有毒中药刺激性毒性成分及矾制解毒共性机制研究[D]. 南京:南京中医药大学, 2009. |
| [42] | 刘先琼, 吴皓, 郁红礼, 等. 禹白附凝集素的凝集活性及加热对刺激性作用的影响[J]. 南京中医药大学学报, 2012, 28(6):548-551. |
| [43] | 吴连英, 仝燕, 程丽萍, 等. 白附子不同炮制品毒性比较研究[J]. 中华中医药杂志, 1992, 7(1):13-15. |
| [44] | 李艳凤, 马英丽. 白附子炮制的历史沿革与现代研究进展[J]. 中医药学报, 2010, 38(4):105-106. |
| [45] | 程立平, 毛淑杰, 马志静, 等. 超微粉碎与常规粉碎白附子中成分比较[J]. 中国实验方剂学杂志, 2010, 16(5):15-18. |
| [46] | 李先端, 程立平, 仝燕, 等. 祛除白附子麻辣刺激性新技术——超微粉碎[J]. 中国实验方剂学杂志, 2008, 14(9):26-29. |
| [47] | 肖碧英, 李先端, 格小光, 等. 超微粉碎对白附子中草酸钙针晶形态和数量的影响[J]. 时珍国医国药, 2011, 22(1):84-85. |
| [48] | 王毅, 张静修. 制白附子饮片中铝含量的研究[J]. 中成药, 1992, 14(5):19-21. |
| [49] | 张红伟. 白附子炮制后新增化学成分的研究[D]. 郑州:河南中医药学院, 2009. |
| [50] | 王媛, 杨胜亚. 白附子的指纹图谱研究[J]. 中医研究, 2008, 21(3):27-30. |
| [51] | 蔡中琴, 王媛, 杨胜亚. 高效液相色谱法测定禹白附中桂皮酸的含量[J]. 中医研究, 2005, 18(12):13-16. |
| [52] | 张振凌, 杨振翔, 杨海玲, 等. 禹白附炮制前后桂皮酸含量比较[J]. 中药材, 2007, 30(2):141-143. |
| [53] | 刘博, 李凡, 张振凌. RP-HPLC法测定白附子趁鲜加工样品中草酸钙针晶的含量[J]. 中华中医药学刊, 2009, 27(6):1181-1183. |
 2015, Vol. 46
2015, Vol. 46


