雪胆属Hemsleya Cogn. 植物隶属葫芦目葫芦科(Cucurbitaceae),主产于亚洲亚热带至温带地区,2种产于印度东部及越南北部。我国全产,主要分布于西南部至中南部,浙江也有[1]。该属植物中富含三萜类化合物,具有清热解毒、抗菌消炎等多种功效,临床上用于治疗菌痢、肠炎、支气管炎及急性扁桃体炎等多种疾病[2]。近年来,国内外学者对雪胆属植物化学成分、药理活性和作用机制等方面进行了大量研究,并取得了较大的进展。本文对该属植物的相关研究进行综述,为开展该植物的研究提供参考。
1 雪胆属植物的分类该属植物为多年生攀援草本,根具膨大块茎,块茎扁卵圆形、稀圆柱状,常半裸于土面。吴征镒等[3]根据花、果实、种子及种子翅的形态特征,对1983年3月之前的雪胆属植物进行了系统的总结,将其分成了曲莲组(Sect. Amabiles C. Y. Wu)、肉花雪胆组(Sect. Carnosiflorae C. Y. Wu ex C. Y. Wu et C. L. Chen)、马铜铃组(Sect. Graciliflorae C. Y. Wu ex C. Y. Wu et C. L. Chen)和雪胆组(Sect. Hemsleya C. Y. Wu et C. L. Chen)4组,包括31种,6原变种,10变种。1992年,陈秀香等[4]发现一新种——弄岗雪胆H. longgangensis X. X. Chen et D. R. Liang sp. nov。1995年,薛祥骥等[5]发现一变种——天目山雪胆H. gracilliflora Cogn. var. tianmuensis X. J. Xue et H. Yao var. nov。由于此2种雪胆所具特征不能明显归入某组,故将其单独列出。雪胆属植物具体来源和分布见表1。
| 表1 我国雪胆属植物种类及资源分布 Table1 Species and distribution of Hemsleya Cogn. in China |
近30年来,国内外学者对雪胆属10余种植物进行了研究。目前发现的葫芦烷型四环三萜有50余种,其母核的C-16、25位有无乙酰基,C-23、24、25位之间有无双键,C-11位为羟基或是羰基等特点是区分该属植物母核的依据。其母核结构见图1,三萜类化合物见表2。
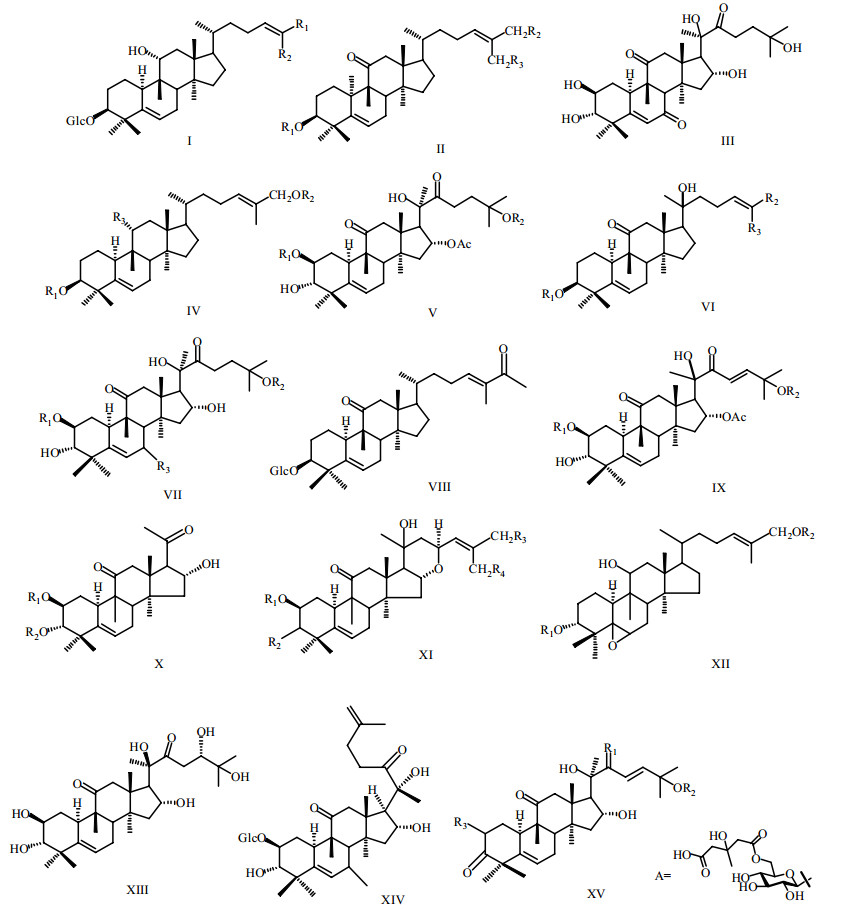 | 图1 葫芦烷型四环三萜母核 Fig.1 Nuclear parent of cucurbitane triterpenoids |
| 表2 雪胆属植物的葫芦烷型四环三萜及其皂苷 Table2 Cucurbitane-type triterpenoids and their saponins in plants from Hemsleya Cogn. |
据文献记载,雪胆属植物中发现的齐墩果烷型五环三萜类化合物约有20余种,母核较稳定,主要变化在C-3位和28位所连接的侧链,其母核结构见图2,雪胆属植物中墩果烷型五环三萜类化合物见表3。
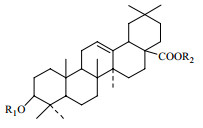 | 图2 齐墩果烷型五环三萜母核 Fig.2 Neclear parent of oleanane triterpenoids |
| 表3 雪胆属植物的齐墩果烷型五环三萜及其皂苷 Table3 Oleanane-type triterpenoids and their saponins in plants from Hemsleya Cogn. |
Chen等[19]从十一叶雪胆中分得endecaphyllacins A和B;2000年,Yang等[26]从曲莲中分离到amabiose,将该化合物用酸水解后得到1种新的单糖hemslose;1997年,Hano等[27]从椭圆果雪胆中分得ellipsoidone A和B;Lin等[28]从大果雪胆H. macrocarpa C. Y. Wu ex C. Y. Wu et C. L. Chen中分离出1种亚胺hemsleyin imine A。相关结构见图3。
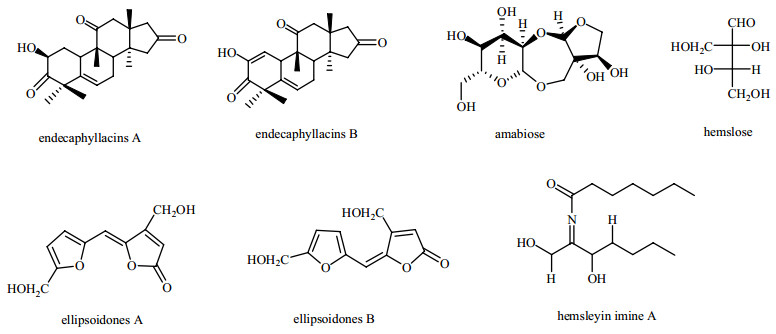 | 图3 雪胆属的其他类化合物 Fig.3 Other compounds from plants of Hemsleya Cogn. |
依照生源关系以及化学、波谱等方法可以确定三萜及其苷元的结构,一般通过Liebermann- Burchard和Molish反应可初步推测化合物是否为三萜皂苷类。总结这些化合物的13C-NMR谱可以确定其苷元类型,发现本属植物主要为葫芦烷型和齐墩果烷型三萜类化合物,而葫芦烷型三萜类化合物的基本骨架可认为是由羊毛脂烯Δ8进行质子化,在C-8位产生正碳离子,然后10-CH3转移到C-9位,H-9转移到C-8位而形成,有H-5β、H-8β、H-10α,C-9位连有β-CH3[29],C-2、C-3位一般为羟基或成苷,C-11位为羟基或羰基,C-25位有羟基或乙酰酯,C-26、C-27变化较大。当苷元结构为3β-hydroxy- cucurbit-5-ene及其衍生物时,至少含有3个糖基就会出现味道,当11α-OH时,化合物呈甜味,苷元侧链上双键氢化甜味降低;当11β-OH时没有味道;当C-11位连羰基时,为苦味,苷元上的双键氢化味道变甜[14]。
齐墩果烷型皂苷结构中大多含有C3-β-OH,其5个六元环中A/B、B/C、C/D环均为反式,D/E环多数是顺式排列即18β-H,但也有反式排列的情况[30]。
3.2 糖基连接位点的确定该属三萜皂苷的糖基主要是β-D-葡萄糖。利用苷化位移的原理,苷元与糖成苷后,苷元上的碳原子向低场位移δ 9~12,再根据HMBC谱上糖端基碳或质子与苷元上质子或碳信号的相关关系,可进一步确证糖的连接位置。葫芦烷型三萜皂苷成苷的位置主要在C-2位或C-3位,有时C-26、27位也可成苷,齐墩果烷型三萜皂苷的成苷位置主要在C-3位和C-28位的羧基。
4 生物活性 4.1 抗肿瘤2002年,Wu等[31]将雪胆95%乙醇提取物作用于包括人星形细胞瘤U87、乳腺癌细胞MDA- MB-231、白血病细胞在内的多种癌细胞,发现其不同浓度均可明显抑制肿瘤细胞的生长和聚集,低浓度下明显抑制人星形细胞瘤U87的扩散,并在一定程度上可诱导癌细胞的凋亡。
高申等[32]以不同浓度的雪胆甲素作用于人非小细胞肺癌A549细胞和小鼠原代培养的脾细胞,发现雪胆甲素对其增殖均有抑制作用,且呈浓度依赖性,25~100 μmol/L雪胆甲素对A549细胞的增殖抑制率明显高于脾细胞。推测作用机制可能为雪胆甲素将大部分A549细胞阻滞于G0/G1和S期,少部分细胞阻滞于G2和M期,并可促进细胞凋亡。
任帅等[33]研究雪胆素乙对人前列腺癌PC-3细胞增殖及细胞周期的影响,发现雪胆乙素浓度依赖性抑制PC-3细胞的增殖(P<0.05),浓度为20 μmol/L作用48 h时,使细胞周期阻滞于G2/M期,从溶剂对照组的(27.7±1.5)%上升为(45.3±1.8)%(P<0.01),相差显微镜下可见细胞发生明显皱缩;同样浓度作用24 h,使G肌动蛋白水平显著下降,F肌动蛋白发生严重聚集(P<0.05),而对微管只有轻微影响。与溶剂对照组相比,雪胆乙素20 μmol/L作用24 h后,细胞p21Cip1表达明显升高,周期蛋白A表达显著下调,其他周期蛋白表达上调(P<0.05)。因此,雪胆乙素抑制人前列腺癌PC-3细胞增殖的机制可能是通过诱导肌动蛋白聚集,破坏微丝骨架,促进抑癌因子p21Cip1表达,阻滞细胞周期的进程。
Boykin等[34]研究发现,雪胆甲素可以诱使丝状肌动蛋白不可逆聚集,增加G2/M期细胞数量,阻断细胞周期而引起细胞凋亡。此外,雪胆素甲既能降低磷酸化组蛋白H3的生成量,又能显著增强ADP核糖聚合酶的分裂。该研究进一步指出,雪胆甲素的抗癌机制是通过破坏肌动蛋白细胞骨架阻碍癌细胞扩散,通过抑制JAK/STAT3下游生存素的生成继而引发腺苷二磷酸核糖聚合酶(PARP)介导下的细胞凋亡。
4.2 抗菌消炎雪胆性寒、味苦,具有清热解毒、抗菌消炎、消肿止痛的功能。根据体外抗菌实验,从雪胆醇浸出物中提取的皂苷和雪胆素可抑制不同浓度的溶血性链球菌、金黄色葡萄球菌、福痢疾杆菌、大肠杆菌、伤寒杆菌等,较同浓度的氯霉素作用强[35]。Yi等[36]对从雪胆中提取的化合物进行抗菌机制研究,发现雪胆甲素是雪胆中主要的抗菌成分,作用机制可能是通过抑制葡萄球菌细胞壁的合成而发挥主要抑菌作用。
临床上将雪胆甲素和雪胆乙素混合制成雪胆素片,陈夏静等[37]通过实验发现该药对二甲苯所致的小鼠耳廓肿胀以及角叉菜胶所致的大鼠足趾肿胀有一定的抑制作用;对氨水致咳小鼠有明显的镇咳作用。
宛蕾等[38]通过实验发现雪胆提取物能使大鼠的3种实验性胃溃疡的溃疡面积缩小、溃疡指数降低,能够减少大鼠胃液分泌、降低胃酸度及胃蛋白酶活性。通过体外抗菌实验发现雪胆提取物对幽门螺杆菌等有较好的抑菌和杀菌作用,并且能够抑制二甲苯导致的小鼠耳廓肿胀,减少扭体次数。刘艳丽等[39]通过实验再次证明了雪胆治疗溃疡的效果,雪胆胃肠丸使无水乙醇所致小鼠胃溃疡的溃疡面积明显减小,降低了大鼠溃疡指数和醋酸致小鼠扭体反应的次数,并能抑制巴豆油致小鼠耳廓肿胀。
何健等[40]研究了雪胆甲素对脂多糖(LPS)活化的RAW264.7巨噬细胞增殖的影响,用相差显微镜观察雪胆甲素对LPS活化的细胞形态的影响,荧光显微镜观察雪胆甲素对细胞骨架的影响,流式细胞仪检测亚二倍体(凋亡)峰的变化,免疫印迹检测cleaved caspase-3、生存素以及G-actin与Factin的变化。结果表明雪胆甲素能明显抑制RAW264.7细胞的增殖,并呈时间和剂量依赖性,但不能单独有效诱导细胞凋亡。其作用机制可能是雪胆甲素引起actin聚集而破坏微丝细胞骨架,诱导LPS活化的RAW264.7细胞凋亡,从而发挥抗炎效应。王遥等[41]研究发现雪胆乙素对小鼠淋巴细胞的活化、增殖均具有明显抑制作用,并减少了炎症相关细胞因子的表达,推测其通过对适应性免疫进行调控而发挥抗炎效应。
4.3 抗HIV作用Chen等[19]实验发现葫芦素B对C8166细胞具有潜在的抗HIV-1活性(EC50=0.09 μg/mL),筛选指数为16.7。2012年,再次发现jinfushanoside G对C8166细胞(EC50=5.9 μg/mL)筛选指数为13.5[7]。
Tian等[42]用从金佛山雪胆中提取到的雪胆甲素和乙素进行抗HIV-1实验,HIV-1中产生的p24抗原感染C8166细胞,细胞与细胞间慢性HIV-1感染的H9细胞,正常的C8166细胞。同时,也检测了HIV-1逆转录酶、蛋白酶抑制以及NCp7锌离子逐出的影响。结果显示,雪胆甲素和雪胆乙素在体外抑制HIV-1所引起合胞体形成的EC50值分别为3.09、2.53 μg/mL,HIV-1中产生的p24抗原感染C8166细胞的EC50值为3.97、18.90 μg/mL,细胞间慢性感染的H9细胞和正常的C8166细胞的EC50值为1.76、11.95 μg/mL。此外,均未观察到雪胆甲素和雪胆乙素有对HIV-1逆转录酶、蛋白酶抑制以及NCp7锌离子逐出的影响。在共培养实验中,比较发现经过雪胆甲素和雪胆乙素预处理的C8166细胞比未处理组能更好地抑制HIV-1。并且推测雪胆甲素和雪胆乙素主要在HIV-1病毒侵入细胞阶段发挥作用。
5 展望雪胆属植物作为传统民族医药,近百年来应用于临床并显现出良好的效果,目前对其化学成分和药理作用的研究日臻成熟,葫芦素类成分显现出良好的抗肿瘤与抗炎作用,而不断发现的新雪胆素类化合物更显示出了抗HIV-1的活性。雪胆素作用机制的研究也不断加深,为其进一步的开发应用提供了非常有价值的实验数据与理论依据。今后,应进一步加深该属植物的研究,以便使其得到更好的开发与利用。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京: 科学出版社, 1986. |
| [2] | 中国药典[S]. 一部. 1977. |
| [3] | 吴征镒, 陈宗莲. 中国葫芦科植物志资料——雪胆属[J]. 植物分类学报, 1985, 23(2): 121-143. |
| [4] | 陈秀香, 梁仁定. 广西雪胆属药用植物一新种[J]. 云南植物研究, 1992, 14(1): 27-28. |
| [5] | 薛祥骥, 姚 红. 小花雪胆一新变种[J]. 植物分类学报, 1995, 33(2): 208. |
| [6] | Chen J C, Niu X M, Li Z R, et al. Four new cucurbitane glycosides from Hemsleya jinfushanensis[J]. Planta Med, 2005, 71(10): 983-986. |
| [7] | Chen J C, Zhou L, Wang Y H, et al. Cucurbitane triterpenoids from Hemsleya penxianensis[J]. Nat Prod Bioprospect, 2012, 2(4): 138-144. |
| [8] | Chiu M H, Gao J. Three new cucurbitacins from Hemsleya lijiangensis[J]. Chin Chem Lett, 2003, 14(4): 389-392. |
| [9] | 陈剑超, 张重权, 邱明华. 短柄雪胆块根的化学成分研究[J]. 化学学报, 2007, 6(16): 1679-1684. |
| [10] | 陈维新, 聂瑞麟, 陈毓群, 等. 圆果雪胆中雪胆甲素和雪胆乙素的结构[J]. 化学学报, 1975, 3(1): 49-56. |
| [11] | 芮和恺, 袁明耀, 余秋妹, 等. 雪胆甲素苷的化学结构[J]. 药学学报, 1981, 16(6): 445-447. |
| [12] | 芮和恺, 余秋妹, 何清英. 新化合物雪胆乙素苷[J]. 自然杂志, 1983, 7(3): 237-237. |
| [13] | Chen Y, Chiu M H, Gu K, et al. Cucurbitacin and trterpenoid glycosides from Hemsleya giganthy[J]. Chin Chem Lett, 2003, 14(5): 475-478. |
| [14] | Kasai R, Matsumoto K, Nie R L, et al. Glycosides from Chinese medicinal plant, Hemsleya panacis-scandens, and structure-taste relationship of cucurbitane glycosides[J]. Chem Pharm Bull, 1988, 36(1): 234-243. |
| [15] | Xu X T, Bai H, Zhou L, et al. Three new cucurbitane triterpenoids from Hemsleya penxianensis and their cytotoxic activities[J]. Biol Med Chem Lett, 2014, 24(9): 2159-2162. |
| [16] | Kubo H, Ohtani K, Kasai R, et al. Cucurbitane glycosides from Hemsleya panacis-scandens rhizomes[J]. Phytochemistry, 1996, 41(4): 1169-1174. |
| [17] | Chen X B, Chen G Y, Liu J H, et al. Cytotoxic cucurbitane triterpenoids isolated from the rhizomes of Hemsleya amabilis[J]. Fitoterapia, 2014, 94(3): 88-93. |
| [18] | Li Z J, Chen J C, Sun Y, et al. Three new triterpene saponins from Hemsleya ehinensis[J]. Helv Chim Acta, 2009, 92(9): 1853-1859. |
| [19] | Chen J C, Zhang G H, Zhang Z Q, et al. Octanorcucurbitane and cucurbitane triterpenoids from the tubers of Hemsleya endecaphylla with HIV-1 inhibitory activity[J]. J Nat Prod, 2008, 71(1): 153-155. |
| [20] | 陶朝阳, 易杨华, 林厚文, 等. 雪胆根抗肿瘤活性成分研究[J]. 第二军医大学学报, 1999, 2(5): 337-339. |
| [21] | 徐金中, 王贤亲, 黄可新, 等. 中华雪胆中的三萜皂苷类化学成分研究[J]. 中国药学杂志, 2009, 43(23): 1770-1773. |
| [22] | 杨培全, 施亚琴, 潘 勤, 等. 彭县雪胆的化学成分研究[J]. 中国中药杂志, 1995, 20(9): 551-553. |
| [23] | 施亚琴, 杨培全, 陈 玲, 等. 峨眉雪胆的化学成分研究[J]. 中草药, 1995, 26(12): 619-621. |
| [24] | 林玉萍, 邱明华, 李忠荣, 等. 古蔺雪胆中的新三萜皂苷 (英文)[J]. 云南植物研究, 2003, 25(2): 235-240. |
| [25] | 陈亚, 邱明华, 古 昆, 等. 巨花雪胆中的两个新化合物[J]. 云南植物研究, 2003, 25(5): 613-619. |
| [26] | Yang Y K, Chiu M H, Gao C W, et al. The novel structure of a disaccharide derivative from Hemsleya amabilis[J]. Tetrahedron, 2000, 56(38): 7433-7435. |
| [27] | Hano Y, Shi Y Q, Nomura T, et al. Two acetogenins from Hemsleya ellipsoidea[J]. Phytochemistry, 1997, 46(8): 1447-1449. |
| [28] | Lin Y P, Yan J, Qiu M H, et al. Novel imine from Hemsleya macrocarpa var. clavata[J]. Lipids, 2006, 41(1): 97-99. |
| [29] | Champagne D E, Koul O, Isman M B, et al. Biological activity of limonoids from the Rutales[J]. Phytochemistry, 1992, 31(2): 377-394. |
| [30] | Mahato S B, Kundu A P. 13C NMR spectra of pentacyclic triterpenoids-a compilation and some salient features[J]. Phytochemistry, 1994, 37(6): 1517-1575. |
| [31] | Wu J, Wu Y J, Yang B B. Anticancer activity of Hemsleya amabilis extract[J]. Life Sci, 2002, 71(1): 16-19. |
| [32] | 高 申, 于孟可, 魏佳慧, 等. 雪胆甲素对人非小细胞肺癌A549细胞增殖的抑制作[J]. 中国生物制品学杂志, 2012, 71(18): 2161-2170. |
| [33] | 任 帅, 徐丽慧, 曾龙辉, 等. 雪胆素乙通过破坏微丝结构及上调p21Cip1抑制前列腺癌PC-3细胞的增殖[J]. 中国药理学与毒理学杂志, 2012, 26(6): 1-7. |
| [34] | Boykin C, Zhang G, Chen Y H, et al. Cucurbitacin Ⅱa: a novel class of anti-cancer drug inducing non-reversible actin aggregation and inhibiting survivin independent of JAK2/STAT3 phosphorylation[J]. Br J Cancer, 2011, 104(5): 781-989. |
| [35] | 曾庆通, 黄永超. 雪胆的综合利用[J]. 药学通报, 1980, 15(5): 5-7. |
| [36] | Yi Z B, Yu Y, Liang Y Z. Investigation of antimicrobial model of Hemsleya pengxianensis W. J. Chang and its main active component by metabolomics technique[J]. J Ethnopharmacol, 2008, 116(1): 89-95. |
| [37] | 陈夏静, 伍怡颖, 匡文娟, 等. 雪胆素片抗炎镇咳作用的实验研究[J]. 四川生理科学杂志, 2009, 31(4): 153-154. |
| [38] | 宛 蕾, 覃仁安. 雪胆提取物对实验性胃溃疡作用的研究[J]. 中国中药杂志, 2003, 28(3): 266-268. |
| [39] | 刘艳丽, 李笑然, 范金胤, 等. 雪胆胃肠丸对胃溃疡的作用实验研究[J]. 时珍国医国药, 2010, 21(2): 301-302. |
| [40] | 何 健, 徐丽慧, 乔 静, 等. 雪胆素甲通过破坏微丝结构诱导LPS活化的RAW264. 7细胞凋亡[J]. 免疫学杂志, 2012, 28(7): 553-557. |
| [41] | 王 遥, 刘坤鹏, 宋方茗, 等. 雪胆素乙对小鼠淋巴细胞体外活化及增殖的影响[J]. 免疫学杂志, 2013, 29(3): 190-194. |
| [42] | Tian R R, Chen J C, Zhang G H, et al. Anti-HIV-1 activities of hemslecins A and B[J]. Chin J Nat Med, 2008, 6(3): 214-218. |
 2015, Vol. 46
2015, Vol. 46



