2. 哈尔滨商业大学 生命科学与环境科学研究中心, 黑龙江 哈尔滨 150076
2. Research Centre on Life Sciences and Environment Sciences, Harbin University of Commerce, Harbin 150076, China
动脉粥样硬化是一种以大量胆固醇聚集于动脉壁为主要特征的慢性疾病[1],是导致死亡的重要原因之一[2, 3]。泡沫细胞的形成是导致动脉粥样硬化的重要因素,在动脉粥样硬化的发生、发展过程中起到了关键作用[2, 4, 5, 6]。泡沫细胞的形成是由于胆固醇流入和流出失衡造成的,在诸多因素作用下,大量胆固醇通过胞吞作用(流入)进入细胞内,或者细胞内胆固醇流出受阻,造成过多胆固醇聚集于外周细胞中,尤其是巨噬细胞和内皮细胞,从而引起了泡沫细胞的形成和斑块的出现[7, 8]。因此,抑制胆固醇流入和促进胆固醇流出对抑制泡沫细胞形成具有重要意义。
胆固醇流出是胆固醇逆转运(reverse cholesterol transport,RCT)的第一步,也是其关键步骤[1, 7]。通过RCT,细胞中过多积累的胆固醇从动脉壁转运到肝脏,通过胆汁排出体外[9]。胆固醇流出的调控有很多蛋白参与,其中,ATP结合盒转运子A1(ATP-binding cassette A1,ABCA1)和ATP结合盒转运子G1(ABCG1)起到了关键作用。ABCA1和ABCG1均属于膜内蛋白,其功能是利用ATP提供能量将脂质或其他代谢物进行跨膜转运[10]。ABCA1和ABCG1均是由过氧化物增殖激活受体γ(PPARγ)/肝X受体α(LXRα)通路调控,所不同的是ABCA1是由PPARγ/LXRα通路单独调控,ABCG1是由PPARγ/LXRα通路部分调控[11]。除了胆固醇流出受阻,胆固醇流入过多也是造成细胞内脂质失衡的重要原因,在泡沫细胞形成过程中也起到了非常重要的作用。巨噬细胞中胆固醇流入主要是通过清道夫受体吞噬修饰了的低密度脂蛋白(LDL)[2],如氧化低密度脂蛋白(ox-LDL)。清道夫受体是一类跨膜糖蛋白受体,在介导ox-LDL流入中起到了重要作用[12]。其中清道夫受体A(scavenger receptors A,SR-A)和CD36介导的胆固醇流入占胆固醇流入总量的75%~90%[1,12],因此,具有调控胆固醇流动和抑制胆固醇积累的药物可能在治疗动脉粥样硬化方面具有显著作用。
表松脂醇是从露兜树Pandanus tectorius Soland. 中提取的具有2个酚羟基的木质素类化合物。目前,表松脂醇的研究大多处于化学方面[13, 14, 15],而对药理方面的研究较少。据报道,尼泊尔老鹤草Geranium nepalense Sweet提取物具有抗炎作用,表松脂醇是其中的成分之一[16]。总花灰莉Fagraea racemose Jack ex Wall. 提取物具有镇痛作用,也从中分离得到了表松脂醇[17]。然而其在抗动脉粥样硬化方面的研究还未见报道。本实验将对表松脂醇在抑制巨噬细胞泡沫化、促进胆固醇流出和抑制胆固醇流入方面的作用进行研究。
1 材料 1.1 主要试剂表松脂醇由本实验室从露兜树Pandanus tectorius Soland. 果实中提取制备,经HPLC分析质量分数>98.6%;洛伐他汀(批号100600-201003)、罗格列酮(批号100673-200401),中国食品药品检定研究院;25-NBD胆固醇、油红O和高糖培养基(DMEM)均购自Sigma公司;细胞内胆固醇测定试剂盒购自南京建成生物技术有限公司;人源ox-LDL、高密度脂蛋白(HDL)购自北京协生生物有限责任公司;总RNA提取、反转录及PCR试剂购自北京全式金生物技术有限公司。
1.2 主要仪器KC junior微孔板扫描酶标仪(美国Biotek公司);JY96-II细胞超声破碎仪(宁波新芝生物科技有限公司);Centri Vap Benchtop真空浓缩离心仪(美国Labconco公司);KQ-50E型超声波清洗器(昆山市超声仪器有限公司);Lsbofuge 400R高速冷冻离心机(德国Heraeus公司);快速PCR仪(美国Applied Biosystems Carl Zeiss Jena)。
2 方法 2.1 细胞培养和巨噬细胞泡沫化形成实验RAW264.7巨噬细胞(购自中国医学科学院基础医学研究所细胞资源中心)用DMEM培养基(含10%胎牛血清、1%青-链霉素合剂)培养于5% CO2、37 ℃的恒温培养箱中,待长到70%~80%时,对照组加入无血清培养基,模型组和其他给药组均加入含50 μg/mL ox-LDL的不完全培养基进行诱导,同时,洛伐他汀组加入10 μmol/L的洛伐他汀,罗格列酮组加入10 μmol/L罗格列酮,表松脂醇高、中、低剂量组分别加入10.0、1.0、0.1 μmol/L的表松脂醇,继续培养24 h,弃掉培养基,磷酸缓冲液(PBS)洗3遍,油红O染色后用酶标仪在358 nm处测定吸光度(A)值。细胞内胆固醇浓度按照试剂盒说明检测[18, 19]。
2.2 胆固醇流出实验RAW264.7巨噬细胞培养于96孔的酶标板上,接种浓度为每孔4×104个,6 h后弃掉培养基,换成含有25-NBD胆固醇(5 μg/mL)的无血清培养基继续培养,24 h后弃掉培养基,PBS洗2遍,加入含有相应浓度药物(分组及给药浓度同“2.1”项,不设洛伐他汀组)和HDL(50 μg/mL)的无血清培养基继续培养6 h,12 000 r/min离心10 min,取上清,用来检测培养基中胆固醇的量;沉淀的细胞PBS洗3次,用0.1% Triton-X100裂解细胞10 min,用酶标仪分别检测培养基中和细胞中的胆固醇的量(发射波长485 nm,吸收波长535 nm)。计算胆固醇流出率,实验重复3次。
胆固醇流出率=培养基中胆固醇的量/(培养基中胆固醇的量+细胞中胆固醇的量)
2.3 25-NBD胆固醇流入实验RAW264.7巨噬细胞接种于96孔酶标板上,每孔4×104个,6 h后弃掉培养基,用含有25-NBD胆固醇(5 μg/mL)和相应浓度药物(分组及给药浓度同“2.1”项,不设洛伐他汀和罗格列酮组)的无血清培养基继续培养,分别在1、2、3、4 h时取出细胞,12 000 r/min离心10 min,弃上清,用PBS洗3次,用0.1% Triton-X100裂解细胞10 min,用酶标仪检测细胞内胆固醇的量(发射波长485 nm,吸收波长535 nm),实验重复3次。
2.4 RT-PCR检测胆固醇流入、流出相关基因表达RAW264.7巨噬细胞培养于6孔板上,接种浓度为5×104/mL,每孔接种2 mL,待长到70%~80%时,模型组加入含50 μg/mL ox-LDL的不完全培养基进行诱导,同时,表松脂醇组加入50 μg/mL ox-LDL和10.0 μmol/L的表松脂醇,罗格列酮组加入50 μg/mL ox-LDL和10 μmol/L罗格列酮,继续培养24 h。总RNA提取、cDNA合成和PCR定量实验均按照文献方法进行[20]。使用ABI-7500检测器,PCR过程:95 ℃、5 min后有40个循环,条件是95 ℃、15 s,60 ℃、34 s,72 ℃、40 s。循环基线设定值(Ct值)为检测器软件默认值。每组有4个生物样本重复,每个生物样本有3个技术重复,RT-PCR特异性引物见表1。
| 表 1 RT-PCR所用引物 Table 1 Primers used in RT-PCR analysis |
实验结果以x±s表示,用SPSS 17.0进行单因素方差分析(One-way ANOVA)。
3 结果 3.1 表松脂醇抑制由ox-LDL诱导RAW264.7巨噬细胞泡沫化的形成泡沫细胞在动脉管壁上的积累是斑块出现和动脉粥样硬化发生的重要原因[9],因此,本实验首先评价了表松脂醇对ox-LDL诱导RAW264.7巨噬细胞胆固醇累积的抑制作用。结果表明ox-LDL能够显著增强RAW264.7巨噬细胞中胆固醇累积(P<0.01),细胞内脂滴数量明显增多,体积增大。不同浓度表松脂醇(10.0、1.0 μmol/L)均能显著降低RAW264.7巨噬细胞中的胆固醇堆积,尤以10.0 μmol/L效果最为显著。检测A值后发现,不同浓度表松脂醇均能够显著降低RAW264.7巨噬细胞因ox-LDL诱导产生的脂质堆积。经单因素方差分析后发现,10.0 μmol/L表松脂醇组作用效果与常用降胆固醇药物洛伐他汀和胆固醇流出激动剂罗格列酮相当(P>0.05)。表松脂醇能够显著抑制RAW264.7巨噬细胞中胆固醇的量,其中以10.0 μmol/L效果最佳。结果见图1。
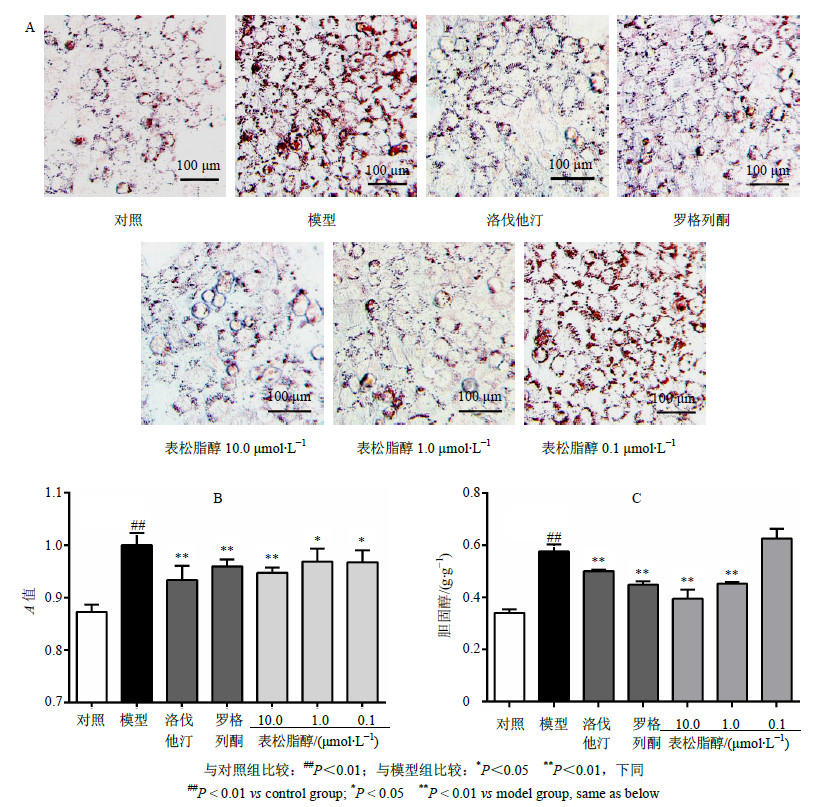 |
与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,下同 ##P < 0.01 vs control group; P < 0.05 **P < 0.01 vs model group, same as below 图 1 表松脂醇对RAW264.7巨噬细胞油红O染色后细胞形态 (A) 和A值 (B) 及细胞内胆固醇量 (C) 的影响(x±s,n=8)Fig.1 Effect of epipinoresinol on cell morphology (A), A values (B), and intracellular concentration of cholesterol (C) in RAW264.7 macrophages after oil-red O staining(x±s,n=8) |
如图2所示,阳性药罗格列酮能够显著增强HDL介导的胆固醇流出,10.0、1.0、0.1 μmol/L的表松脂醇均能够显著增强HDL介导的胆固醇流出,其中以10.0 μmol/L表松脂醇的作用效果最好,其作用比罗格列酮强(P<0.05),且显示出剂量依赖性。RT-PCR结果(图3)显示,表松脂醇能够显著增强基因PPARγ、LXRα、ABCA1和ABCG1的表达水平,其上调PPARγ、LXRα的作用强度与罗格列酮相当(P>0.05),而上调ABCA1和ABCG1的作用强度要强于罗格列酮(P<0.01)。其中,PPARγ升高了2.11倍,LXRα升高了4.21倍,ABCA1、ABCG1均升高了20倍以上。
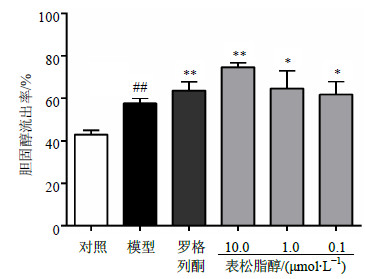 | 图 2 表松脂醇促进RAW264.7巨噬细胞胆固醇流出作用(x±s,n=8)Fig.2 Promotion of epipinoresinol on HDL-mediated cholesterol efflux from RAW264.7 macrophages(x±s,n=8) |
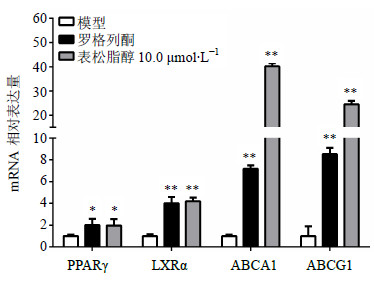 | 图 3 表松脂醇促进胆固醇流出相关基因表达(x±s,n=8)Fig.3 Promotion of epipinoresinol on cholesterol efflux- associated genes expression(x±s,n=8) |
如图4所示,2 h内,表松脂醇对RAW264.7巨噬细胞胆固醇摄入的抑制作用以1.0 μmol/L作用最好。2 h后表松脂醇能够显著抑制RAW264.7巨噬细胞对胆固醇的摄入,其作用效果稳定,1.0 μmol/L与10.0 μmol/L表松脂醇均具有抑制作用,且以1.0 μmol/L作用效果最强。清道夫受体SR-A1、SR-A2和CD36能够选择性地从HDL或细胞中摄入胆固醇[21, 22, 23],采用RT-PCR技术检测其表达情况,结果见图5,表松脂醇能够显著抑制SR-A1、SR-A2的表达,而对CD36表达没有抑制作用。
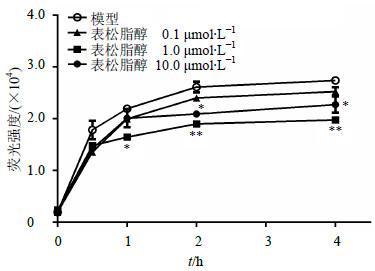 | 图 4 表松脂醇抑制胆固醇摄入(x±s,n=8)Fig.4 Inhibition of epipinoresinol on cholesterol uptake(x±s,n=8) |
 | 图 5 表松脂醇抑制胆固醇流入相关基因表达(x±s,n=4)Fig.5 Regulation of epipinoresinol on cholesterol influx-associated genes expression(x±s,n=4) |
动脉壁上泡沫细胞(含有大量胆固醇的巨噬细胞)累积是斑块形成和动脉粥样硬化出现的重要标志。因此,首先评价了表松脂醇对由ox-LDL诱导的RAW264.7巨噬细胞胆固醇累积的抑制作用。结果表明,ox-LDL(50 μg/mL)能够显著增强RAW264.7巨噬细胞中胆固醇累积,不同浓度表松脂醇均能显著降低RAW264.7巨噬细胞中的胆固醇累积,尤以10.0 μmol/L效果最好,其作用效果与洛伐他汀和罗格列酮相当。实验结果表明表松脂醇能够有效抑制由ox-LDL诱导的胆固醇累积,从而起到抑制泡沫细胞形成的作用。
促进巨噬细胞胆固醇流出很可能是表松脂醇抑制胆固醇累积的另一条途径。本实验结果表明不同浓度的表松脂醇均能够显著增强由HDL介导的RAW264.7巨噬细胞胆固醇流出,且具有剂量依赖性,其中以10.0 μmol/L作用效果最好,其作用强于罗格列酮。此结果与表松脂醇能够降低胆固醇积累和降低巨噬细胞中胆固醇的量的结果一致。因此,表松脂醇促进胆固醇流出,使得RAW264.7巨噬细胞中胆固醇的量降低、胆固醇累积情况得到改善,从而起到抑制泡沫细胞形成的作用。
巨噬细胞中胆固醇流出的调控是由很多基因共同作用的结果,其中ABCA1和ABCG1起到了关键作用[1]。ABCA1主要作用于将细胞内的胆固醇转运到细胞外的受体,如载脂蛋白A-1(apolipoprotein A-1,ApoA-1)[21]。ABCG1在巨噬细胞中高表达,其作用是促进胆固醇流出,并使之与HDL结合[21]。ABCA1和ABCG1均是由PPARγ-LXRα通路调控,其中两者不同的是ABCA1是由PPARγ-LXRα通路单独调控,而ABCG1是由PPARγ-LXRα通路部分调控[11, 21, 22]。RT-PCR结果显示,表松脂醇能够显著增强基因PPARγ、LXRα、ABCA1和ABCG1的表达水平。表明表松脂醇调节胆固醇流出的作用可能是通过上调PPARγ-LXRα-ABCA1/ABCG1通路实现的。然而有关胆固醇流出的其他通路及ABCG1的精确调控还有待于进一步研究。
泡沫细胞的形成通常是胆固醇流出受阻,或者是由于巨噬细胞大量吞噬胆固醇造成的。因此,也检测了表松脂醇对胆固醇摄入的影响。表松脂醇能够显著抑制RAW264.7巨噬细胞对胆固醇的摄入,这也在很大程度上抑制了胆固醇累积、降低了细胞中胆固醇的量,从而起到抑制泡沫细胞形成的作用。
巨噬细胞胆固醇流入是通过细胞表面的清道夫受体实现的,其中SR-A1、SR-A2和CD36介导的胆固醇流入起到了决定性作用(占流入总量的75%~90%)[12],因此,采用RT-PCR的分析方法,分析了SR-A1、SR-A2及CD36基因mRNA的表达水平,结果显示,表松脂醇能够显著抑制SR-A1、SR-A2的表达,但对CD36无作用。因此,表松脂醇抑制胆固醇流入的作用可能是通过下调SR-A1和SR-A2的表达实现的。但是其调控通路还有待于研究。
通过体外实验证明,表松脂醇能够抑制由ox-LDL诱导的RAW264.7巨噬细胞中的胆固醇累积、促进胆固醇流出和抑制胆固醇流入,从而起到抑制巨噬细胞转化成泡沫细胞的作用。上调PPARγ-LXRα-ABCA1/ABCG1通路可能是其促进胆固醇流出的作用机制,下调SR-A1和SR-A2可能是抑制胆固醇流入的作用机制。这些结果表明表松脂醇可能在防治动脉粥样硬化方面具有潜在的作用,具有开发应用的前景,值得进行深入细致的研究。
| [1] | Yu X H, Fu Y C, Zhang D W, et al. Foam cells in atherosclerosis[J]. Clin Chim Acta, 2013, 424(9):245-252. |
| [2] | Glass C K, Witztum J L. Atherosclerosis:the road ahead[J]. Cell, 2001, 104(4):503-516. |
| [3] | Darwish H A, Arab H H, Abdelsalam R M. Epipinoresinol alleviates testicular dysfunction in adjuvant arthritic rats via suppression of inflammation and apoptosis:Comparison with celecoxib[J]. Toxicol Appl Pharmacol, 2014, 279(2):129-140. |
| [4] | Tabas I. Apoptosis and plaque destabilization in atherosclerosis:the role of macrophage apoptosis induced by cholesterol[J]. Cell Death Differ, 2004, 11(7):12-16. |
| [5] | Ross R. Atherosxlerosis——an inflammatory disease[J]. N Engl J Med, 1999, 340(2):115-126. |
| [6] | Pennings M, Meurs I, Ye D, et al. Regulation of cholesterol homeostasis in macrophages and consequences for atherosclerotic lesion development[J]. FEBS Lett, 2006, 580(23):5588-5596. |
| [7] | Reiss A B, Cronstein B N. Regulation of foam cells by adenosine[J]. Arterioscler Thromb Vasc Biol, 2012, 32(4):879-886. |
| [8] | Zhang M, Wu J F, Chen W J, et al. MicroRNA-27a/b regulates cellular cholesterol efflux, influx and esterification/hydrolysis in THP-1 macrophages[J]. Atherosclerosis, 2014, 234(1):54-64. |
| [9] | Ohashi R, Mu H, Wang X, et al. Reverse cholesterol transport and cholesterol efflux in atherosclerosis[J]. QJM, 2005, 98(12):845-856. |
| [10] | Dean M, Hamon Y, Chimin G. The human ATP-binding cassette (ABC) transporter superfamily[J]. J Lipid Res, 2001, 42(7):1007-1017. |
| [11] | Ozasa H, Ayaori M, Iizuka M, et al. Pioglitazone enhances cholesterol efflux from macrophages by increasing ABCA1/ABCG1 expressions via PPARgamma/LXRalpha pathway:findings from in vitro and ex vivo studies[J]. Atherosclerosis, 2011, 219(1):141-150. |
| [12] | Silverstein R L. Inflammation, atherosclerosisand arterial thrombosis:role of the scavenger receptor CD36[J]. Cleve Clin J Med, 2009, 76(2):27-30. |
| [13] | Sun Y J, Li Z L, Chen H, et al. Four new cytotoxic tetrahydrofuranoid lignans from Sinopodophyllum emodi[J]. Planta Med, 2012, 78(5):480-484. |
| [14] | Lee D G, Lee S M, Bang M H, et al. Lignans from the flowers of Osmanthus fragrans var. aurantiacus and their inhibition effect on NO production[J]. Arch Pharm Res, 2011, 34(12):2029-2035. |
| [15] | Chen J J, Fang H Y, Duh C Y, et al. New indolopyridoquinazoline, benzophenanthridines and cytotoxic constituents from Zanthoxylum integrifoliolum[J]. Planta Med, 2005, 71(15):470-475. |
| [16] | Lu C H, Li Y Y, Li L J, et al. Anti-inflammatory activities of fractions from Geranium nepalense and related polyphenols[J]. Drug Discov Ther, 2012, 6(4):194-197. |
| [17] | Okuyama E, Suzumura K, Yamazaki M. Pharmacologically active components of Todopon Puok (Fagraea racemosa), a medicinal plant from Borneo[J]. Chem Pharm Bull, 1995, 43(12):2200-2204. |
| [18] | Yang R, Guo P, Song X, et al. Hyperlipidemic guinea pig model:mechanisms of triglyceride metabolism disorder and comparison to rat[J]. Biol Pharm Bull, 2011, 34(7):1046-1051. |
| [19] | Wu C, Zhang X, Zhang X, et al. The caffeoylquinic acid-rich Pandanus tectorius fruit extract increases insulin sensitivity and regulates hepatic glucose and lipid metabolism in diabetic db/db mice[J]. J Nutr Biochem, 2014, 25(4):412-419. |
| [20] | Wu C, Guo Y, Su Y, et al. Cordycepin activates AMP-activated protein kinase (AMPK) via interaction with the gamma1 subunit[J]. J Cell Mol Med, 2014, 18(2):293-304. |
| [21] | Yvan L, Wang N, Tall A R. Role of HDL, ABCA1and ABCG1 transporters in cholesterol efflux and immune responses[J]. Arterioscler Thromb Vasc Biol, 2010, 30(2):139-143. |
| [22] | Tall A R, Yvan L, Terasaka N, et al. HDL, ABC transporters and cholesterol efflux:implications for the treatment of atherosclerosis[J]. Cell Metab, 2008, 7(5):365-375. |
| [23] | Wu C, Luan H, Wang S, et al. Modulation of lipogenesis and glucose consumption in HepG2 cells and C2C12 myotubes by sophoricoside[J]. Molecules, 2013, 18(12):15624-15635. |
 2015, Vol. 46
2015, Vol. 46



