薏苡仁Coicis Semen为禾本科(Gramineae)薏苡属Coix Linn. 植物薏苡Coix lachryma-jobi L. var. ma-yuen (Roman) Stapf. 的干燥成熟种仁[1]。研究表明,薏苡仁中含有酯类、不饱和脂肪酸类、糖类及内酰胺类等活性成分,具有抗肿瘤、提高免疫力、降血糖等作用[2, 3]。作为薏苡仁主要药效成分的薏苡仁油具有较强的抗肝癌作用[4, 5],多糖成分具有调节免疫功能的作用,但二者口服生物利用度较低,影响了其作为口服制剂在临床上的疗效发挥。
微乳作为纳米载体之一,是一种由油相、水相、表面活性剂和助表面活性剂按适当比例制得的一种透明、黏度低、且热力学稳定的溶液体系[6],其粒径小、稳定性好,能够促进难溶性药物的口服吸收。本课题组前期研究中以薏苡仁油为微乳油相,荷载灵芝三萜,制备了薏苡仁油-灵芝三萜组分微乳,有效地增加了薏苡仁油及灵芝三萜的体内吸收[7]。本实验利用薏苡仁中薏苡仁油及多糖2种抗肿瘤活性组分,制备了薏苡仁组分微乳(CMEs),为了进一步提高薏苡仁组分微乳的抗肝癌作用,本实验合成了能够被肝细胞膜上去唾液酸糖蛋白受体(ASGPR)[8, 9, 10]特异性识别的一种具有半乳糖残基的丁酰半乳糖酯(butyryl galactose ester,But-Gal),并将其修饰CMEs,对修饰后的CMEs的理化性质及体外抗肿瘤活性进行了考察[11],为进一步提高中药多组分抗肿瘤制剂的组织靶向性及抗肿瘤效果提供实验依据。
1 仪器与材料FA2104型万分之一天平,上海良平仪器仪表有限公司;Nano-ZS型马尔文粒径测定仪,英国马尔文公司;Nicolet IS-10型傅里叶变换红外光谱(FT-IR)仪,美国赛默菲世尔科技公司;JEM-2100型透射电子显微镜,日本JEOL公司;Bruker 500 MHz核磁共振仪,瑞士布鲁克公司;ZEISS倒置显微镜,南京微弗德科学仪器有限公司;HERA Cell 150 CO2培养箱,美国热电集团;酶标仪,美国热电集团;Cytation5细胞成像微孔板检测系统,美国伯腾仪器有限公司。
Novozym 435固定化脂肪酶,南京诚纳化工有限公司;丁酸乙烯酯,南京森贝伽生物科技有限公司;D-(+)-半乳糖,国药集团化学试剂有限公司;OP-10乳化剂,上海久亿化学试剂有限公司;聚氧乙烯氢化蓖麻油(Cremophor® RH40),德国BASF公司;聚乙二醇400(PEG400),国药集团化学试剂有限公司;聚山梨酯80、20,成都市科龙化工试剂厂;薏苡仁油,自制,超临界萃取制得,以总甘油三酯计质量分数为86.67%;薏苡仁多糖,自制,由超临界萃取药渣水提醇沉制得,以葡萄糖计质量浓度为76.63%;胎牛血清,杭州四季青生物工程材料有限公司;RPMI-1640培养基、胰蛋白酶溶液,GIBCO公司;二甲基亚砜,南京化学试剂有限公司;四甲基偶氮唑盐(MTT),SunShine公司;异硫氰酸荧光素(FITC),天津百萤科技有限公司。
人肝癌细胞HepG2细胞株,购自于中国科学院上海生命科学院生物化学与细胞生物学研究所。
2 方法与结果 2.1 But-Gal的合成与表征[12, 13]称取2.0 g Novozym 435固定化脂肪酶,研细,与1.5 g D-(+)-半乳糖和3.0 mL丁酸乙烯酯,共置于100 mL圆底烧瓶中,加入纯化后的丙酮50 mL,与分子筛适量,60 ℃油浴,回流15 h。将所得粗产物进行TLC分析,并以硅胶柱色谱,以石油醚-醋酸乙酯(12∶1)为洗脱剂洗脱,纯化产物。But-Gal合成路线见图 1,通过FT-IR及1H-NMR对其结构进行验证。FT-IR、1H-NMR结果见图 2与图 3。
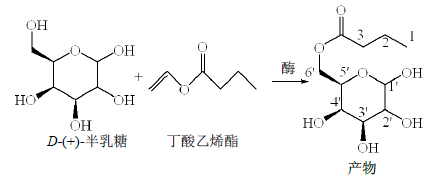 | 图 1 But-Gal的合成路线 Fig.1 Structure and key NOE and HMBC correlations of c |
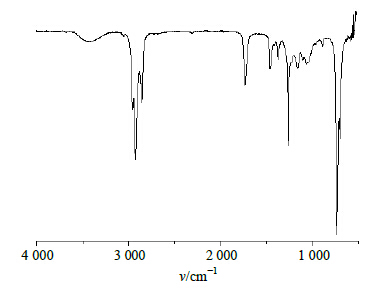 | 图 2 But-Gal的FT-IR图 Fig.2 FT-IR of But-Gal |
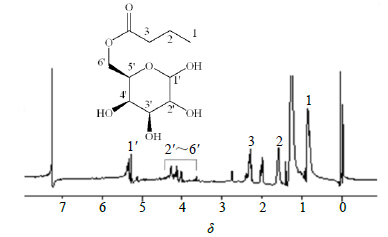 | 图 3 But-Gal的1H-NMR图 Fig.3 1H-NMR of But-Gal |
FT-IR:在3 428.11 cm−1处是羟基的伸缩振动吸收峰,在2 917.61、2 849.96 cm−1处有甲基和亚甲基的吸收峰,1 736.70 cm−1处是羰基的特征峰,而在1 600 cm−1处不存在丁酸乙烯酯烯键的特征峰,提示反应生成了But-Gal。
1H-NMR (500 Mz, CDCl3) 中,δ 0.89 (3H, t, J = 6.0 Hz, 1-CH3), 1.62 (2H, m, 2-CH2), 2.01 (4H, s, 1′, 2′, 3′, 4′-OH), 2.32 (2H, t, J = 3.5 Hz, 3-CH2), 3.5~4.5归属为D-半乳糖单元C-2′, 3′, 4′, 5′, 6′位质子,5.31 (s) 归属为D-半乳糖单元C-1′位质子。产物在δ 0.89~2.32处有丁酸乙烯酯结构中的-CH2、-CH3质子信号峰,在δ 3.54~4.51处有与D-半乳糖相似的峰,提示成功合成了But-Gal。
通过FT-IR及1H-NMR分析,经过酶促反应,在半乳糖C-6′位羟基发生了酯化反应,所得产物为But-Gal。
2.2 CMEs处方的设计与筛选 2.2.1 伪三元相图的绘制按乳化剂与助乳化剂的质量比(Km值)称取混合乳化剂(Smix),磁力搅拌混匀,固定薏苡仁油与混合乳化剂的质量比为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2及9∶1,加入薏苡仁油,于磁力搅拌下混匀后,在室温下以240 mg薏苡仁多糖溶于不同体积的蒸馏水中作为水相,磁力搅拌下滴加此薏苡仁多糖水溶液,直到形成澄清透明的微乳,分别以混合乳化剂、薏苡仁油、薏苡仁多糖水溶液作为伪三元相图的3个顶点,每一条边表示相应2组分的质量比,微乳制备过程中记录进入凝胶区、退出凝胶区以及微乳形成时各相所占比例,应用Origin 7.5软件绘制伪三元相图,确定凝胶区及微乳区。
2.2.2 乳化剂的选择以薏苡仁油、PEG400为微乳油相、助乳化剂,分别选取聚山梨酯80、RH40、OP-10以及聚山梨酯20作为乳化剂,混合均匀后,滴加薏苡仁多糖水溶液,观察体系的变化,绘制伪三元相图。结果显示,以RH40作为乳化剂所得微乳区面积最大,其次为聚山梨酯80,OP-10与聚山梨酯20的微乳区面积均较小,表明RH40更有利于微乳形成,因此确定最佳乳化剂为RH40。
2.2.3 助乳化剂的选择以薏苡仁油、RH40为微乳油相、乳化剂,分别选取乙醇、PEG400以及丙二醇作为助乳化剂,混合均匀后,滴加薏苡仁多糖水溶液,观察体系的变化,绘制伪三元相图。结果显示,以PEG400作为助乳化剂所得微乳区面积最大,其次为乙醇,丙二醇的微乳区面积最小,表明PEG400更有利于微乳形成,因此确定最佳助乳化剂为PEG400。
2.2.4 Km值筛选根据以上筛选的处方,以薏苡仁油为油相、RH40为乳化剂、PEG400为助乳化剂、薏苡仁多糖水溶液为水相,分别选择Km值1∶1、2∶1、3∶1,水滴定法制备微乳并绘制伪三元相图。结果显示,当Km值为3∶1时所得微乳区面积最大,2∶1时略小于3∶1,1∶1时微乳区面积最小,表明乳化剂与助乳化剂的最佳比例为3∶1,因此确定最佳Km值为3∶1,见图 4。
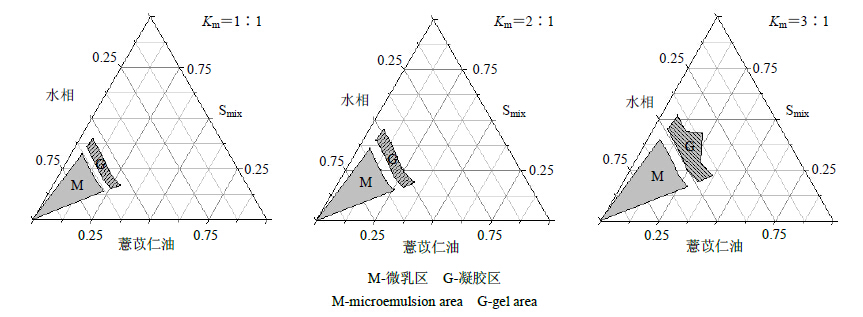 | 图 4 不同Km值的But-Gal-CMEs伪三元相图 Fig.4 Pesudo-ternary phase diagram of But-Gal-CMEs at different Km values |
根据上述研究结果,确定CMEs处方为薏苡仁油200 mg、RH40 150 mg、PEG400 50 mg、薏苡仁多糖240 mg溶于水相,所制备的微乳有淡蓝色乳光,澄清透明。
2.3 CMEs及But-Gal-CMEs制备 2.3.1 CMEs制备[14]取150 mg RH40、50 mg PEG 400置于西林瓶中,磁力搅拌2.5 h,混匀后加200 mg薏苡仁油,再磁力搅拌2.5 h混匀,以2 mL薏苡仁多糖水溶液(120 mg/mL)为水相,水滴定法制备CMEs。
2.3.2 But-Gal-CMEs制备取150 mg RH40、50 mg PEG400与32 mg But-Gal置于西林瓶中,磁力搅拌2.5 h,混匀后加200 mg薏苡仁油,再磁力搅拌2.5 h混匀,以2 mL薏苡仁多糖水溶液(120mg/mL)为水相,水滴定法制备But-Gal-CMEs。
2.4 微乳表征采用马尔文激光散射粒度测定仪,在室温下测定CMEs与But-Gal-CMEs的平均粒径、多分散指数(PDI)和Zeta电位,结果见表 1。同时将载有Formvar支持膜的铜网放于蜡板上,在膜上滴加微乳液1滴,红外灯下照射5 min,再滴加1%的磷钨酸1滴,室温风干10 min,置于JEM-2100型透射电镜下观察微乳的外观形态。结果显示所制备的CMEs与But-Gal-CMEs外观圆整,分散均匀(图 5)。
| 表 1 微乳的平均粒径、PDI与Zeta电位 Table 1 Average particle size, PDI, and Zeta potential of microemusions |
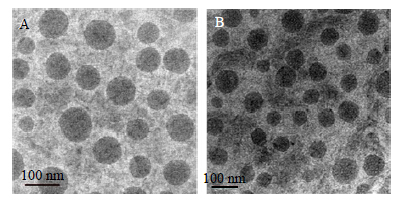 | 图 5 CMEs (A)与But-Gal-CMEs (B)的透射电镜图 Fig.5 TEM photos of CMEs (A) and But-Gal-CMEs (B) |
取微乳1.0 mL,分别用蒸馏水及生理盐水将其稀释10、20、50、100倍,测定其粒径和PDI。结果见表 2,稀释对微乳粒径无显著性影响。
| 表 2 不同稀释介质对微乳粒径的影响 Table 2 Effect of different dilution media on mean droplet size of But-Gal-CMEs |
取微乳1.0 mL于离心管中,以13 000 r/min的速度离心30 min,观察微乳外观。结果显示所制备微乳无明显絮凝和分层现象。
2.5.3 放置时间对稳定性的影响微乳在4 ℃和25 ℃的条件下保存1个月,观察微乳外观。结果显示所制备微乳无明显絮凝和分层现象。
2.5.4 pH对稳定性的影响取微乳样品溶液7份,加磷酸缓冲液调节pH值分别为2.5、3.0、4.5、5.0、6.5和7.4,观察其外观形态的变化并测定平均粒径。结果见图 6及表 3,在考察范围内pH对微乳的粒径无显著性影响。
 | 图 6 不同pH值下But-Gal-CMEs的透射电镜图 Fig.6 TEM photos of But-Gal-CMEs at different pH values |
| 表 3 不同pH值下微乳的粒径与PDI Table 3 Particle size and PDI at different pH values |
从液氮罐中取出HepG2细胞冻存管,迅速置于37 ℃恒温水浴中解冻,离心去除冻存液,加入已配制的含10% FBS的RPMI 1640培养液,吹打均匀并移至细胞培养瓶中,于37 ℃、5% CO2的饱和湿度孵箱中静置培养。次日换液,2~3 d传代,取对数生长期细胞用于实验。
2.6.2 MTT实验[15, 16]收集对数生长期HepG2人肝癌细胞,用含10% FBS的RPMI 1640培养基调整细胞悬液浓度至1×105个/mL,接种于96孔板中,每孔加入200 μL细胞悬液,置于5% CO2、37 ℃培养箱中培养24 h使其贴壁,对照组正常培养,对照组给予RPMI 1640不完全培养基,给药组给予CMEs与But-Gal-CMEs(以薏苡仁油质量浓度计分别为7.81、15.63、31.25、62.50、125.00、250.00 μg/mL),每个质量浓度均设3个复孔,药物与细胞作用48 h,终止培养前4 h加入MTT(5 mg/mL),10 μL/孔,培养结束后弃去上层液体,每个复孔加入100 μL DMSO溶液,摇床低速振摇10 min后,采用酶标仪检测492 nm处各孔吸光度(A)值。并利用公式计算药物对细胞的增殖抑制率。
细胞增殖抑制率=1-A给药组/A对照组
根据细胞增殖抑制率(表 4)求得CMEs、But-Gal-CMEs抑制HepG2细胞增殖的半数抑制浓度(IC50)分别为71.23、62.55 μg/mL。在薏苡仁油质量浓度为7.81、15.63 μg/mL时,But-Gal-CMEs与CMEs相比,But-Gal-CMEs对HepG2细胞增殖的抑制作用显著强于CMEs。
| 表 4 CMEs和But-Gal-CMEs作用HepG2细胞48h的抑制效应(x±s, n = 3 Table 4 Inhibitory effect of CMEs and But-Gal-CMEs on HepG2 cells at 48 h (x±s, n = 3) |
游离FITC(free FITC)溶液的制备:称取FITC 0.975 mg,用去离子水溶解定容至5 mL,得500 μmol/L Free FITC溶液,避光保存于4 ℃。
薏苡仁组分物理混合(mixture)溶液的制备:精密称取薏苡仁油200 mg、薏苡仁多糖240 mg、FITC 0.975 mg,磁力搅拌混合均匀后溶于5 mL DMSO中,得500 μmol/L溶液,避光保存于4 ℃。
载FITC的CMEs(FITC-loaded CMEs)的制备:称取FITC 0.975 mg、RH40 150 mg、PEG400 50 mg,避光条件下,磁力搅拌2 h,加入200 mg薏苡仁油,磁力搅拌2 h混匀,以2 mL薏苡仁多糖水溶液(120 mg/mL)为水相,水滴定法制备微乳,用去离子水定容至5 mL,得500 μmol/L FITC-loaded CMEs微乳,避光保存于4 ℃。
载FITC的But-Gal-CMEs(FITC-loaded But- Gal-CMEs)的制备:称取FITC 0.975 mg、RH40 150 mg、PEG400 50 mg、But-Gal 32 mg,避光条件下,磁力搅拌2 h,加入200 mg薏苡仁油,磁力搅拌2 h混匀,以2 mL薏苡仁多糖水溶液(120 mg/mL)为水相,水滴定法制备微乳,用去离子水定容至5 mL,得500 μmol/L FITC-loaded But-Gal-CMEs微乳,避光保存于4 ℃。
2.7.2 细胞摄取实验取对数生长期细胞,用胰蛋白酶消化使其脱壁,用含10% FBS的RPMI 1640培养液重悬成单细胞悬液,并进行细胞计数,用含10% FBS的RPMI 1640培养液稀释至细胞浓度1×105/mL,吹打均匀,接种于24孔细胞培养板,每孔培养液400 μL,在37 ℃、5% CO2培养箱中孵育24 h。移去孔内原培养液,将上述500 μmol/L free FITC、mixture、FITC-loaded CMEs、FITC-loaded But- Gal-CMEs用不完全培养基稀释至20 μmol/L,给药于HepG2细胞,每孔400 μL。然后移入细胞培养箱继续培养2 h。孵育结束后,快速弃去培养基,加入冷的PBS终止细胞摄取,并冲洗细胞3遍。于荧光倒置显微镜下观察并比较各孔的细胞形态及细胞荧光强度,结果见图 7。
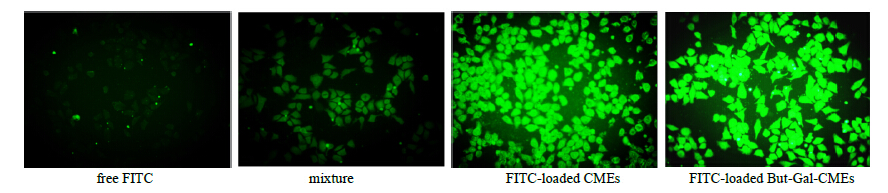 | 图 7 荧光倒置显微镜观察各组HepG2细胞2h的摄取作用 Fig.7 Fluorescent staining of cellular uptake in each group after incubation with HepG2 cell for 2 h |
由图 7可知,FITC-loaded CMEs及FITC-loaded But-Gal-CMEs组荧光强度显著强于free FITC、mixture组,提示薏苡仁油形成微乳后增强了细胞摄取作用;由FITC-loaded CMEs及FITC-loaded But-Gal-CMEs组对比可知,But-Gal-CMEs荧光强度强于CMEs,提示CMEs经But-Gal表面修饰后进一步增强了细胞摄取作用。
3 讨论本研究以酶催化法成功合成了But-Gal,并用水滴定法制备了CMEs及经But-Gal对CMEs表面修饰形成的But-Gal-CMEs。所制备的微乳均具有粒径小、圆整度好、稳定性好的特点。体外MTT实验考察了CMEs与But-Gal-CMEs对抑制肝癌细胞HepG2增殖的作用,实验发现,CMEs、But-Gal- CMEs抑制HepG2细胞增殖的IC50值分别71.23、62.55 μg/mL,CMEs经But-Gal修饰后促进了其对HepG2细胞增殖的抑制作用。细胞摄取结果也进一步证明了But-Gal-CMEs增强了HepG2细胞对药物的摄取。CMEs及But-Gal-CMEs体内靶向性如何,值得进一步建立荷载HepG2裸鼠异位瘤模型,采用近红外成像技术观察CMEs及But-Gal-CMEs口服后体内分布情况,以及2种制剂体内药效如何,也会对其进一步验证。
以薏苡仁油作为CMEs的油相,不仅可以作为药效成分,又可以降低辅料用量,CMEs中的薏苡仁多糖成分,能够起到协同抗肿瘤作用。
在肝细胞膜表面具有丰富的ASGPR,能特异性识别结构中具有半乳糖残基的半乳糖配体,结合形成的配体受体复合物,定向转运到肝细胞内。而且But-Gal是一种带有半乳糖残基的化合物,能被ASGPR特异性识别,将其对CMEs表面修饰形成But-Gal-CMEs,增强肿瘤靶向效果。此外,本研究合成But-Gal所采用的酶催化法具有反应温和、效率高、选择性强、副产物少等优势。
本研究合成But-Gal过程中遇到了产率低问题,期望得到较高产率仍需对反应条件进行优化。本研究只合成了一种半乳糖酯修饰中药组分微乳,关于其对不同分子构象的半乳糖酯修饰中药组分微乳能否达到较好的肿瘤靶向效果,可以对其进一步研究。
| [1] | 胡少华, 肖小年, 易醒, 等. 薏苡仁的研究新进展[J]. 时珍国医国药, 2009, 20(5):1059-1060. |
| [2] | 吴岩, 原永芳. 薏苡仁的化学成分和药理活性研究进展[J]. 华西药学杂志, 2010, 25(1):111-113. |
| [3] | 张明发, 沈雅琴. 薏苡仁抗代谢综合征的药理作用研究进展[J]. 药物评价研究, 2014, 37(2):178-183. |
| [4] | 胡军, 金国梁. 薏苡仁的营养与药用价值[J]. 中国食物与营养, 2007(6):57-58. |
| [5] | 张明发, 沈雅琴. 薏苡仁油抗肝癌的药理作用与临床作用[J]. 现代药物与临床, 2010, 25(6):422-425. |
| [6] | Tenjaria S. Microemulsions:An overview and pharmaceutical applications[J]. Crit Rev Ther Drug Carrier Syst, 1999, 16(5):461-521. |
| [7] | 贺俊杰, 陈彦, 杜萌, 等. 灵芝多组分微乳一步制备方法的探索[J]. 药学学报, 2013, 48(3):441-446. |
| [8] | Rigopoulou E I, Roggenbuck D, Smyk D, et al. Asialoglycoprotein receptor (ASGPR) as target autoantigen in liver autoimmunity:Lost and found[J]. Autoimmun Rev, 2012, 12(2):260-269. |
| [9] | Mcvicker B, Tuma D J, Kubik J A, et al. The effect of ethanol on asialoglycoprotein receptor-mediated phagocytosis of apoptotic cells by rat hepatocytes[J]. Hepatology, 2002, 36(6):1478-1487. |
| [10] | 张盈, 杨硕, 李灵芝. 肝靶向给药系统研究进展[J]. 中国新药杂志, 2013, 22(8):923-927. |
| [11] | 严红梅, 贾晓斌, 张振海, 等. 维生素E聚乙二醇1000琥珀酸酯对宝藿苷I抑制乳腺癌细胞MCF-7增殖的影响[J]. 中草药, 2015, 46(3):384-388. |
| [12] | 程怡, 吴卫, 张冬青. 非水相酶促催化合成去唾液酸糖蛋白配体修饰物[J]. 药学学报, 2010, 45(9):1134-1138. |
| [13] | 郭波红, 程怡, 林绿萍, 等. 去唾液酸糖蛋白受体介导的肝靶向脂质体配体的酶促催化合成研究[J]. 中国药学杂志, 2012, 47(1):40-43. |
| [14] | 袁成甜, 贺俊杰, 陈彦, 等. 灵薏方多组分微乳的制备及其抗肺癌活性研[J]. 中草药, 2014, 45(22):3284-3288. |
| [15] | Eren Y, Özata A. Determination of mutagenic and cytotoxic effects of Limonium globuliferum aqueous extracts by Allium, Ames, and MTT tests[J]. Rev Bras Farmacogn, 2014, 24(1):51-59. |
| [16] | 岳文华, 徐坤, 冯玉林, 等. 白头翁皂苷D体外抗肝癌作用及其机制研[J]. 中草药, 2014, 45(22):3295-3301. |
| [17] | Nam H Y, Kwon S M, Chung H, et al. Cellular uptake mechanism and intracellular fate of hydrophobically modified glycol chitosan nanoparticles[J]. J Controlled Release, 2009, 135(3):259-267. |
| [18] | Teskač K, Kristl J. The evidence for solid lipid nanoparticles mediated cell uptake of resveratrol[J]. Int J Pharm, 2010, 390(1):61-69. |
 2015, Vol. 46
2015, Vol. 46


