当归Angelicae Sinensis Radix为伞形科植物当归Angelica sinensis (Oliv.) Diels的干燥根,是临床常用药,一般认为其味辛,而性微温,归心、肝、脾三经,其主要药理成分为当归多糖,现代药理学研究证明当归多糖具有补血、抗菌、抗肿瘤、抗辐射、免疫调节、抗氧化等作用[1]。黄芪Astragali Radix是豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var.mongholicus (Bge.) Hsiao或荚膜黄芪Astragalus membranaceus (Fisch.) Bge. 的干燥根,其主要活性成分黄芪多糖具有提高免疫力、抗炎、抗病毒、抗肿瘤、抗氧化和延缓衰老之功能[2]。
“当归补血汤”是中国古老的方剂之一,作为补血的经典方剂而被使用了几个世纪。该方剂是以当归和黄芪用量1∶5混合水煎而成,其具有广泛的药理作用,如抗氧化、免疫刺激、保护肝脏损害等[3]。归芪多糖是按照当归补血汤,将当归、黄芪以特定比例(1∶5)混合水煎提取出的多糖,目前对于归芪多糖的研究,均以药理活性为主,本实验室前期研究证明归芪多糖的抗氧化活性优于当归多糖和黄芪多糖[4],但对其分离纯化,以及纯化后多糖的结构特征和药理活性等相关研究还很不足。为了更加深入了解和合理开发归芪多糖,本实验从归芪多糖中分离纯化得到一种多糖成分AAP-2A,并利用红外光谱、紫外光谱、高效凝胶渗透色谱、凝胶渗透色谱-多角度激光散射联用、气相色谱、甲基化、核磁共振等方法,对其理化性质及结构特征进行了探讨。
1 材料与仪器BP211D型与BS224S型电子天平(德国Sartorius公司);UV-1700紫外可见分光光度计(日本岛津公司);KQ-3200DE超声波仪器(江苏昆山公司);BT100N数显恒流泵(上海青浦沪西仪器厂)。CR22GII离心机(日本日立);Freezone 6PWS型真空冷冻干燥仪(美国LABCONCO);Dawn HeleosII型十八角度激光散射仪(美国怀雅特技术公司);Waters 600高效液相色谱仪(美国Waters公司);UltrahydrogelTM 1000、500色谱柱(美国Waters公司);GC 2014型气相色谱仪(日本岛津公司);QP2010 GC-MS仪(日本岛津公司);OV-101毛细管色谱柱(兰州中科安泰分析科技有限责任公司);600 MHz Inova 600 NB核磁共振波谱仪(德国Bruker公司)。
标准单糖:鼠李糖(Rha,批号111683-200401)、阿拉伯糖(Ala,批号111506-200001)、木糖(Xyl,批号111508-200404)、甘露糖(Man,批号140651- 200602)、葡萄糖(Glc,批号110833-200904)、半乳糖(Gal,批号100226-201105)、葡萄糖醛酸(GluA批号140648-200602)、半乳糖醛酸(GalA,批号111646-200301)均购于中国食品药品检定研究院;右旋糖酐(dextran)对照品(相对分子质量分别为668 000、410 000、273 000、148 000、48 600、23 800、11 600、5 200),批号SDKC-600-200903,购于美国PSS公司。其余试剂均为国产分析纯。
2 方法 2.1 归芪多糖的提取与分离纯化将当归与黄芪的混合物(1∶5)以10倍量(体积质量比)80%乙醇回流提取2次,每次2 h;滤过得药渣。药渣中加入一定量的蒸馏水,加热回流提取2次,每次2 h,合并滤液,减压浓缩后加适量95%乙醇,使乙醇终体积分数为80%,静置过夜,抽滤,得归芪多糖浸膏。浸膏用Sevag法除蛋白[5],H2O2除色素后再醇沉,沉淀物依次用无水乙醇、丙酮、无水乙醚洗涤,真空干燥得得归芪粗多糖AAP。
AAP经DEAE-52柱色谱,以纯水及0.1、0.3 mol/L的NaCl梯度洗脱得到3个均一组分AAP-1、AAP-2、AAP-3。AAP-2经Sephadex G-100柱色谱,NaAc-HAc缓冲液洗脱,得到2个均一组分AAP-2A和AAP-2B。AAP-2A经浓缩,醇沉,真空干燥得白色粉末,此粉末易溶于水,不溶于DMSO、乙醇等有机溶剂。
2.2 总糖量的测定以葡萄糖为标准对照,采用苯酚硫酸法测定AAP-2A的总糖量[6]。
2.3 紫外、红外光谱分析紫外光谱:以1 mg/mL的AAP-2A溶液在200~400 nm内扫描。红外光谱:取2~3 mg AAP-2A样品,以KBr压片,测其红外光谱吸收[7]。
2.4 相对分子质量、绝对分子质量、分子构象及分子质量分布测定采用高效凝胶渗透色谱法(HPGPC),取AAP-2A样品溶于蒸馏水中,配成3 mg/mL的溶液进样,流动相为蒸馏水,色谱柱为凝胶渗透色谱柱UltrahydrogelTM 1000、500串联,体积流量0.8 mL/min,柱温为30 ℃。相对分子质量测定时将相对分子质量分别为5 200、11 600、23 800、48 600、148 000、273 000、410 000、668 000的右旋糖酐标准品用流动相配成质量浓度为0.5 mg/mL的水溶液,按相对分子质量由小到大顺序依次分别进样,测定保留时间(t)。以t对相对分子质量对数(lgMw)绘制标准曲线,计算AAP-2A的相对分子质量。
采用凝胶渗透色谱与光散射仪(GPC-MALLS)联用法,流动相为0.1 mol/L NaNO3与质量分数为0.02% NaN3的混合溶液,示差折光检测器温度为35 ℃,测定AAP-2A的绝对分子质量和分子构象及相对分子质量分布。
2.5 单糖组成分析[8]取10 mg AAP-2A,加2 mol/L三氟乙酸(TFA)2.0 mL置于特弗伦管中,封管后120 ℃水解3 h,冷却后于60 ℃减压旋蒸除去TFA,加入1.5 mL甲醇溶解,减压蒸干,重复3次,除尽TFA。向已水解的样品中加入10 mg 盐酸羟胺、7 mg内标肌醇六乙酰酯、0.5 mL吡啶,置烘箱中90 ℃恒温30 min。取出后冷至室温,加入0.5 mL醋酸酐,在90 ℃下继续反应30 min(乙酰化)。反应产物减压蒸干,溶于1.0 mL氯仿中,进行GC分析。取各单糖对照品适量,按上述步骤乙酰化后进行GC分析。
2.6 甲基化分析AAP-2A 5 mg充分干燥,溶于DMSO,用改良的Hakomori法甲基化[9],经IR分析无羟基后,水解,还原,乙酰化后进行GC-MS分析。
2.7 NMR分析精密称取充分干燥的AAP-2A 15 mg,溶于0.5 mL重水中,冷冻干燥,如此重复用重水交换3次,再溶于0.5 mL重水后,用微孔滤膜(0.45 μm)滤过后在Bruker DRX-600核磁共振光谱仪上进行1H-NMR和13C-NMR分析。1H-1H COSY、HMQC和HMBC相关谱在60 ℃下进行测定[10]。
3 结果与讨论 3.1 AAP-2A的分离纯化归芪粗多糖AAP经DEAE-52纤维素柱色谱分离,AAP-2经Sephadex G-100排阻色谱分离,得白色絮状归芪多糖AAP-2A;得率为1.85%,含糖量为98.8%。经过HPGPC检测,AAP-2A呈单一对称峰。说明AAP-2A为含糖量较高的均一多糖。
3.2 紫外、红外光谱分析在紫外光谱图(图 1)中,260和280 nm处无蛋白、核酸吸收峰,表明多糖中无蛋白、多肽及核酸的存在。
 | 图 1 AAP-2A紫外光谱图 Fig.1 UV spectrum of AAP-2A |
红外光谱图(图 2)显示出了明显的多糖特征吸收峰。在3 403.16、2 919.60、1 633.62、1 423.72、1 076.28、614.23 cm−1等处均有多糖的特征吸收,3 403.16 cm−1处吸收峰主要是由多糖的配糖体羟基(缔合)伸缩振动引起的;2 919.60 cm−1 处的吸收峰与碳氢键的伸缩振动相对应;1 633.62 cm−1处的吸收峰为葡糖糖的特征吸收,1 076.28 cm−1处的吸收峰为碳氧碳键的特征吸收,614.23 cm−1处吸收峰为吡喃糖的特征吸收,提示多糖中可能有吡喃糖存在。
 | 图 2 AAP-2A红外光谱图 Fig.2 FT-IR spectrum of AAP-2A |
以右旋糖酐系列标准葡聚糖的保留时间(t)为横坐标和相对分子质量的对数(lgMw)为纵坐标计算得回归方程为lgMw=25.8-4.79 t+0.401 t2-0.011 t3(r2=0.983 8),求得AAP-2A相对分子质量大于6.68×105。
采用激光检测器记录供试品质量浓度和供试品在不同角度的光散射强度,通过多角度激光散射仪自带ASTRAV软件计算得到AAP-2A的绝对分子质量为2.252×106;以旋转均方根半径对摩尔质量作图,图像呈马蹄形,说明AAP-2A的分子构象呈高度支化;通过激光检测器和多角度激光散射仪自带的软件计算AAP-2A的数均分子量(Mn),最终得出分布指数d=Mw/Mn=1.038,接近1.00,证明AAP-2A分子质量分布呈单分散性,即表明摩尔质量分布范围较集中,分子大小较均一。
3.4 单糖组成分析AAP-2A经GC分析后,用面积归一化法得AAP-2A的单糖组成及其比例为Rha-Gal-Ara-Glc(1∶2.13∶3.22∶6.18)。色谱图见图 3和4。
 | 图 3 混合单糖对照品的气相色谱图 Fig.3 GC of mixed monose reference substances |
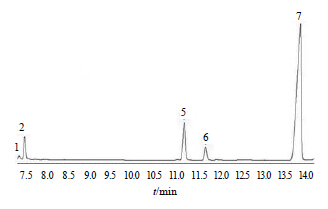 | 图 4 AAP-2A的气相色谱图 Fig.4 GC of AAP-2A |
根据Hakomori 法甲基化3次后,进行红外光谱检测,在3 600~3 300 cm−1处没有-OH的特征吸收峰,说明样品甲基化完全。对乙酰化产物进行GC-MS 分析,结果见表 1。表 1中鼠李糖连接方式、半乳糖连接方式、阿拉伯糖连接方式、葡萄糖连接方式的摩尔比总和为1.01∶2.06∶3.21∶6.07,与气相色谱结论(1∶2.13∶3.22∶6.18)基本一致,说明AAP-2A结构中最多的单糖残基为葡萄糖。
| 表 1 AAP-2A甲基化结果 Table 1 Methylating results of AAP-2A |
多糖AAP-2A经过D2O氘化后进行1D和2D的核磁共振波谱分析。
α-L-鼠李糖的确定:在1H-NMR谱中,H-1/H-2有较小的耦合常数(JH-1,2),H-3/H-4(JH-3,4 = 7.5 Hz)和H-4/H-5(JH-4,5 = 10.0 Hz)有较大的耦合常数,表明残基是甘露糖构型[11, 12]。在NOESY中H-1/H-2有交叉峰,这两者都表明残基是α构型[13]。H-6的化学位移δ 1.25是鼠李糖C-6位甲基质子信号[14]。由以上结果推断此残基为→3)- α-L-Rhap (1→。
β-D-半乳糖的确定:异头氢的化学位移在δ 4.6,并且耦合常数较大(JH-1,2 = 8.4 Hz),H-1有裂分,表明残基是β构型[15]。在1H-NMR谱中,JH-3,4小于3.0 Hz,说明残基是半乳糖[16]。综上分析,此残基为→3)-β-D-Galp(1→。
→1,3)-α-L-阿拉伯糖的确定:异头氢的化学位移在δ 5.2,在1H-NMR谱中,JH-1,2小于2.0 Hz,C-5化学位移为δ 65.8,在δ 63~67,证明残基为阿拉伯糖。与文献值[17]比较,C-3化学位移向低场偏移。说明残基为→3)-α-L-Araf (1→。
→1,5)-α-L-阿拉伯糖的确定:异头氢的化学位移为δ 5.1,在1H-NMR谱中,JH-1,2小于2.0 Hz,在1H-1H COSY谱与NOESY谱中没有与H-6相关的信号,说明残基为阿拉伯糖。参照文献报道[18, 19],C-5的化学位移向低场偏移。通过以上信息可判断残基为→5)-α-L-Araf (1→。
→1,3,5)-α-L-阿拉伯糖的确定:在1H-NMR谱中,JH-1,2小于2.0 Hz,C-5化学位移为δ 69.5,证明残基为阿拉伯呋喃糖,大于δ 67,说明在C-5位有取代。与文献值[18, 19]比较C-3化学位移向低场偏移,可知此残基为→3,5)-α-L-Araf (1→。
端基α-D-葡萄糖的确定:异头氢的化学位移在δ 5.30、JH-1,2小于3.0 Hz,JC-1,H-1 = 171 Hz,以及在NOESY中有H-1/H-2的交叉峰,表明残基是α构型。H-2/3和H-3/4均有较大的耦合常数(9.0~10.0 Hz),可以确定残基是葡萄糖。在NOESY和HMBC谱中,没有与除H-1外其他氢有相交的键间连接点,表明残基是端基α-D-Glcp[11, 20]。
→1,4)-α-D-葡萄糖的确定:残基异头氢的化学位移在5.0,JH-1,2的耦合常数非常小,且JH-1,C-1 = 170 Hz,表明残基为α构型。H-2/H-3和H-3/H-4均有较大的耦合常数(J = 10.0 Hz),说明残基是葡萄糖。与参考文献相比[21, 22],残基上的C-4向低场发生了偏移。说明此残基为→4)-α-D-Glcp (1→。
→1,4,6)-α-D-葡萄糖的确定:在1H-NMR谱中,H-1化学位移为δ 5.0,为单峰(JH-1,2小于3.0 Hz),在NOESY谱中H-1/H-2有交叉峰,说明残基是α构型。JH-2,3(8.5 Hz)和JH-3,4(10.0 Hz)有较大的耦合常数,确定残基为葡萄糖。与参考文献相比[21, 22],H-4与H-6化学位移向低场偏移。综合分析,此残基为→4,6)-α-D-Glcp (1→。
根据分析结果,将8种糖残基的1H与13C-NMR谱的信号进行全归属,见表 2。各单糖残基的连接方式可以从NOESY谱(表 3)中得出。
| 表 2 AAP-2A的1H-NMR和13C-NMR化学位移 Table 2 1H-NMR and 13C-NMR chemical shifts of AAP-2A |
| 表 3 NOESY谱中各残基的连接方式 Table 3 Connection mode of each residue observed in NOESY spectrum |
由甲基化分析结果,可以推出糖残基A、B、C、D、E、F、G和H的摩尔比大约是1∶2∶1∶1∶1∶3∶1∶1。综合以上分析结果,推出AAP-2A一级结构的重复单元见图 5。
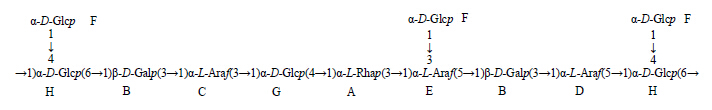 | 图 5 AAP-2A一级结构的重复单元 Fig.5 Structure of repetitive unit of AAP-2A primary structure |
由于相对分子质量和绝对分子质量测定时溶剂使用的是葡聚糖的对照品,而AAP-2A是由8种单糖组成的杂多糖,两者结构差异较大,系统不同,多糖伸展和皱缩的程度不同。多糖在水中呈伸展状态,在盐溶液中呈皱缩状态,后者的分子半径变小,在通过凝胶色谱柱时后出峰,从而导致相对分子质量测定结果不一致。另外,测定相对分子质量时使用的是葡聚糖的对照品,而AAP-2A是由8种单糖组成的杂多糖,两者结构差异较大,推测AAP-2A的分支较多,分子半径较大,所以出峰时间较靠前,导致测定的相对分子质量与绝对分子质量相差较大,此推论在甲基化与核磁的结果中得到印证。
综上所述,AAP-2A主链骨架由1,3-α-L-鼠李糖,1,3-β-D-半乳糖,1,3、1,5、1,3,5-α-L-阿拉伯糖和1,4、1,4,6-α-D-葡萄糖组成,侧链分支点位于阿拉伯糖的3位和葡萄糖的4位,侧链分支由1位连接的α-D-葡萄糖组成。AAP-2A为一种新的中性杂多糖,其构象呈高度支化状,并且具有单分散性,即表明摩尔质量分布范围较集中,分子大小较均一。体外抗氧化活性研究表明,AAP-2A的抗氧化活性强于归芪粗多糖AAP,其作用机制有待进一步研究。
| [1] | 孙红国, 张蔓, 纪鹏, 等. 当归多糖的分离、纯化及单糖成分分析[J]. 天然产物研究与开发, 2014, 26(4):480-485. |
| [2] | 姚丹, 王宏军. 黄芪多糖单糖组分的气相色谱分析[J]. 安徽农业科学, 2012, 40(9):5128-5129. |
| [3] | 阴赬宏, 李兰芳, 金亚宏, 等. 当归补血汤的实验研究进展[J]. 中国实验方剂学杂志, 1998, 4(6):58-60. |
| [4] | 蒲秀瑛, 李言, 王鹏, 等. 归芪多糖体外抗氧化活性的研究[J]. 中国食品工业, 2011, 25(1):64-66. |
| [5] | Sun Y X, Liu J C. Structural characterization of a water-soluble polysaccharide from the roots of Codonopsis pilosula and its immunity activity[J]. Int J Biol Macromol, 2008, 43(3):279-282. |
| [6] | Dubois M, Gilles K A, Hamilton J K, et al. Colorimetric method for determination of sugars and related substances[J]. Anal Chem, 1956, 28(3):350-356. |
| [7] | Zhao L Y, Dong Y H, Chen G T, et al. Extraction, purification, characterization and antitumor activity of polysaccharides from Ganoderma lucidum[J]. Carbohydr Polym, 2010, 80(3):783-789. |
| [8] | 黄凯, 李志孝, 邓永康, 等. 药用真菌马勃多糖的分离纯化及结构分析[J]. 华西药学杂志, 2008, 23(5):516-518. |
| [9] | 张惟杰. 糖复合物生化研究技术[M]. 第2版. 杭州:浙江大学出版社, 1999. |
| [10] | Cui W W, Eskin M N A, Biliaderis C G, et al. NMR characterization of a 4-O-methyl-β-D-glucuronic acidcontaining rhamnogalacturonan from yellow mustard (Sinapis alba L.) mucilage[J]. Carbohydr Res, 1996, 292:173-183. |
| [11] | Mondal S, Chakraborty I, Rout D. Isolation and structural elucidation of a water-soluble polysaccharide (PS-I) of a wild edible mushroom, Termitomyces striatus[J]. Carbohydr Res, 2006, 341(7):878-886. |
| [12] | Rout D, Mondal S, Chakraborty I. The structure of a polysaccharide from fraction-II of an edible mushroom, Pleurotus florida[J]. Carbohydr Res, 2006, 341(8):995-1002. |
| [13] | Pramanik M, Mondal S, Chakraborty I. Structural investigation of a polysaccharide (Fr. II) isolated from the aqueous extract of an edible mushroom, Pleurotus sajor-caju[J]. Carbohydr Res, 2005, 340(4):629-636. |
| [14] | Leone S, Molinaro A, Dubery I, et al. The O-specific polysaccharide structure from the lipopolysaccharide of the gram-negative bacterium Raoultella terrigena[J]. Carbohydr Res, 2007, 342(11):1514-1518. |
| [15] | Agrawal P K. NMR Spectroscopy in the structural elucidation of oligosaccharides and glycosides[J]. Phytochemistry, 1992, 31(10):3307-3330. |
| [16] | Prabhakar G R, Unaiza H, Xu Q W. Structure determination of the capsular polysaccharide from Vibrio vulnificus strain 6353[J]. Eur J Biochem, 1998, 255(1):279-288. |
| [17] | Sun Y L, Steve W, Cui B, et al. Structural features of pectic polysaccharide from Angelica sinensis (Oliv.) Diels.[J]. Carbohydr Polym, 2010, 80(2):544-550. |
| [18] | Cordeiro L M C, Reinhardt V F, Baggio C H, et al. Arabinan and arabinan-rich pectic polysaccharides from quinoa (Chenopodium bquinoa) seeds:Structure and gastroprotective activity[J]. Food Chem, 2012, 130(4):937-944. |
| [19] | Kang J, Cui S W, Phillips G O, et al. New studies on gum ghatti (Anogeissus latifolia) Part III:Structure characterization of a globular polysaccharide fraction by 1D, 2D, NMR spectroscopy and ethylation analysis[J]. Food Hydrocolloid, 2011, 25(8):1999-2007. |
| [20] | Dominaika D, Philip V T, Nikolay P A. Structure of the O-specific polysaccharide of Proteus penneri 103 containing ribitol and 2-aminoethanol phosphates. Carbohydr Res, 2002, 337(17):1535-1540. |
| [21] | Ye L B, Zhang J S, Yang Y, et al. Structural characterization of a heteropolysaccharide by NMR spectra[J]. Food Chem, 2009, 112(4):962-966. |
| [22] | Zhang A Q, Sun P L, Zhang J S, et al. Structural investigation of a novel fucoglucogalactan isolated from the fruiting bodies of the fungus Hericium erinaceus[J]. Food Chem, 2007, 104(2):451-456. |
 2015, Vol. 46
2015, Vol. 46


