2. 福建农林大学作物科学学院, 福建 福州 350002;
3. 福建农林大学生命科学学院, 福建 福州 350002
2. College of Crop Science, Fujian Agriculture and Forestry University, Fuzhou 350002, China;
3. College of Life Science, Fujian Agriculture and Forestry University, Fuzhou 350002 China
三叶青学名三叶崖爬藤Tetrastigma hemsleyanum Diels et Gilg,属于被子植物门双子叶植物纲葡萄科植物[1]。多年生草质攀缘藤本,阴生植物,喜斑驳光照。野生三叶青主要分布在江西、浙江、福建、安徽、广西、四川部分山区,主要有2个品种:一种是褐紫藤三叶青,成熟期靠近根部藤的表皮颜色为紫褐色,生长在纬度27.30°以北的江西、浙江山区;另一种是青色藤三叶青,藤的表面颜色为青白色,生长在我国纬度27.30°以南的福建、湖南、四川、广东、广西、云南的部分地区。三叶青是我国独有的珍贵药材,以干燥块根入药,其具有抗癌、活血散结、消炎止痛、祛风化痰等功效,被誉为“植物抗生素”。
目前,福建省三叶青栽培技术以大田人工栽培和组织培养快速繁殖模式为主,引种驯化野生三叶青品种。在1 500~2 000 μmol/(m2·s) 光照强度条件下,28 ℃是三叶青愈伤组织生长的最适温度,30 ℃次之,34 ℃下愈伤组织完全死亡[2, 3]。同时,光照能诱导三叶青植物中黄酮类化合物的形成和积累[4],黄酮类化合物使得三叶青具有抑制肿瘤细胞作用[5]。在15%光照(双层黑色遮荫网)条件下,每年10月份是三叶青植物的最佳生长时期[6]。该期午间温度高,由气孔因素导致光合“午休”现象[7]。依据之前研究可知,三叶青植物的蒸腾作用、光合作用均与其叶片上气孔有着直接的关系,气孔具有副卫细胞、保卫细胞和气室的结构[8, 9, 10, 11, 12]。气孔的开启、闭合与保卫细胞的吸水失水有关,也与光照的强弱有关,这些生态因素对三叶青的生长过程中蒸腾作用、光合作用起到正面或负面效应,最终影响到其药效成分的高低。
1 材料和方法 1.1 材料实验材料为福建闽侯、顺昌和浙江台州产地的三叶青叶片,选择采摘植株的生理年龄为1年。实验于2012年9月15日在福建农林大学科技园基地进行,实验插穗来自浙江省台州市和福建省南平市顺昌县人工栽培的三叶青、以及福建省福州市闽侯县的野生三叶青以扦插栽培模式,栽培时间为2012年9月15日~2013年10月1日。由于每年9月是三叶青的最佳生长时期,(28±2)℃为最佳生长温度[1],而福州地区每年10月上旬气温在(28±2)℃。因此,采集与光合测试的时间均选择2013年10月1日上午,气温为30 ℃。同时,叶片采集位置分别于植株的顶端、中部、底端,以便更好观测植株的气孔变化。
1.2 仪器与试剂 1.2.1 仪器电子天平、-40 ℃超低温冰箱、LGJ 1.5冷冻干燥机、6380 Lv扫描电镜、镀金膜仪器、LI-6400便携式光合作用测定仪。
1.2.2 试剂二水磷酸氢二钠、七水磷酸氢二钠、十二水磷酸氢二钠、二水磷酸二氢钠、一水磷酸二氢钠、25%戊二醛、无水乙醇均为分析纯,纯水。
1.3 气孔观察法 1.3.1 固定液制备量取40.5 mL 0.2 mol/L磷酸氢二钠贮备液、9.5 mL 0.2 mol/L磷酸二钠贮备液混匀成0.2 mol/L 磷酸缓冲液(pH值为7.4),再量取10 mL 2.5%戊二醛固定液(量取90 mL 0.135 mol/L磷酸缓冲液,再取10 mL 25%戊二醛均匀混合)混合,加纯水定容至100 mL。
1.3.2 固定用含有微量水分棉球轻擦去不同品种叶表的尘埃,保持新鲜叶片的状态。浸泡置于固定液24 h,注意叶片一定要完全浸没在固定液中,维持采集时刻的叶肉细胞状态。
1.3.3 切片从不同产地的三叶青不同位置(顶端、中部、底端)的叶片上,取1 cm×1 cm叶块,注意不要切入叶脉。
1.3.4 脱水将固定好的样品用0.135 mol/L磷酸缓冲液或纯水冲洗3次,每次5~10 min。再将样品依次置于30%、50%、70%、80%、90%、100%乙醇溶液中脱水置换,两级间隔时间一般为10~15 min,置于70%无水乙醇过夜,在100%无水乙醇中不宜过长时间,否则细胞会失水收缩变形。
1.3.5 冷冻干燥将脱水后的样品置于-40 ℃超低温冰箱过夜,冷冻干燥处理24 h。
1.3.6 镀膜-导电(金属镀膜法)用镊子将样品需要观察的一面朝上粘贴,镀金15~30 min。
1.3.7 气孔观察将样品台置于6380 Lv扫描电镜的样品台架,设置加速电压15.0 kV,分别在300倍视野和4 500倍视野下观察气孔结构和分布规律,分析样品表皮每平方毫米的气孔数量[13]。
1.4 光合测定选10月份上午10点于30 ℃温度条件下,采用LI-6400便携式光合作用测定仪设定光照强度在0~2 000 μmol/(m2·s) 内的蒸腾速率、净光合速率、气孔导度,同光照强度测定次数:3次/片,取其平均数值。根据以上数值,分析叶片间水分利用率(水分利用率=净光合速率/蒸腾速率)与光照强度间变化趋势[14, 15]。
1.5 数据分析使用Excel与DPS软件对实验数据进行分析。
2 结果与分析 2.1 气孔类型与分布采用扫描电镜观察各品种的叶片表皮气孔形态,图 1可看出,叶片的上表皮和叶脉均无气孔存在;其下表皮存在气孔,平行分布,气孔位于细胞中央,副卫细胞的长轴与保卫细胞的长轴相互平行。典型的环绕类型气孔,一个副卫细胞围绕2个尖帽型保卫细胞,气孔完全张开呈纺锤形,副卫细胞外壁呈光滑、突起。
 | 图 1 不同产地的样品叶片上表皮 Fig.1 Upper epidermis of T. hemsleyanum from different habitats |
图 2可看出,副卫细胞外壁薄,而保卫细胞两端细胞壁薄、中间细胞壁厚。气孔的开启与闭合动力与保卫细胞的膨胀与压缩变化有关。当保卫细胞吸收水分时,细胞壁膨胀开来,保卫细胞也相应膨胀开向一边弯曲,导致气孔口张开。此时,植物吸收大量CO2进行光合作用,增加植物体内的能量,促进三叶青的生长。光照强度高时,植物为了保持细胞内水分,气孔闭合。
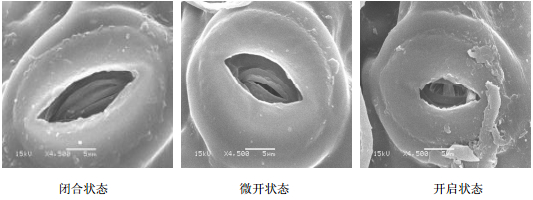 | 图 2 三叶青叶片气孔状态 Fig.2 Stomata status of leaves of T. hemsleyanum |
选择在30 ℃,观察植株不同位置的叶片气孔状态,判定不同产地样品所需的栽培光照度是否一致。图 3可看出,福建闽侯产地样品顶端单叶片的气孔均张开,最大直径4.8 μm,长轴11.0 μm;中部单叶片的气孔微开,少数气孔闭合,张开直径2.3 μm,长轴5.0 μm;底端单叶片的气孔大部分闭合,少数气孔张开,张开直径2.0 μm以下,长轴3.0 μm以下。福建顺昌产地样品顶端单叶片的气孔均张开最大,直径均8.0 μm,长轴均13.0 μm;中部单叶片的极少气孔闭合,张开直径3.8 μm,长轴7.0 μm;底端单叶片的气孔部分闭合,其余气孔微开,直径2.0 μm以下,长轴5.0 μm以下。浙江台州产地样品顶端单叶片的气孔均闭合,少数气孔微开,直径1.0 μm,长轴均4.0 μm以下;中部单叶片的气孔微开,少数气孔闭合,张开直径均2.3 μm以下,长轴5.0 μm;底端单叶片的气孔均张开,其余气孔微开,直径3.0 μm,长轴7.0 μm。依据不同光温条件对三叶青总黄酮量的研究结果,可知30 ℃温度且24 h/d时总黄酮量为最高(20.23 mg/g),黑暗处理时总黄酮量为4.39 mg/g[4]。由此可见,福建闽侯和顺昌产地适合在30 ℃温度下生长,气孔张开;而浙江台州产地在30 ℃温度时出现光合午休现象,气孔关闭。
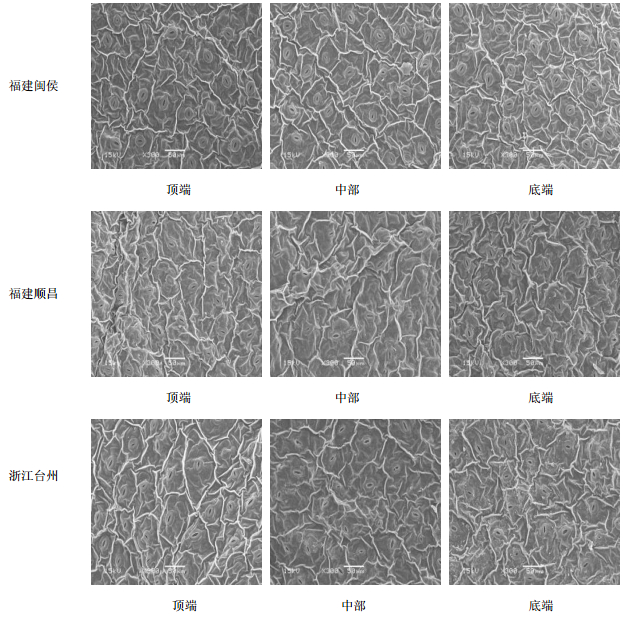 | 图 3 不同产地三叶青叶片下表皮气孔形态 Fig.3 Stomatal shape of lower epidermis in leaves of T. hemsleyanum from different habitats |
通过图 1和图 3对比可知,同种材料的上下表皮气孔数目存在明显不同。因此,根据每个产地样品材料的3个视野中每平方毫米上下表皮中的气孔数目进行计算与分析得出,福建闽侯产地样品上表皮气孔均为0个/mm2,下表皮气孔数量平均为213个/mm2;福建顺昌产地样品上表皮气孔数量均为0个/mm2,下表皮气孔数量平均为220个/mm2;浙江台州产地样品上表皮气孔均数量为0个/mm2,下表皮气孔平均数量为230个/mm2。3个产地样品的三叶青气孔数目差异不大(P>0.05),其上下表皮中气孔数目差异明显(P<0.01)。
2.4 不同光照强度下3个产地样品净光合速率分析从图 4可知,在不同光照条件下 [≤2 000 μmol/(m2·s)],福建闽侯、浙江台州产地样品叶片在500 μmol/(m2·s) 弱光时净光合速率最高;福建顺昌产地样品叶片在1 800 μmol/(m2·s) 强光时净光合速率达到最高。
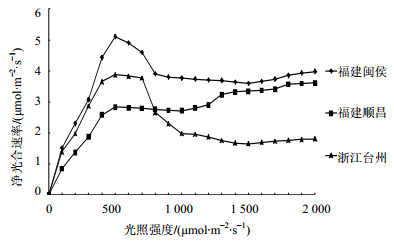 | 图 4 叶片的净光合速率-光照强度曲线 Fig.4 Curves of net photosynthetic rate light intensity of leaves |
样品叶片的净光合速率随着光照强度增大而增加;福建闽侯产地样品叶片的净光合速率随着光照强度增大而先升高后降低。浙江台州产地样品叶片的净光合速率随着光照强度增大而先升高后快速降低,之后稳定。3种产地样品叶片的净光合速率均在1 000 μmol/(m2·s) 光照强度时出现减低而后增加或趋于平稳,但是福建顺昌产地样品与其他2种相比,显示出其适应光照度较强,细胞失水现象不明显。在1 000 μmol/(m2·s) 光照强度时,三叶青出现光合午休现象,维持植物体内水分。
对不同光照强度的3个产地样品叶片的净光合速率进行二因素无重复方差分析,结果见表 1和2。
| 表 1 不同产地对三叶青的净光合速率影响的LSD多重分析 Table 1 LSD multiple analysis onamounts of leavesnet photosynthetic rate of T. hemsleyanumfrom different habitats |
| 表 2 不同光照强度对三叶青的净光合速率影响的LSD多重分析 Table 2 LSD multiple analysis on amounts of leaves net photosynthetic rate of T. hemsleyanumfrom different habitats |
结果表明,福建闽侯产地样品对叶片的净光合速率的提高有较大帮助,且在400~700 μmol/(m2·s)光照强度与0、100 μmol/(m2·s) 光照强度处理后相比表现为差异极显著,而其他光照强度处理对叶片的净光合速率的影响差异不显著,这与光照强度处理后叶片净光合速率曲线图的变化一致。
2.5 叶片蒸腾速率从图 5可知,在不同光照条件下 [≤2 000 μmol/(m2·s)],福建闽侯、顺昌和浙江台州产地样品叶片均在1 000 μmol/(m2·s) 弱光时蒸腾速率最小,表皮细胞中水分损失最少,此时,气孔起到调节光合与蒸腾作用功能。在500~1 000 μmol/(m2·s) 光照强度时,福建闽侯、顺昌产地样品叶片的蒸腾速率趋于接近。随着光照强度增大,浙江台州产地样品叶片的蒸腾速率在500 μmol/(m2·s) 光照强度时出现降低,之后在1 000~2 000 μmol/(m2·s) 光照强度时出现缓增,整体波动大;福建闽侯产地样品叶片的蒸腾速率在500~2 000 μmol/(m2·s) 光照强度之间波动不大,趋于平稳;福建顺昌产地样品叶片的蒸腾速率在500~2 000 μmol/(m2·s) 趋于递增。
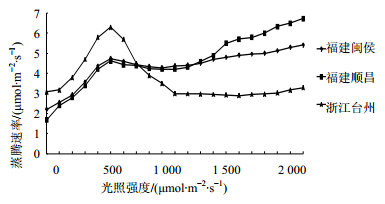 | 图 5 叶片的蒸腾速率-光强曲线 Fig.5 Curves of light intensity in leaves transpiration rate |
对不同光照强度的3个产地样品叶片的蒸腾速率进行二因素无重复方差分析,结果见表 3和4。
| 表 3 不同产地对三叶青的蒸腾速率影响的LSD多重分析 Table 3 LSD multiple analysis on leaf transpiration rate of T.hemsleyanum different habitat regions |
| 表 4 不同光照强度对三叶青的蒸腾速率影响的LSD多重分析 Table 4 LSD multiple analysis on leaf transpiration rate of T. hemsleyanum with different light intensity |
结果表明,闽侯产地样品对叶片的蒸腾速率的提高有较大帮助,且500、600、1 900、2 000 μmol/(m2·s) 光照强度与0、100 μmol/(m2·s) 光照强度处理后相比呈差异极显著(P<0.01),而其他光照强度处理对叶片的蒸腾速率的影响差异不显著,这与光照强度处理后叶片蒸腾速率曲线图的变化一致。
2.6 叶片气孔导度从图 6可知,在0~2 000 μmol/(m2·s) 光照强度范围内,福建闽侯产地样品叶片的气孔导度变化趋势较平稳,顺昌产地样品叶片的气孔导度变化趋势递增,台州产地样品叶片的气孔导度变化趋势先升后降再趋于平稳,并且3个产地样品叶片的蒸腾速率变化趋势与气孔导度变化趋势均相似。在1 000 μmol/(m2·s) 光照强度时,3个产地样品叶片的气孔导度变化趋势最低点,这现象与蒸腾速率变化趋势、净光合速率变化趋势一致。
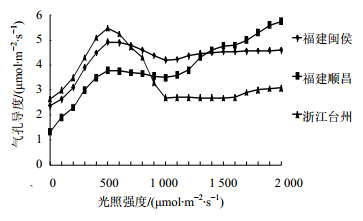 | 图 6 叶片的气孔导度-光强曲线 Fig.6 Curves of stomatal conductance light intensity of leaves |
对不同光照强度的3个产地样品叶片的气孔导度进行二因素无重复方差分析,结果见表 5和6。
| 表 5 不同产地样品对三叶青的气孔导度影响的LSD多重分析 Table 5 LSD multiple analysis on stomatal conductance of T.hemsleyanum different habitat regions |
| 表 6 不同光照强度对三叶青的气孔导度影响的LSD多重分析 Table 6 LSD multiple analysis on stomatal conductance of T. hemsleyanum with the different light intensity |
结果表明,闽侯产地样品对叶片的气孔导度的提高有较大帮助,且400~700、1 900、2 000 μmol/(m2·s) 与0、100 μmol/(m2·s) 光照强度处理相比差异呈极显著差异(P<0.01),而其他光照强度处理对叶片的气孔导度的提高影响差异不显著,这与光照强度处理后叶片气孔导度曲线图的变化一致。
2.7 叶片水分利用率在三叶青的生长发育过程中,叶片的水分平衡对植物的生长极其重要,影响到叶片的光合作用和蒸腾作用以及气孔的调节功能。叶片水分利用率是叶片内蒸散消耗单位量水所制造的干物质量,反映出叶片水势对净光合速率和蒸腾速率的影响程度,是蒸腾系数的倒数,从而影响到三叶青植物体内水分散失和碳固定的平衡点。蒸腾耗水量又可视为生理需水量,以蒸腾系数来表示。
从图 7可知,用公式光合速率/蒸腾速率表示单叶片间水分利用率曲线。在0~500 μmol/(m2·s) 光照强度时,3个产地样品单叶片间水分利用率随着光照强度增强而增加。在500~2 000 μmol/(m2·s) 光照强度时,顺昌、台州产地样品单叶片间水分利用率相当,其中在1 000 μmol/(m2·s) 光照度出现
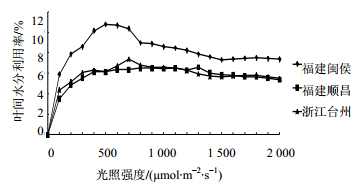 | 图 7 叶片水分利用率-光照强度曲线 Fig.7 Curves of water utilization ratio-light intensity in leaves |
水分利用率下降现象,下降幅度不大,整体变化趋于平稳。闽侯品种单叶片间水分利用率随着光强增强而先急剧下降后缓慢上升,而在500~1 000 μmol/(m2·s) 光照强度时出现大幅度下降,与气孔导度变化趋势一致,说明叶片细胞间水分散失降低,蒸腾速率和光合速率减缓。同时,可得出在500 μmol/(m2·s) 光照强度条件下,三叶青植物的生理需水量最小。
对不同光照强度的3个产地样品叶片的水分利用率进行二因素无重复方差分析,结果见表 7和8。
| 表 7 不同产地对三叶青的叶片水分利用影响的LSD多重分析 Table 7 LSD multiple analysis on leaf water use efficiency of T. hemsleyanum from different habitat regions |
| 表 8 不同光照强度对三叶青的叶片水分利用影响的LSD多重分析 Table 8 LSD multiple analysis on leaf water use efficiency of T. hemsleyanum with the different light intensity |
结果表明,闽侯产地样品对叶片水分利用率高,且600、700 μmol/(m2·s) 光照强度与0、100 μmol/(m2·s) 光照强度处理后相比表现为差异极显著(P<0.01),而其他光照强度处理对叶片的净光合速率的影响差异不显著,这与不同光照强度处理后叶片净光合速率曲线图的变化一致。
3 讨论 3.1 三叶青的气孔结构本实验在30 ℃温度时观察不同产地样品叶片的气孔状态,发现在福建顺昌产地样品植株不同部位的叶片的气孔均张开;福建闽侯产地样品植株仅顶端位置叶片的气孔张开;浙江台州产地样品植株仅底端位置叶片的气孔张开。实验表明,三叶青植物仅在叶片的下表皮平行分布着环绕类型气孔,副卫细胞外壁呈光滑、突起,气孔完全张开呈纺锤形。
3.2 三叶青蒸腾作用的研究本实验对不同产地样品三叶青植物的气孔变化与蒸腾速率进行对比,采用二因素无重复方差分析,表明福建顺昌、闽侯产地样品的差异性均具有显著性差异。福建闽侯产地样品三叶青的光饱和点为600 μmol/(m2·s),光合速率与蒸腾速率均最高,水分利用率最高,有利于块根生长,促进植株体内黄酮类化合物积累。福建顺昌产地样品三叶青的光饱和点为1 900 μmol/(m2·s),维持植物体内水分,光合速率与蒸腾速率均最高,促进植物体内呼吸作用、光合作用和蒸腾作用转化。
本研究显示,药用植物气孔的开闭变化与蒸腾速率、净光合速率、气孔导度以及叶间水分利用率的变化曲线是一致。在相同温度条件下,不同品种、不同生长部位的药用植物叶片气孔呈现出不同形态。不同光照强度对不同产地样品叶片的蒸腾作用、气孔导度、光合作用影响较大,体现了中药材道地性优势。进而得出不同产地植物所需的最优光照强度,确定不同产地植物所需的最优栽培条件。因此,本研究得到了不同产地三叶青的气孔变化、光合作用以及蒸腾作用的规律,为人工栽培技术奠定了可靠的依据。
| [1] | 陈瑞云. 特色中药材栽培技术 [M]. 福州: 福建科学技术出版社, 2011. |
| [2] | 彭 昕, 林言娜, 何军邀, 等. 培养条件对三叶青愈伤组织生长及总黄酮含量的影响 [J]. 药物生物技术, 2012, 19(2): 138-141. |
| [3] | 钟毓倩. 三叶青的组织培养与快速繁殖研究 [J]. 浙江中医杂志, 2007, 42(6): 363. |
| [4] | 钱丽华, 毛碧增. 光温条件对三叶青愈伤生长及黄酮积累的影响 [J]. 浙江农业科学, 2013, 1(9): 1098-1100. |
| [5] | 程 伟, 陆曙梅. 三叶青提取物对肺癌A549细胞的体外抑制作用 [J]. 中国实验方剂学杂志, 2007, 13(10): 53-56. |
| [6] | 符渊淼. 药用植物三叶青的种质鉴定和组培快敏研究 [D]. 杭州: 浙江大学, 2012. |
| [7] | 杨 华, 宋绪忠, 陈 磊. 不同遮阴处理的三叶崖爬藤光合作用特性 [J]. 林业科技开发, 2010, 24(5): 57-59. |
| [8] | 杨 洋, 马三梅, 王永飞. 植物气孔的类型、分布特点和发育 [J]. 生命科学研究, 2011, 15(6): 550-555. |
| [9] | 高华娟, 陈信云. 药用植物气孔之探析 [J]. 海峡药学, 2011, 23(7): 55-57. |
| [10] | 杨 芳, 蒲 训. 植物气孔类型初步分类考证 [J]. 现代农业科技, 2010, 1(22): 193-196. |
| [11] | Zhang D X, Xiang T H, Li P H, et al. Transgenic plants of Petunia hybrida harboring the CYP2EJ gene efficiently remove benzene and toluene pollutants and improve resistance to formaldehyde [J]. Gen Mol Biology, 2011, 34(4): 634-639. |
| [12] | Shkryl Y N, Veremeichik G N, Bulgakov V P, et al. Individual and combined effects of the rolA, B, and (genes on anthraquinone production in Rubia cordifolia transformed calli [J]. Biot Bioen, 2008, 100(1): 118-125. |
| [13] | 邱东萍, 丁 鸿, 齐丽霞. 阴生植物和阳生植物气孔数量比较分析 [J]. 山东农业科学, 2010, 1(8): 41-43. |
| [14] | 陈洪国. 四种常绿植物蒸腾速率、净光合速率的日变化及对环境的影响 [J]. 福建林业科技, 2006, 33(1): 76-79. |
| [15] | 董泽军. 植物蒸腾作用高速率之原因 [J]. 中国农学通报, 2010, 26(21): 131-135. |
 2015, Vol. 46
2015, Vol. 46


