2. 吉林农业大学生命科学学院, 吉林 长春 130118
2. College of Life Science, Jilin Agricultural University, Changchun 130118, China
红花黄色素(safflor yellow,SY)是红花Carthamus tinctorius L. 的主要有效成分之一,具有扩张血管、改善心肌供血、抑制血小板聚集、抑制血栓形成、修复血管内皮损伤、抗氧化等多种药理作用,被广泛应用在冠心病、高血压、脑梗死、抗肿瘤、糖尿病并发症、慢性肾病等疾病[1, 2]。目前,红花黄色素制剂已经被批准上市广泛应于治疗临床,红花黄色素需求量较大。因此,虽然红花的种植面积在我国不断扩大,但仍未能解决红花黄色素资源匮乏问题。因此,提高红花自身黄色素量,培育高产黄色素的红花新品系,具有重要经济意义。
红花黄色素属于植物次生代谢产物黄酮类化合物。植物黄酮类生物合成途径主要由2类基因控制:结构基因和调节基因。其中,结构基因直接编码与黄酮类次生代谢生物合成有关的各种酶类,其中查耳酮合酶(chalcone synthase,CHS)和查耳酮异构酶(chalcone isomerase,CHI)基因被认为是黄酮类化合物代谢的关键酶和限速酶[3],而调节基因则是控制结构基因表达强度和表达方式的一类基因。通过转录因子作用,可以直接激活整个代谢通路,有可能激活类黄酮次生代谢途径中多个结构基因的表达,达到的效果将比导入某个结构基因的作用更明显。
近年来,有关植物黄酮类化合物生物合成的研究取得了很大进展,参与植物类黄酮代谢调控的转录因子(MYB)大多为R2R3型,部分基因已被克隆、验证[4, 5, 6, 7]。关于红花黄色素的研究仅报道了几个关键酶基因,如CHI、IEO、FLS[8, 9, 10, 11]。而关于MYB的研究特别是MYB参与黄酮类化合物生物合成过程还未见报道。本研究用新一代测序技术(Illumina/Solexa sequnceing)对红花花瓣的转录组进行测序[12],并以测序文库中高表达的Uingene-
123933片段为基础,利用RT-PCR和RACE技术克隆红花CtMYB1基因的cDNA序列并对其进行生物信息学分析;将基因CtMYB1的开放阅读框(ORF)序列插入表达载体pEASY-E1,构建原核表达载体pEASY-E1-CtMYB1,利用IPTG 诱导并纯化重组蛋白,从而获得了CtMYB1蛋白,以期为实现CtMYB1蛋白的高水平表达,进而为研究探索MYB在红花中的具体生物化学及分子生物学功能奠定基础,特别是黄色素生物合成中的调控作用机制奠定基础。
1 材料与方法 1.1 材料样品采自吉林农业大学种植基地,经吉林农业大学胡全德教授鉴定为红花Carthamus tinctorius L.。
1.2 方法 1.2.1 RNA提取和cDNA合成将红花花瓣置于液氮中研碎,总RNA提取方法按照Trizol试剂说明书进行;并于−80 ℃保存备用。cDNA合成根据Biotek公司反转录试剂盒操作进行,反转录产物分离纯化后置于−20 ℃保存备用。
1.2.2 MYB基因中间cDNA序列的克隆根据Illumina测序(数据已上传至NCBI Short Read Archive数据库,登录号SRA047279.2)获得的红花转录组序列中高表达的Unigene123933(660 bp),按照引物设计原则,采用引物设计软件 Primer 5.0,对红花转录组序列中的MYB基因序列设计引物(MYB-F、MYB-R)(引物序列见表 1)。以反转录后的cDNA为模板进行中间cDNA序列的PCR扩增,反应程序为94 ℃预变性5 min;94 ℃、30 s,58 ℃、30 s,72 ℃、30 s,30个循环;72 ℃、10 min,4 ℃终止反应。PCR产物用10 g/L琼脂糖凝胶电泳进行检测。将目的片段进行切胶回收后,PCR 产物与克隆载体pEASY-T1连接并转化至大肠杆菌DH5α感受态细胞,挑取单菌落进行菌液PCR鉴定,并将阳性克隆送交生工生物工程(上海)股份有限公司测序。
| 表 1 扩增红花MYB基因及RT-PCR所用的引物序列 Table 1 Primers used for amplification of MYB gene and RT-PCR |
cDNA 3’和5’末端克隆 3’RACE和5’RACE第一链的合成按照公司试剂盒使用说明进行。根据MYB基因中间cDNA序列设计3’RACE和5’RACE引物(引物序列见表 1),进行PCR扩增。取10 μL PCR产物用10 g/L琼脂糖凝胶电泳检测,对PCR扩增得到的特异条带进行克隆鉴定后送交生工生物工程(上海)股份有限公司测序。
1.2.4 CtMYB1基因的克隆及序列分析将目的基因中间片段和3’RACE和5’RACE扩增片段相拼接,获得理论上的基因全长序列,根据基因编码区序列特异引物M1、M2(引物序列见表 1),以红花花瓣cDNA为模板进行PCR扩增。反应程序为94 ℃预变性5 min;94 ℃、30 s,60 ℃、1 min,72 ℃、1 min,30个循环;72 ℃、10 min,4 ℃终止反应。将目的条带切胶回收后克隆至pEASY-T1载体并进行测序,分析测序结果与所拼接得到的全长序列的一致性。利用DNAMAN软件,对目的基因与已知其他植物MYB基因的氨基酸序列进行生物信息学分析。
1.2.5 CtMYB1原核表达载体的构建与鉴定以测序结果正确的、含有目的基因的质粒为模板,利用引物M1、M2进行PCR扩增。将扩增得到的CtMYB1基因ORF片段切胶回收后与pEASY-E1载体按照4∶1混合后,25 ℃连接10 min,转化大肠杆菌感受态Trans-T1,构建重组质粒pEASY-E1-CtMYB1。挑取单菌落,以载体上T7P引物和目的基因引物M2进行菌液PCR验证。将测序正确的重组质粒pEASY-E1-CtMYB1转化至E. coli BL21(DE3)表达菌株,以载体上T7T引物和目的基因引物M1进行菌液PCR验证。
1.2.6 红花CtMYB1的原核表达及检测挑取已鉴定的阳性克隆,在10 mL含有50 μg/mL氨苄青霉素的LB液体培养基中37 ℃条件下180 r/min震荡培养,在600 nm吸光度(A600)达到1.0时,1 mol/L IPTG分别诱导4 h,收集2 mL菌液,将收集的菌体4 ℃,12 000 r/min离心5 min,弃上清,向沉淀中加入200 μL PBS缓冲液,充分混匀后加入50 μL 5×SDS上样缓冲液,100 ℃煮沸10 min,4 ℃冷却。取15 μL蛋白样品上样,12% SDS-PAGE电泳检测。
2 结果与分析 2.1 CtMYB1基因的cDNA全长的获得及序列分析利用NanoDrop分析仪进行纯度及浓度测定,RNA的质量浓度在1 000 μg/μL左右,且A260/A280在1.9左右,表明提取的RNA质量较好。以红花花瓣RNA反转录的cDNA为模板,MYB-F和MYB-R为引物,扩增出一条250 bp的单一特异性条带(图 1-A)。回收纯化产物后经测序与预期结果一致。用所设计的2条特异引物(3F和3R)参照试剂盒说明进行3’RACE PCR反应,PCR得到长度为500 bp左右的目的条带(图 1-B),经克隆、测序结果表明获得了CtMYB1基因的3’末端,该片段长318 bp,包含有终止密码子。用所设计的2条特异引物(5F和5R)参照试剂盒说明进行5’RACE PCR反应,PCR得到长度为700 bp左右的目的条带(图 1-C)。经克隆、测序结果表明获得了CtMYB1基因的5’末端,该片段长295 bp,包含有起始密码子。根据3’RACE和5’RACE测序结果拼接得到CtMYB1基因,最终获得一条893 bp的cDNA全长序列(图 2),利用ORF Finder在线软件分析发现,CtMYB1基因包含一个长度为750 bp的开放阅读框(ORF),5’非翻译区长93 bp,3’非翻译区长50 bp。
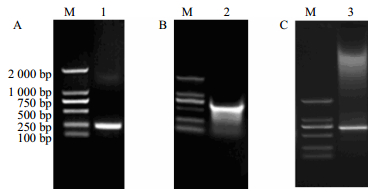 |
M-Marker 1-CtMYB1 特异片段扩增产物 2-3’RACE 扩增产物3-5’RACE 扩增产物 M-Marker 1-amplification product of MYB partial fragment 2-amplification product of 3’RACE 3-amplification product of 5’RACE 图 1 CtMYB1 基因的 PCR 扩增结果 Fig.1 PCR amplification of CtMYB1 |
 |
“ ***”标记的碱基序列为 MYB 基因的起始密码子;“ ”标记的碱基序列为 MYB 基因的终止密码子 “***”marked base sequence is start codon of MYB and “ ”marked base sequence is stop codon of MYB 图 2 CtMYB 基因全长序列 Fig.2 Full length sequence of MYB from C. tinctorius |
根据基因编码区序列特异引物(M1、M2),以红花花瓣cDNA为模板扩增出1条750 bp的条带(图 3),命名该基因为CtMYB1(GenBank 登录号为KJ524853)。利用ExPASy Proteomics Server的在线软件 Protparam预测MYB编码蛋白的理化性质。CtMYB1码蛋白包含249个氨基酸,分子式为C1220H1930N358O378S13,总原子数为3 899;相对分子质量为28 077.7;理论等电点(pI):7.14。
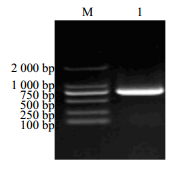 |
M-Marker 1-CtMYB1 基因 ORF 扩增产物 M-Marker 1-ORF amplification products of CtMYB1 gene 图 3 MYB 基因 ORF 的 PCR 扩增 Fig.3 ORF Amplification product of MYB gene full length by PCR |
采用SWISS-MODELSOPMA进行MYB的编码蛋白二级结构分析和结构域预测MYB的编码蛋白二级结构中α-螺旋(alpha helix)占27.71%、延伸链(extended strand)占18.88%、无规则卷曲(random coil)占42.97%(图 4)。
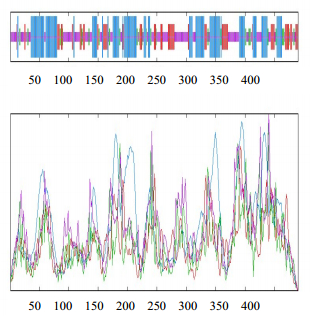 | 图 4 红花 CtMYB1 蛋白二级结构 Fig.4 Predicted secondary structure of CtMYB1 protein from C. tinctorius |
跨膜螺旋分析表明该蛋白为膜外蛋白。用DictyOGlyc在线工具对蛋白的糖基化位点进行预测。根据P值大于0.5即为存在糖基化位点为评分标准,CtMYB1蛋白仅存在1糖基化位点,是位于第159位的丝氨酸(Ser)。在SWISS-MODEL依据保守结构域作图工具中,对CtMYB编码蛋白进行三维结构建模(图 5),结果显示CtMYB编码蛋白是由6个α-螺旋条带简单的缠绕在无规则卷曲上的简单结构。
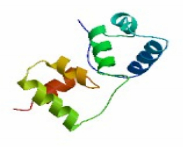 | 图 5 CtMYB1 蛋白预测的三级结构 Fig.5 Predicted tertiary structure of CtMYB1 protein from C.tinctorius |
将克隆得到的红花CtMYB1基因的氨基酸序列与NCBI网站相关序列进行比对分析,结果表明,红花CtMYB1基因与其他植物有着较高的同源性。比较CtMYB1蛋白与已报道的MYB蛋白氨基酸序列的R2、R3区域,发现CtMYB蛋白在N端具有2个典型的MYB DNA结合域cd00167(DNA-binding domains),即R2、R3结构域,为典型的R2R3MYB转录因子,第17、37、57、89、108位的色氨酸(W)为保守氨基酸(图 6)。上述结果表明,CtMYB1符合R2R3-MYB类转录因子的特征,表明CtMYB1属于MYB基因家族。与其他植物的MYB序列的比对分析,构建系统发育树(图 7)。结果表明,CtMYB1确实属于MYB家族,与非洲菊MYB(CAD87009.1)具有较高的同源相似性,同源性达到55%。
 |
横线部分为 R2、R3 结构域;“★”表示 R2、R3 结构域中保守的第 17、37、57、89、108 位氨基酸 solid line shows R2 and R3 domains; “★” indicates conservative 17th, 37th, 57th, 89th, and 108th amino acids in R2 and R3 domains 图 6 CtMYB 与其他植物 MYB 蛋白 R2、R3 结构域的同源性比较 Fig.6 Alignment of R2 and R3 domains in MYB proteins from C. tinctorius and other plants |
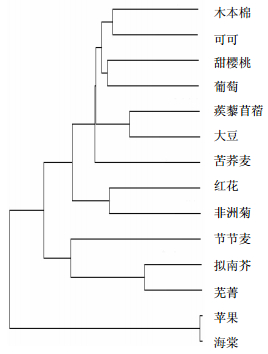 | 图 7 CtMYB1 与其他物种 MYB 氨基酸序列的系统进化树分析 Fig.7 Phylogenetic tree of CtMYB1 from C. tinctorius and MYB amino acid sequence from other plants |
菌液PCR获得一条1 000 bp左右特异性片段(图 8),表明扩增的CtMYB1片段已插入载体质粒中。同时测序结果表明,连入表达载体pEASY-E1中的基因片段与目的序列一致,未出现碱基突变和移码现象。结果表明,已获得正确的CtMYB1的原核表达质粒,编码包括6个组氨酸(His)在内的267个氨基酸的重组蛋白。重组质粒转化大肠杆菌感受态BL21(DE3)后,菌液PCR鉴定获得大小1 000 bp左右的目的条带,表明重组质粒成功转入大肠杆菌感受态BL21中(图 9)。
 |
1-阴性对照 2~4-pEASY-E1-CtMYB1 菌 M-Marker 1-negative control 2—4-pEASY-E1-CtMYB1 bacteria M-Marker 图 8 pEASY-E1-CtMYB1 菌液 PCR 验证 Fig.8 PCR verification of pEASY-E1-CtMYB1 bacteria solution |
 |
1-pEASY-E1-CtMYB1 BL21 菌 2-阴性对照 M-Marker 1-pEASY-E1-CtMYB1 BL21bacteria 2-negative control M-Marker 图 9 表达载体 pEASY-E1-CtMYB1 转化 BL21 的 PCR 鉴定 Fig.9 PCR verification on DNA of E. coli BL21 transformed with expression vector pEASY-E1-CtMYB1 |
由12% SDS-PAGE电泳结果可知(图 10),与未诱导的pEASY-E1-CtMYB1重组菌相比,IPTG诱导的pEASY-E1-CtMYB1重组菌在30 000处出现目的条带。CtMYB1基因的ORF由249个氨基酸组成,编码27 400的蛋白,而原核表达载体pEASY-E1的His-Tag标签的大小1 980,所以重组表达载体编码的蛋白大小约为30 000。结果初步表明含有CtMYB1基因的重组质粒在大肠杆菌中已成功表达。
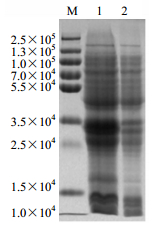 |
M-Marker 1-诱导 E. coli 2-未诱导 E. coli M-Marker 1-inducted E. coli 2-uninducted E. coli 图 10 pEASY-E1-CtMYB1 的 SDS-PAGE 电泳分析 Fig.10 Analysis of pEASY-E1-CtMYB1 fusion protein expression by SDS-PAGE |
药用植物次生代谢产物是天然药物的主要来源,但其在植物体内量低。通过基因转化、次生代谢工程等技术可实现大规模获得目标次生代谢产物[13, 14]。MYB蛋白作为调控因子,参与黄酮类化合物生物合成并发挥重要的作用,是目前植物黄酮类化合物代谢分子生物学领域研究的热点之一。目前已得到功能验证的MYB基因还是少数,还有很大的空间有待探索,尤其是植物体在不同环境条件下黄酮类化合物在种类和量上的调节,以及调控机制。
基因克隆是研究基因功能的基础,已有报道利用转录组测序筛选参与重要次生代谢产物生物合成MYB基因并研究其功能,如杉木[15]、萝卜[16]、龙胆[17]、吊兰[18]、芜菁[19]等。本研究在红花转录组测序结果的基础上克隆1个新的红花MYB基因,为红花在红花黄色素合成代谢调控方面的深入研究奠定理论基础。
研究表明,MYB转录因子可以与多种顺式作用元件结合,调控下游基因的表达。目前,多采用体外凝胶迁移(EMSA)来鉴定蛋白与元件的作用情况[20, 21, 22]。为了获得纯化的转录因子蛋白,最有效的方法就是通过原核表达系统在大肠杆菌中大量表达目的重组蛋白,再通过重组蛋白上的表达序列标签对目的蛋白进行纯化。选择合适的表达载体和表达菌株是外源基因高效表达及纯化的关键。该实验选用pEASY-E1作为载体,其含有6×His Tag作为纯化标记,成功构建原核表达载体并转化大肠杆菌感受态BL21(DE3)。表达的重组蛋白经Ni柱即可一步纯化回收,大大简化了蛋白纯化的操作步骤,并且融合标签蛋白相对分子质量较小,不会改变蛋白的生物活性。本课题初步验证含有CtMYB1基因的重组质粒在大肠杆菌中已成功表达约30 000的重组蛋白。后续将通过对原核表达条件的优化获得CtMYB1蛋白,实现CtMYB1蛋白的高水平表达,纯化该蛋白用于EMSA来鉴定CtMYB1蛋白与元件的作用情况及植物体内CtMYB1蛋白表达水平的检测,为后期进一步研究红花转录因子CtMYB1的生物化学和分子生物学功能奠定基础。
| [1] | 周文君, 冯 晶. 红花黄色素治疗不稳定型心绞痛的临床观察 [J]. 药物评价研究, 2014, 37(6): 548-550. |
| [2] | 石宁宁,程春生,查朱青, 等. 红花注射液防治游离皮瓣移植术后血管危象的临床研究 [J]. 中国中西医结合杂志, 2011, 31(10): 1322-1327. |
| [3] | Cheng H, Li L, Cheng S, et al. Molecular cloning and function assay of a chalconeisomerase gene (GbCHI) from Ginkgo biloba [J]. Plant Cell Rep, 2011, 30(1): 49-62. |
| [4] | Bovy A, de Vos R, Kemper M, et al. High-flavonol tomatoes resulting from the heterologous expression of the maize transcription factor genes LC and C1 [J]. Plant Cell, 2002(14): 2509-2526. |
| [5] | Mehrtens F, Harald K, Pawel B, et al. The Arabidopsis transcription factor MYB12 is a flavonol-specific regulator of phenylpropanoid biosynthesis [J]. Plant Physiol, 2005(138): 1083-1096. |
| [6] | Espley R V, Hellens R P, Putterill J, et al. Red colouration in apple fruit is due to the activity of the MYB transcription factor, MdMYBl0 [J]. Plant J, 2007, 49(3): 414-427. |
| [7] | Pattanaik S, Kong Q, Zaitlin D, et al. Isolation and functional characterization of a floral tissue-specific R2R3 myb regulator from tobacco [J]. Planta, 2010, 231(5): 1061-1076. |
| [8] | 刘秀明, 杨文婷, 王 南, 等. 红花黄酮化合物合成途径关键酶基因的分离与表达分析 [A]//2013全国植物生物学大会论文集 [C]. 南京: 中国科技出版社, 2013. |
| [9] | 杨文婷, 刘秀明, 姚 娜, 等. 红花黄酮醇合酶基因植物表达载体构建及转化 [A]//2013全国植物生物学大会论文集 [C]. 南京: 中国科技出版社, 2013. |
| [10] | 康亚兰, 裴 瑾, 刘 薇, 等. 红花查尔酮合成酶基因的克隆、生物信息学分析及表达 [J]. 中草药, 2014, 45(16): 2385-2389. |
| [11] | 杨文婷, 刘秀明, 张雪萌, 等. 红花黄酮醇合成酶基因片段的克隆及表达分析 [J]. 中草药, 2015, 46(2): 250-254. |
| [12] | Li H Y, Dong Y Y, Yang J, et al. De novo transcriptome of safflower and and the identification of putative genes for oleosin and the biosynthesis of flavonoids [J]. PLoS One, 2012, 7: 1-10. |
| [13] | 生书晶, 赵 炜, 赵树进, 等. 药用植物次生代谢工程研究概况 [J]. 生命的化学, 2010, 30(6): 968-971. |
| [14] | 沈忠伟, 许 昱, 夏 犇, 等. 植物类黄酮次生代谢生物合成相关转录因子及其在基因工程中的应用 [J]. 分子植物育种, 2008, 6(3): 542-548. |
| [15] | Huang H H, Xu L L, Tong Z K, et al. De novo characterization of the Chinese fir (Cunninghamia lanceolata) transcriptome and analysis of candidate genes involved in cellulose and lignin biosynthesis [J]. BMC Genomics, 2012, 13(1): 648-652. |
| [16] | Wang Y, Pan Y, Liu Z, et al. De novo transcriptome sequencing of radish (Raphanus sativus L.) and analysis of major genes involved in glucosinolate metabolism [J]. BMC Genomics, 2013, 14(1): 836-846. |
| [17] | Takashi N, Misa S, Eri Y, et al. Isolation and characterization of GtMYBP3 and GtMYBP4, orthologues of R2R3-MYB transcription factors that regulate early flavonoid biosynthesis, in gentian flowers [J]. J Exp Bot, 2012, 63(18): 6505-6517. |
| [18] | Shikha K, Bhanwar L P, Deepika K, et al. De Novo transcriptome sequencing reveals important molecular networks and metabolic pathways of the plant, Chlorophytum borivilianum [J]. PLoS One, 2013, 8(12): e83336. |
| [19] | Jung H J, Dong X S, Park J I, et al. Genome-wide transcriptome analysis of two contrasting brassica rapa doubled haploid lines under cold-stresses using Br135K oligomeric chip [J]. PLoS One, 2014, 9(8): e106069. |
| [20] | Sousuke I, Yu K, Mio O, et al. R2R3-type MYB transcription factor, CmMYB1, is a central nitrogen assimilation regulator in Cyanidioschyzon merolae [J]. Proc Natl Acad Sci USA, 2009, 106(30): 12548-12553. |
| [21] | Michael B P, Malcolm M. Campbell. Interactions between the R2R3-MYB transcription factor, AtMYB61, and target DNA binding sites [J]. PLoS One, 2013, 8(5): e65132. |
| [22] | Tang H H, Erwin G. A-MYB (MYBL1) stimulates murine testis-specific Ldhc expression via the cAMP-responsive element (CRE) site [J]. Biol Reprod, 2012, 86(2): 30-36. |
 2015, Vol. 46
2015, Vol. 46


