2. 华中科技大学同济医学院附属协和医院 药剂科, 湖北 武汉 430022
2. Department of Pharmacy, Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430022, China
中药有效成分的抗肿瘤活性研究是目前药物抗肿瘤研究的热点[1, 2]。汉防己甲素(tetrandrine,Tet),又称粉防己碱,是从防己科(Menispermaceae)植物粉防己Stephania tetrandra S. Moore的干燥根中提取出的具有双苄异喹类结构的生物碱。大量文献表明Tet对多种肿瘤细胞表现出相当的活性,其对肿瘤作用及其机制包括逆转肿瘤的多重耐药,诱导细胞凋亡,放疗增敏以及抑制肿瘤生成[3, 4, 5, 6]。但是作为一种生物碱,Tet的水溶性差,导致其生物利用度低;此外,它还具有一定的刺激性,iv可导致局部疼痛或静脉炎,这些都限制了其作为抗肿瘤药物的临床应用[7]。
为了提高Tet的疗效并减低其毒性,本研究采用聚乳酸-羟基乙酸共聚物(PLGA[8],一类FDA批准的安全、无毒的高生物相容性及可降解性高分子聚合物材料)制备载药纳米粒(Tet-PLGA-NPs),利用纳米给药系统可以改善Tet的水溶性,并具备缓释效果,提高药物生物利用度,减少其毒副作用[9, 10, 11]。已有文献报道带正电的纳米粒更易被细胞摄取[12],本实验选取溴化双十二烷基二甲基铵(didodecyldimethylammonium bromide,DMAB)作为稳定剂,对Tet-PLGA-NPs表面进行修饰。全面考察了DMAB-Tet-PLGA-NPs的理化性质、载药特性、细胞毒性和细胞摄取特性,为载Tet新剂型的开发提供依据。
1 仪器与材料乳化超声仪Ultrasonifier,G560E,Scientific Industries,Inc.,美国;Zetasizer激光粒度仪,英国马尔文仪器有限公司;ROTINA420通用台式离心机,德国Hettich;EVO HD扫描电子显微镜(SEM),Carl Zeiss,德国;JEM-2010透射电子显微镜(TEM),JEOL,德国;高效液相色谱仪,德国Dionex;酶标仪,瑞士TECAN集团有限公司;激光共聚焦电镜CLSM,德国蔡司LSM510。
Tet,南京泽朗医药科技有限公司,质量分数98.65%,批号ZL20120108;PLGA(50∶50),德国Evonik Industries,相对分子质量24 000~38 000,批号#213748;人肺腺癌细胞株A549由美国马纳萨斯典型培养物保藏中心(ATCC)提供;四甲基偶氮唑蓝(MTT),德国Promega公司;DMAB,批号#108014,美国Sigma-Aldrich公司;透析袋,截留相对分子质量3 500,美国Fisher Scientific公司;其余试剂均为进口分析纯。
2 方法与结果 2.1 制备方法DMAB-Tet-PLGA-NPs制备采用乳化扩散溶剂挥发法[13]。将含PLGA 20 mg/mL和Tet 0.2、0.3、0.4、0.5 mg/mL的醋酸乙酯作为有机相(2.5 mL),逐滴滴加至含0.1% DMAB的水相(2.5 mL)中持续搅拌。该初乳液运用Ultrasonifier(10%震幅等于500 J)超声均匀乳化30 s后,使用去离子水(15 mL)稀释使醋酸乙酯扩散入水相。搅拌过夜使有机溶液充分挥发。制得DMAB-Tet-PLGA-NPs胶体溶液。14 000×g、40 min离心收集纳米粒,纯化水洗涤冷冻干燥得成品,贮存备用。
DMAB修饰的空白PLGA纳米粒(DMAB- PLGA-NPs)采用同样方法制备。
2.2 处方工艺优化通过预试验,选出制备过程中对纳米粒的粒径均一性[以多分散系数(PDI)表示]影响较大的3个因素:稳定剂DMAB的用量、油相-水相体积比及超声乳化能量(以振幅强度表示)。采用均匀设计法优化条件,以纳米粒的PDI作为评价指标(平均粒径和Zeta电位作为辅助参考指标,不参与条件优化),对制备工艺进行考察优化。均匀设计试验及结果见表 1。
| 表 1 均匀设计及结果 (n = 3) Table 1 Uniform design and results (n = 3) |
采用Design-Expert.V8.0.6.1软件对均匀设计试验结果进行分析,见表 2。得出最佳制备条件为DMAB质量分数为0.1%、油相-水相体积比1∶1、超声乳化振幅10%(500 J)。表 2结果表明,3个影响因素均对纳米粒的PDI有影响,且在3个影响因素中,对纳米粒PDI影响大小依次为DMAB用量(0.089)>油相水相体积比(0.077)>超声乳化能量(0.028)。
| 表 2 均匀设计试验直观分析结果 (PDI) Table 2 Results of uniform design experiment analyzed by intuitive analysis method (PDI) |
利用激光粒径仪分别测定水溶液中DMAB-Tet-PLGA-NPs及DMAB-PLGA-NPs的粒径大小及Zeta电位。将1 mL稀释的纳米粒子溶液加入到1 cm的石英比色皿中进行检测。粒径大小及粒径分布图见表 3和图 1。实验所合成的DMAB-PLGA-NPs及DMAB-Tet- PLGA-NPs胶体溶液为稳定、大小均一的乳白色半透明分散体系,2种纳米粒的PDI均较小,表明制备的纳米粒粒径分布范围较窄,纳米粒粒径大小均一,而Zeta电位显示DMAB-Tet-PLGA-NPs带较强的正电荷。
| 表 3 DMAB-PLGA-NPs和DMAB-Tet-PLGA-NPs的平均粒径、PDI及Zeta电位(x±s, n = 3) Table 3 Diameter, PDI, and Zeta potential of DMAB-PLGA-NPs and DMAB-Tet-PLGA-NPs (x±s, n = 3) |
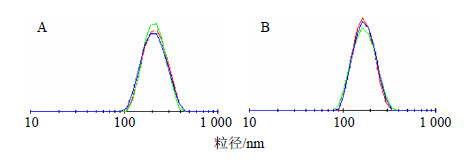 | 图 1 DMAB-Tet-PLGA-NPs (A) 及DMAB-PLGA-NPs (B) 的粒径分布图 (n = 3)Fig.1 Size distribution by intensity of DMAB-Tet-PLGA- NPs (A) and DMAB-PLGA-NPs (B) (n = 3) |
(1)SEM样品制备:取DMAB-Tet-PLGA-NPs悬液适量,稀释,滴加在硅胶晶板上自然挥干,Quorum Q 150 ES喷金仪真空条件喷金,并用EVO HD型SEM观察形态结构。
(2)TEM样品制备:取DMAB-Tet-PLGA-NPs
悬液适量,稀释,滴加在覆盖碳膜的铜网上,用2.0%的磷钨酸钠液负染色,TEM观察形态结构。
结果见图 2,SEM观察结果表明,DMAB-Tet- PLGA-NPs呈表面光滑,分布均匀的致密球形;TEM结果显示,DMAB-Tet-PLGA-NPs呈球型或椭球形,大小均一。
 | 图 2 DMAB-Tet-PLGA-NPs的扫描电镜SEM (A) 及透射电镜TEM (B) 图像Fig.2 SEM image (A) and TEM image (B) of DMAB-Tet- PLGA-NPs |
pH 7.4的PBS缓冲液中,于0、3、6、9、12 d时测定其粒径,每次取3批样品测定,结果平均粒径分别为(205.5±2.95)、(200.1±3.27)、(198.2± 3.21)、(196.4±4.26)、(191.9±2.63)nm,PDI分别为0.074±0.013、0.069±0.021、0.082±0.019、0.077±0.023、0.092±0.026。由结果可知,DMAB- Tet-PLGA-NPs在PBS环境中室温放置12 d,粒径变化范围在14 nm左右,而PDI较小,说明DMAB- Tet-PLGA-NPs具有较好的稳定性。
2.4 Tet包封率、载药量及体外释放 2.4.1 色谱条件色谱柱为RP18-select B柱(125 mm×4 mm,填充物粒径5 μm);流动相为水-乙腈-三乙胺(700∶300∶1),pH 7.4;体积流量0.7 mL/min;进样量20 μL;柱温35 ℃;保留时间2.5 min;紫外检测器,检测波长280 nm。
2.4.2 包封率与载药量测定精密称取一定量的DMAB-Tet-PLGA-NPs冻干粉,用乙腈溶解,经0.2 μm微孔滤膜滤过,取滤液进行HPLC测定Tet的量,并分别按公式计算包封率与载药量。
包封率=纳米粒中Tet的质量/Tet的投药量
载药量=纳米粒中Tet的质量/(纳米粒中Tet的质量+PLGA聚合物的质量
2.4.3 投药量对包封率与载药量的影响投药量的改变会对DMAB-Tet-PLGA-NPs的包封率和载药量造成影响。随着投药量的增加,包封率下降,载药量升高。包封率的下降是由聚合物的饱和性及高浓度Tet会析出结晶所造成[14]。本实验考察了不同投药量(Tet-PLGA比例1∶50、2∶50、3∶50、4∶50,PLGA 50 mg)对包封率及载药量的影响,结果包封率分别为(65.48±1.67)%、(58.29±4.37)%、(49.98±4.32)%、(41.09±4.85)%,载药量分别为(0.96±0.04)%、(1.25±0.09)%、(2.19±0.05)%、(2.44±0.07)%。发现当Tet-PLGA比例为3∶50时,同时具有较高的载药量和包封率。平行重复试验3次,DMAB-Tet-PLGA-NPs的包封率和载药量分别为(50.780±3.253)%和(2.130±0.035)%,纳米粒的包封率与载药量重现性较好。因此选取此组进行下一步体外释放及细胞学实验。
2.4.4 DMAB-Tet-PLGA-NPs体外释药测定精密称取30 mg DMAB-Tet-PLGA-NPs冻干粉,用6 mL 0.01 mol/L的pH 7.4 PBS重分散,转入处理过的透析袋中,扎紧,悬置于盛有94 mL 0.01 mol/L的pH 7.4 PBS烧杯中,置于恒温37 ℃摇床中。定时取样0.5 mL,HPLC法测定Tet的量,计算Tet累积释放量。每次取样后立即补加等量新鲜的溶出介质,并绘制Tet的药物累积释放曲线,结果见图 3。
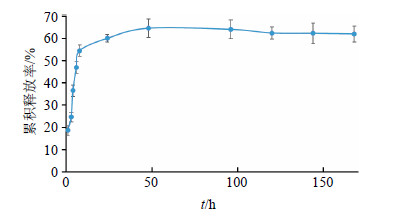 | 图 3 DMAB-Tet-PLGA-NPs的体外累积释药曲线Fig.3 Cumulative release curve in vitro of DMAB-Tet- PLGA-NPs |
考察0~168 h内在pH 7.4的释放介质中,Tet的累积释放情况。DMAB-Tet-PLGA-NPs在8 h内累积释药量为54.50%,为快速释放相;8~48 h药物相对缓速释放,48 h后药物释放达到平台期,累积释药量64.56%。实验结果表明将Tet制备成PLGA纳米给药系统可以实现药物的缓释,而纳米粒内剩余药物最终随着PLGA聚合物的生物降解被逐步释放出来。
2.5 体外细胞毒性实验及细胞摄取实验 2.5.1 剂量依赖性细胞毒性研究剂量依赖性细胞毒性研究采用人肺腺癌A549细胞标准MTT法检测。将人肺腺癌A549细胞悬液每孔1×104接种于96孔板置于培养箱24 h。实验共设6组:DMAB-PLGA-NPs组,DMAB-Tet-PLGA-NPs组、Tet组、阴性对照组(细胞培养液),阳性对照组(1%的聚乙二醇辛基苯基醚,即1% TritonX-100)和空白对照组(无细胞)。Tet组和DMAB-Tet-PLGA-NPs组分别设0.4、2、4、20、40 μg/mL 5个质量浓度,对应DMAB-PLGA-NPs组设0.045、0.225、0.45、2.25、4.5 mg/mL 5个质量浓度。药物与A549细胞共培养4 h后,每孔分别加入5 mg/mL的MTT溶液200 μL,置培养箱反应4 h后,每孔再分别加入二甲基亚砜(DMSO)100 μL,采用酶联免疫检测仪于570 nm处测定吸光度(A)值,按下列公式计算细胞相对存活率,重复实验3次。
细胞活力=(A样品组―A空白组)/(A阴性组―A空白组)
在剂量依赖性细胞毒性研究中,如表 4所示,细胞与纳米粒共培养4 h后,当Tet质量浓度为0.4 μg/mL时,Tet组显示对A549细胞无毒性,而DMAB-Tet-PLGA-NPs组表现出一定的细胞毒性,但Tet组与DMAB-Tet-PLGA-NPs组间细胞存活率无显著差异;当Tet质量浓度为2、4 μg/mL时,Tet组和DMAB-Tet-PLGA-NPs组细胞毒性均随着药物质量浓度增高而加大,在该2种质量浓度下,Tet组的细胞存活率均显著性地高于DMAB-Tet-PLGA- NPs组。当Tet质量浓度增至20 μg/mL时,DMAB-
| 表 4 Tet、DMAB-Tet-PLGA-NPs及DMAB-PLGA-NPs对A549细胞毒性的剂量依赖性 (x±s, n = 3) Table 4 Dose-dependent cytotoxicity assay against A549 cells of Tet, DMAB-Tet-PLGA NPs, and DMAB-PLGA NPs(x±s, n = 3) |
Tet-PLGA-NPs及Tet组均表现出很强的细胞活力抑制作用,而Tet组与DMAB-Tet-PLGA-NPs组对细胞存活率的影响无显著性差异。Tet与DMAB-Tet- PLGA-NPs呈现剂量依赖性细胞毒性。同时,DMAB-PLGA-NPs组在质量浓度0.045、0.225、0.45 mg/mL时对细胞均无毒性,表明DMAB-PLGA-NPs的生物安全性高。
2.5.2 时间依赖性细胞毒性研究
实验共设5组:Tet组、DMAB-Tet-PLGA-NPs组、DMAB-PLGA-NPs组、阴性对照组(细胞培养液)、阳性对照组(1% TritonX-100)。Tet组和DMAB-Tet- PLGA-NPs组设2 μg/mL质量浓度,对应DMAB- PLGA-NPs组选取对应质量浓度0.225 mg/mL。按照标准MTT实验步骤,分别与A549细胞培养1、4、8、24 h后测定A值,按公式计算细胞活力,重复实验3次。
时间依赖性细胞毒性研究中,如表 5所示,当细胞共培养时间为1 h时,Tet组的细胞毒性高于DMAB-Tet-PLGA-NPs组;当培育时间为4、8、24 h时,DMAB-Tet-PLGA-NPs组的细胞毒性显著性高于Tet组,呈现时间依赖性细胞毒性。而对应该质量浓度的DMAB-PLGA-NPs在各个时间点均未显示出细胞毒性。结果表明载药纳米粒不断被细胞摄取,同时DMAB-Tet-PLGA-NPs缓慢释放药物,持续抑制肿瘤细胞的活性,从而减少Tet在血管中的瞬间积聚带来的毒副作用。
| 表 5 Tet、DMAB-Tet-PLGA-NPs及DMAB-PLGA-NPs对A549细胞毒性的时间依赖性 (x±s±s, n = 3) Table 5 Time-dependent cytotoxicity assay against A549 cells of Tet, DMAB-Tet-PLGA-NPs, and DMAB-PLGA-NPs(x±s±s, n = 3) |
将人肺腺癌A549细胞悬液接种于96孔板,每孔细胞1×104。将培养液换100 μL(0.225 mg/mL,pH 7.4 PBS缓冲溶液)荧光标记的DMAB-PLGA-NPs培养液。细胞孵育1、4、8 h后,细胞用PBS缓冲液清洗3次除去未吸收的DMAB-PLGA-NPs。加入细胞裂解液(150 mmol/L NaCl、1% Triton X-100、0.1% SDS、50 mmol/L tris pH 7.4)处理收集的细胞,测定裂解液中荧光强度(荧光素的激发波长为430 nm,发射波长为485 nm)。纳米粒浓度与细胞裂解液发射的荧光强度呈线性关系,通过荧光强度(I)的比值计算细胞的摄取率。细胞摄取率通过公式细胞摄取率=(I样品组―I阴性组)/(I阳性组―I阴性组) 计算。结果细胞摄取率分别为(4.36±2.40)%、(16.96±2.97)%、(26.96±3.96)%(n=3)。
当DMAB-PLGA-NPs与A549细胞共培养1 h,仅有4.36%的摄取率;当培养时间延长到4 h时,细胞摄取率为16.98%,显著高于1 h时的细胞摄取率;而当培养时间达到8 h时,细胞摄取率为26.86%,显著性高于1 h及4 h。定量细胞摄取实验显示DMAB-PLGA-NPs呈现明显地时间依赖性增加。
2.5.4 定性细胞摄取实验利用共聚焦激光扫描显微镜(CLSM)示踪粒子的吸收行为。将人肺腺癌A549细胞悬液接种于12孔板,每孔细胞3×105。37 ℃培养2 d后,将培养液换成1 mL(0.225 mg/mL,pH 7.4)荧光标记的DMAB-PLGA-NPs。与细胞孵育1、4、8 h后,细胞用PBS缓冲液清洗3次除去未吸收的纳米粒,用DAPI染色A549细胞核。固定细胞后运用激光共聚焦显微镜观察细胞摄取。采用C-Apochromat 63倍镜头,DAPI激发光λex=488 nm,荧光激发光λex=720 nm,纳米粒的荧光信号通过(BP 505-550)检测。
通过荧光标记的DMAB-PLGA-NPs与A549细胞培养1、4、8 h后,利用共聚焦激光显微镜多通道扫描,检测DAPI染色的A549细胞核和荧光标记的DMAB-PLGA-NPs的分布情况,见图 4。结果证明DMAB-PLGA-NPs能充分被人肺腺癌A549细胞摄取,且分布在细胞各层中。摄取量顺着培养时间延长明显增加。时间依赖性结果与定量细胞摄取实验一致。
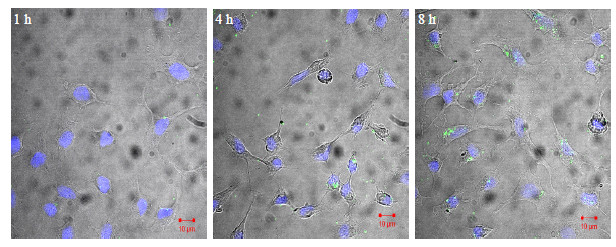 | 图 4 A549细胞体外摄取DMAB-PLGA-NPs的激光共聚焦断层扫描图Fig.4 Confocal laser scanning images of DMAB-PLGA-NPs of A549 cellular uptake in vitro |
实验数据以x±s表示,组间比较采用t检验,以P<0.05为差异具有统计学意义。
3 讨论乳化扩散溶剂挥发法制备PLGA纳米粒的过程中,稳定剂的浓度选择十分重要,浓度过高,过量的稳定剂不容易被除去,残留在纳米粒表面会增加纳米粒的毒性,同时纳米粒体系稳定性下降;浓度过低,同样无法保证纳米粒体系的稳定性[16, 17, 18, 19, 20];油水相体积比,根据制备方法,油相缓慢滴加入水相中形成液滴,而当油相体积大于水相时,在制备中,高分子聚合物PLGA会出现絮集,继而沉淀析出,出现分层,无法形成均匀的初乳体系[13];超声乳化能量,将初乳液滴切割成纳米尺寸,需要给予一定能量,而能量大小直接影响纳米粒的均一性[21]。根据前期预试验研究发现以上3个因素对纳米粒的制备有较大影响。而多分散系数(PDI)表示高分子直径的多分散性,是评价纳米粒大小均一性、稳定性的直接指标。作为纳米载体,只有大小一致才能保证每个纳米粒载药量的一致性。如果大小不均一,每个纳米粒的载药量必然不相同,这将直接影响后期药物释放,及体外细胞实验的准确性。故本实验中以PDI作为考察指标;稳定剂DMAB的质量分数、油相水相体积比及超声乳化能量为考察因素,设计均匀实验,优化最佳制备工艺。
DMAB作为常用的表面修饰剂和稳定剂用于纳米粒的制备,它能将PLGA负电性的表面转变为正电性表面。由于细胞膜的负电性,带正电的载药纳米粒可以通过静电力的作用,有效地与细胞相结合,延长纳米粒在细胞表面的接触停留时间,增加纳米粒的细胞摄取机会。从而更有效地将药物带入胞内[18, 22, 23]。
由于Tet依靠单纯扩散作用被细胞摄取,而其疏水性又在很大程度上限制了其被细胞摄取。带正电的PLGA纳米粒则可以不断被细胞摄取,药物在细胞内从纳米粒中被缓慢释放,发挥对癌细胞更持久的细胞毒作用,从而提高药物疗效。而作为药物载体的DMAB-PLGA-NPs在一定质量浓度内无细胞毒性,生物安全性高。
研究结果表明DMAB-Tet-PLGA-NPs能明显提高Tet对肺癌A549细胞的抗肿瘤活性作用。DMAB- Tet-PLGA-NPs作为Tet一种有效的纳米传递系统,值得继续深入研究。
| [1] | Shah U, Shah R, Acharya S, et al. Novel anticancer agents from plant sources [J]. Chin J Nat Med, 2013, 11(1): 16-23. |
| [2] | Cragg G M, Newman D J. Plants as a source of anti-cancer agents [J]. J Ethnopharmacol, 2005, 100(1/2): 72-79. |
| [3] | Xu W, Debeb B G, Lacerda L, et al. Tetrandrine, a compound common in Chinese traditional medicine, preferentially kills breast cancer tumor initiating cells (TICs) in vitro [J]. Cancers, 2011, 3(2): 2274-2285. |
| [4] | Liou J T, Chen Z Y, Ho L J, et al. Differential effects of triptolide and tetrandrine on activation of COX-2, NF-kappaB, and AP-1 and virus production in dengue virus-infected human lung cells [J]. Eur J Pharmacol, 2008, 589(1/3):288-298. |
| [5] | Liu Z L, Hirano T, Tanaka S, et al. Persistent reversal of P-glycoprotein-mediated daunorubicin resistance by tetrandrine in multidrug-resistant human T lymphoblastoid leukemia MOLT-4 cells [J]. J Pharm Pharmacol, 2003, 55(11): 1531-1537. |
| [6] | Cho H S, Chang S H, Chung Y S, et al. Synergistic effect of ERK inhibition on tetrandrine-induced apoptosis in A549 human lung carcinoma cells [J]. J Vet Sci, 2009, 10(1): 23-28. |
| [7] | Li R, Li X, Xie Q, et al. Preparation and evaluation of PEG-PCL nanoparticles for local tetradrine delivery [J]. Int J Pharm, 2009, 379(1): 158-166. |
| [8] | 刘楠楠, 蒋福升, 俞婷婷, 等. 改良溶剂挥发法制备姜黄素衍生物mPEG5000-PLGA纳米粒的研究 [J]. 中草药, 2013, 44(16): 2223-2229. |
| [9] | Roberts A D, Zhang H F. Poorly water-soluble drug nanoparticles via solvent evaporation in water-soluble porous polymers [J]. Int J Pharm, 2013, 447(1/2): 241-250. |
| [10] | Jose Merlin J P, Venkadesh B, Hussain R, et al. Paclitaxel loaded poly-d, l-lactide-co-glycolide nanoparticles: Enhanced anticancer effect in non-small cell lung carcinoma cell line [J]. Biomed Prev Nutr, 2013, 3(2): 1-9. |
| [11] | Brannon-Peppas L, Blanchette J O. Nanoparticle and targeted systems for cancer therapy [J]. Adv Drug Deliv Rev, 2004, 56(11): 1649-1659. |
| [12] | Bhardwaj V, Ankola D, Gupta S, et al. PLGA nanoparticles stabilized with cationic surfactant: safety studies and application in oral delivery of paclitaxel to treat chemical-induced breast cancer in rat [J]. Pharm Res, 2009, 26(11): 2495-2503. |
| [13] | Nafee N, Schneider M, Friebel K, et al. Treatment of lung cancer via telomerase inhibition: Self-assembled nanoplexes versus polymeric nanoparticles as vectors for 2'-O-methyl-RNA [J]. Eur J Pharm Biopharm, 2012, 80(3): 478-489. |
| [14] | Wischke C, Schwendeman S P. Principles of encapsulating hydrophobic drugs in PLA/PLGA microparticles [J]. Int J Pharm, 2008, 364(2): 298-327. |
| [15] | Weiss B, Schneider M, Muys L, et al. Coupling of biotin-(poly(ethylene glycol)) amine to poly(D,L-lactide-co-glycolide) nanoparticles for versatile surface modification [J]. Bioconjug Chem, 2007, 18(4): 1087-1094. |
| [16] | Shakweh M, Besnard M, Nicolas V, et al. Poly (lactide-co-glycolide) particles of different physicochemical properties and their uptake by Peyer’s patches in mice [J]. Eur J Pharm Biopharm, 2005, 61(1/2): 1-13. |
| [17] | Vandervoort J, Ludwig A. Biocompatible stabilizers in the preparation of PLGA nanoparticles: A factorial design study [J]. Int J Pharm, 2002, 238(1/2): 77-92. |
| [18] | Gan Q, Wang T, Cochrane C, et al. Modulation of surface charge, particle size and morphological properties of chitosan-TPP nanoparticles intended for gene delivery [J]. Colloid Surface B, 2005, 44(2/3): 65-73. |
| [19] | Cheng F Y, Wang S P H, Su C H, et al. Stabilizer-free poly(lactide-co-glycolide) nanoparticles for multimodal biomedical probes [J]. Biomaterials, 2008, 29(13): 2104-2112. |
| [20] | Grabowski N, Hillaireau H, Vergnaud J, et al. Surface coating mediates the toxicity of polymeric nanoparticles towards human-like macrophages [J]. Int J Pharm, 2015, 482(1/2): 75-83. |
| [21] | Kimura T, Okuno A, Miyazaki K, et al. Novel PVA-DNA nanoparticles prepared by ultra high pressure technology for gene delivery [J]. Mater Sci Eng: C, 2004, 24(6/8): 797-801. |
| [22] | Prabha S, Zhou W Z, Panyam J, et al. Size-dependency of nanoparticle-mediated gene transfection: Studies with fractionated nanoparticles [J]. Int J Pharm, 2002, 244(1/2): 105-115. |
| [23] | Peetla C, Labhasetwar V. Effect of molecular structure of cationic surfactants on biophysical interactions of surfactant-modified nanoparticles with a model membrane and cellular uptake [J]. Langmuir, 2009, 25(4): 2369-2377. |
 2015, Vol. 46
2015, Vol. 46


