2. 中药质量研究国家重点实验室(澳门科技大学), 澳门特别行政区 氹仔;
3. 广州中医药大学中药学院, 广东 广州 510000;
4. 中国农业科学院特产研究所, 吉林 长春 132109
2. State Key Laboratory of Quality Research in Chinese Medicine, Macau University of Science and Technology, Taipa, Macau Special Administrative Region, China;
3. College of Chinese Medicines, Guangzhou University of Traditional Chinese Medicine, Guangzhou 510000, China;
4. Institute of Special Wild Economic Animal and Plant, Chinese Academy of Agriculture Science, Changchun 132109, China
中成药及其保健品(以下简称成药制剂)都是以中药材为原料,按照规定的处方、生产工艺和质量标准生产的制剂[1, 2]。其加工过程中主要添加的辅料有淀粉、蜂蜜、葡萄糖、蔗糖等[3]。由于深加工的原因,DNA大多数已经分解[4],但是部分片段尚存在,因此可以对其药材基原进行分子鉴定。
中药材分子鉴定技术已经成为了中药鉴定研究的新方向[5, 6],由于成药制剂在制剂过程中基原药物的化学成分发生了改变,形态学特征多数也已经丢失,难以成为鉴定依据,所以基于DNA的分子鉴定技术对于成药制剂的鉴别有着独特的优势。目前已经有部分报道显示成药制剂分子鉴别具有一定的可行性[7, 8],但是相对于中药材的分子鉴定,成药制剂的分子鉴定研究报道还是太少,高质足量的DNA获取困难是其重要原因。成药制剂主要分为2大类,一类为有原粉末入药的散剂、丸剂、搽剂等,另一类是药材经过深加工入药的颗粒剂、片剂、液体制剂等。由于制剂时通常会添加大量糖,因此DNA的提取经常选择CTAB法[9]。少量第1类成药制剂因为含有大量的淀粉或多糖在一定程度上给DNA的提取造成困难,第2类成药制剂DNA尤其难以获得。在使用传统CTAB(Hexadecyltrimethyl ammonium Bromide)法提取人参类成药制剂DNA进行分子鉴定时,发现第2类成药制剂的DNA提取尤其困难,无法获得预期结果。进一步研究发现造成这种困难的原因不仅仅与深加工制剂工艺有关,更与添加的辅料有关。故本实验以人参类成药制剂为例,探索了影响传统CTAB法提取成药制剂DNA效率的可能原因,并提出优化了的技术方案。随后利用这个优化的方法和已经成熟的基于ETS基因SNP分子标记,采用MAS-PCR技术鉴定了市售的11种人参类制剂的真伪及掺伪情况。
1 仪器与材料Pro-Flex PCR仪,美国Life-technologies公司;50×TAE电泳液,美国Bio-Rad Laboratories公司;Agarose G-10,香港Gene公司;SYBR® Safe DNA Gel Stain,美国Invitrogen公司;冷冻离心机及移液枪,德国Eppenddorf公司;微量分光光度计,美国Life-technologies公司;凝胶成像系统,美国Bio-Rad公司;化学及荧光分析仪,Molecular Devices公司。所用试剂均为分析纯。
5年生人参嫩叶(大马牙,由中国农业科学院特产研究所赠送,经中国农业科学院特产研究所王英平研究员鉴定为五加科人参属植物人参Panax ginseng C. A. Mey.)用于提取标准DNA;人参类成药制剂购买于广州市场或互联网商家,均标注为正规厂家生产,样品保存于中药质量研究国家重点实验室(澳门科技大学),样品的制剂信息见表 1。
| 表 1 实验用人参类成药制剂情况 Table 1 Ginseng preparations for test |
采用传统的CTAB法提取DNA,取人参嫩叶少许,液氮研磨,随后置于2 mL EP管中,加入65 ℃预热的2×CTAB提取缓冲液800 μL以及巯基乙醇16 μL,置于65 ℃水浴裂解2 h,期间常震荡,随后加等体积氯仿-异戊醇(24∶1)颠倒混匀5 min,12 000 r/min离心15 min;取上清液加等体积−20 ℃预冷的异丙醇,−20 ℃沉淀2 h,12 000 r/min离心15 min;取沉淀用无菌水600 μL溶解,随后加入乙醇1 200 μL及3 mol/L 醋酸钠溶液60 μL,混匀,−20 ℃沉淀1 h,12 000 r/min离心15 min,重复此过程2~3次;沉淀置于37 ℃烘箱温育1 h,直至乙醇挥干;加无菌水200 μL溶解,−20 ℃冷冻备用。
2.2 人参类成药制剂的分子鉴定方法使用Wang等[10]建立的MAS-PCR方法,基于SNP方法针对人参ETS基因设计特征性引物ETSR(5-TTTGCAAGTCGTGTGAGTTG-3);AgF(5-GTGTTGGCATAGTGTACGTTA-3);PgF(5-AGAGCAGTAAGCCTTGGAAAAT-3)。使用50 μL体系,DNA模板10 ng、引物各0.5 μL、以及10 μL 2×Premix DNA polymerase,补水至50 μL;94 ℃预变性4 min,然后94 ℃解链30 s、63 ℃退火30 s、72 ℃延伸30 s进行35次循环,72 ℃延伸5 min,4 ℃保存,通过10%琼脂糖凝胶检测。
2.3 CTAB法提取不同成药制剂DNA的差异成药制剂如前所述主要分2大类,第1类为药材全粉末入药,第2类为深加工者。全粉末入药的剂型,如大蜜丸等通常和中药材一样可以较容易提取DNA,第2类则很难提取获得理想的DNA。一般来说,研究人员大多数将第2类的原因归结为DNA在制剂过程中的降解。但是,本课题组发现在使用CTAB法提取第2类制剂时,会产生极性较大的物质,其与异丙醇、70%乙醇不能互溶,且密度大于异丙醇和乙醇,如图 1所示,在提取第2类成药制剂时,2×CTAB抽提物加等体积异丙醇出现的溶液分层现象(图 1第1管);在提取第1类成药制剂时,则不出现分层现象(图 1第2管);在提取第2类成药制剂出现分层现象后,将下层收集并加乙醇至70%(含10% 3 mol/L醋酸钠)后,依然出现分层现象,不能沉淀DNA(图 1第3管)。出现此种现象的样品按照传统的CTAB法只能获得微量DNA,且DNA质量很差,难以适应分子鉴定的要求,用于PCR也不能成功扩增出目标DNA片断。
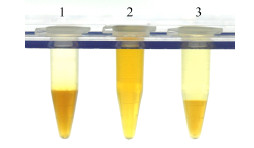 |
1-提取第2类成药制剂时2×CTAB抽提物加等体积异丙醇出现的溶液分层现象 2-提取第1类成药制剂时,则不出现分层现象 3-在提取第2类成药制剂出现分层现象后,将下层收集并加乙醇至70%依然出现分层现象 1-stratification appeared when an equal volume of ethanol were mixed with extraction of 2 × CTAB in the extract process of the second category patent medicine 2-no stratification appeared when an equal volume of ethanol were mixed with extraction of 2 × CTAB in the extract process of the first category patent medicine 3-stratification appeared again when mixed with ethanol to 70% in the lower solution in process of the second category patent medicine 图 1 可知DNA提取困难的主要原因是出现了与异丙醇和乙醇不相溶的未知物,其能溶解DNA,Fig.1 Difference of DNA extracted by classic CTAB method in different types of CPM preparation |
使用微量分光光度计检测上述2类制剂的吸光度(A)值,计算DNA的量,结果见表 2(试验类别A)。
| 表 2 不同DNA提取试验微量分光光度计检测值 (n = 3~6) Table 2 Micro spectrophotometer test values of different DNA extraction (n = 3—6) |
从而阻碍了DNA沉淀。由此可见,优化传统CTAB法提取成药制剂DNA的目标在于了解该物质的性质,并设计物理或者化学方法消除该物质所造成的影响。本实验考察了中成药中常用的辅料以及赋型剂对标准DNA(50 μL)提取的影响,分别将人参粗提液、葡萄糖、蔗糖、麦芽糖、乳糖、5%淀粉溶液、淀粉标准DNA混合后再按“2.1”项方法(至第1次异丙醇沉淀为止)进行提取,以模拟CTAB法提取DNA中的裂解和异丙醇萃取过程,所得结果分别在自然光和紫外光下拍照(图 2),并使用微量分光光度计检测A值,计算DNA的量,结果见表 2(试验类别A)。
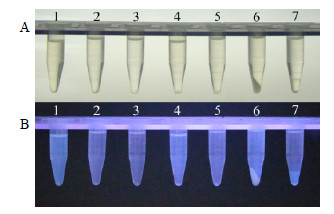 |
1~7分别是人参粗提液、葡萄糖、蔗糖、麦芽糖、乳糖、淀粉溶液、淀粉单独与2% CTAB在65 ℃反应2 h后加等体积异丙醇结果。图片分别在自然光(A)和紫外光(B)下拍照所得 Tubes 1—7 showed the results when ginseng extract, glucose, sucrose, maltose, lactose, starch solution, and starch, respectively, mixed with 2% CTAB at 65 ℃ for 2 h and then precipitate by equal volume of isopropanol. The photos were taken under sunlight (A) and UV light (B) 图 2 不同辅料对传统CTAB法提取标准DNA的影响Fig.2 Effect of different excipients on extraction of standard DNA by classic CTAB method |
含DNA的样品与CTAB在65 ℃反应2 h后,加入等体积异丙醇,正常情况下溶液互溶,DNA则成絮状沉淀。而由图 2可知,第7管出现了与第2类成药制剂提取DNA时类似的分层现象,即提取液与异丙醇不能互溶,推测可能是淀粉与CTAB发生了反应,会影响DNA沉淀过程。同样,使用70%乙醇沉淀继续处理此分层时,仍然会出现分层,不能沉淀DNA(图 1第3管)。由此判断在CTAB裂解过程中,产生了一种物质,极性较大,介于水和乙醇之间,且不能与乙醇和异丙醇互溶。
为了分析这种物质,采用傅里叶变换红外光谱(FTIR)对淀粉(1)和淀粉与CTAB反应物(2)进行比较分析(图 3),发现与CTAB反应后淀粉原有的两处红外吸收峰有发生变化,即1 084 cm−1处的C-O-C伸缩振动消失,2 851 cm−1处的-CH2反对称伸缩振动加强。另外,本实验发现,淀粉与CTAB在常温及65 ℃下均可以发生反应(不再与碘液不发生颜色反应,图 4第2~4管),但是常温反应并不会产生分层现象(图 4第3’和4’管),只有通过加热后才能形成高极性的淀粉-CTAB复合物并引起分层(图 4第2’管)。由于CTAB为含有大量-CH2-而无-C-O-C-的季铵盐类物质,由此推测该条件下淀粉α-1,4苷键在碱性条件下水解,并与CTAB生成了极性较大的复合物,由于CTAB带正电荷,所以极易与带负电荷的DNA互溶,从而阻止DNA沉淀。
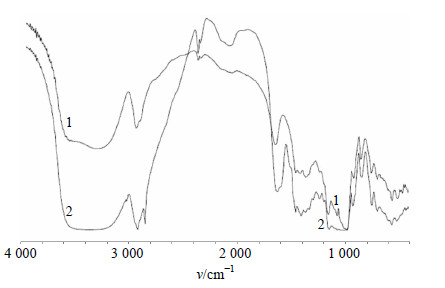 |
1-淀粉傅里叶变换红外光谱图 2-淀粉与CTAB反应物的傅里叶变换红外光谱图 1-FTIR spectrum of starch 2-comparison on FTIR spectrum of starch and CTAB 图 3 淀粉及淀粉-CTAB反应物的FTIR图谱比较Fig.3 Comparison on FTIR charts of starch and starch-CTAB reacted products |
 |
1-淀粉在65 ℃加热2 h后稀碘液显色 2-淀粉与CTAB在65 ℃反应2 h后稀碘液显色 3-淀粉与CTAB在常温反应2 h后稀碘液显色 4-淀粉65 ℃加热2 h冷却后与CTAB在常温反应2 h后稀碘液显色 1’-淀粉在65 ℃加热2 h后用异丙醇沉淀 2’-淀粉与CTAB在65 ℃反应2 h后用异丙醇沉淀 3’-淀粉与CTAB在常温反应2 h后用异丙醇沉淀 4’-淀粉65 ℃加热2 h冷却后与CTAB在常温反应2 h后用异丙醇沉淀 1-starch heated for 2 h at 65 ℃ and colorized with I2 solution 2-starch reacted for 2 h at 65 ℃ with CTAB and colorized with I2 solution 3-starch reacted for 2 h at room temperature with CTAB and colorized with I2 solution 4-starch heated for 2 h at 65 ℃ and then cooled down for reaction with CTAB for 2 h and finally colorized with I2 solution 1’-starch heated for 2 h at 65 ℃ and precipitated with isopropanol 2’-starch reacted for 2 h at 65 ℃ with CTAB and precipitated with isopropanol 3’-starch reacted for 2 h at room temperature with CTAB and precipitated with isopropanol 4’-starch heated for 2 h at 65 ℃ and then cooled down for reaction with CTAB for 2 h and finally precipitated with isopropanol 图 4 淀粉与CTAB的颜色反应和分层现象Fig.4 Colorreaction and stratification between starch and CTAB |
2.5 甲醇、乙醇沉淀DNA效率比较
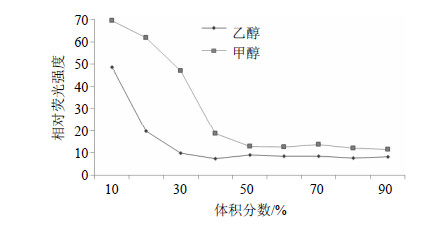
分别取制备好的标准DNA样品50 μL于2 mL EP管中,加入无菌水600 μL、3 mol/L醋酸钠溶液 60 μL以及等体积−20 ℃预冷的异丙醇,−20 ℃放置2 h,12 000 r/min离心15 min,取沉淀,加无菌水600 μL、3 mol/L醋酸钠溶液60 μL并分别加入梯度甲醇和乙醇溶液(梯度分别为10%、20%、30%、40%、50%、60%、70%、80%、90%),12 000 r/min离心15 min,取沉淀37 ℃烘干,用无菌水100 μL溶解,并使用微量分光光度计检测A值,计算DNA的量并计算提取率(图 5);取上清液198 μL,按顺序加入96孔板,分别加入稀释100倍的SYBR Safe DNA Gel Stain 2 μL,置于暗处10 min,放入化学及荧光分析仪,设置激发波长和发射波长Ex/Em=485/538 nm,检测其相对荧光强度(图 6)。
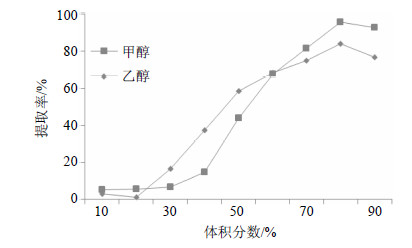 | 图 5 甲醇及乙醇沉淀DNA效率分析Fig.5 Analysis on DNA extraction rate between methanol and ethanol precipitation |
 | 图 6 甲醇及乙醇沉淀DNA上清液残留荧光分析Fig.6 Analysis on fluorescence remained in supernatants of DNA extraction in methanol and ethanol precipitation |
由结果可知,甲醇、乙醇沉淀DNA的效果(提取率)与其浓度相关,当工作浓度低于60%时,甲醇沉淀DNA效果较乙醇差,但两者的总体提取率均低于70%;当工作浓度高于60%时,甲醇沉淀处理的提取率达到了80%,也超过了乙醇。从上清液的DNA残留荧光来看,也反映了类似的情况。虽然使用高浓度的甲醇作为工作浓度时,提取率还会继续轻微的增加,但这会导致操作体系显著增大,导致不必要的试剂浪费,因此,本实验使用70%甲醇作为DNA沉淀试剂可以产生理想的效果。
2.6 甲醇、乙醇对淀粉-CTAB复合物的溶解作用及成药制剂DNA的提取通过“2.5”项下的比较,确定70%的甲醇沉淀效果较优,在此基础上,本实验对于经过CTAB反应后的中成药中的DNA情况进行进一步分析。采用70%甲醇或乙醇在CTAB法中异丙醇沉淀步骤之前先处理样品,观察两者效果的区别,结果如表 2(试验类别C)所示。使用甲醇沉淀处理后DNA提取量比直接使用异丙醇提取高10倍以上,而使用乙醇沉淀处理效果则不明显。在中成药的提取过程中,使用70%甲醇在异丙醇沉淀之前先处理,比乙醇处理DNA提取效率高近2.5倍。
2.7 优化方法的验证——人参类成药制剂的分子鉴别基于前面的研究结果确定的成药制剂DNA提取方法为分别取样品约2 g置于10 mL离心管中,加65 ℃预热的2×CTAB提取缓冲液2.5 mL及巯基乙醇100 μL,于65 ℃水浴裂解2 h,期间常震荡,8 000 r/min离心5 min;取上清液加甲醇5 mL,−20 ℃沉淀1 h,8 000 r/min离心5 min;取沉淀转移到2 mL EP管中,加入65 ℃预热的2×CTAB提取缓冲液600 μL及巯基乙醇16 μL,置于65 ℃裂解20 min,期间常震荡,随后加等体积氯仿-异戊醇(24∶1)颠倒混匀5 min,12 000 r/min离心15 min;取上清液加等体积−20 ℃预冷的异丙醇,−20 ℃沉淀2 h,12 000 r/min离心15 min;取沉淀用无菌水600 μL溶解,随后加入乙醇1 200 μL及3 mol/L醋酸钠溶液60 μL,混匀,置−20 ℃沉淀1 h,12 000 r/min离心15 min,根据DNA的质量重复本操作2~3次;沉淀置于37 ℃烘箱温育1 h,直至乙醇挥干,随后加无菌水200 μL溶解,−20 ℃冷冻备用。
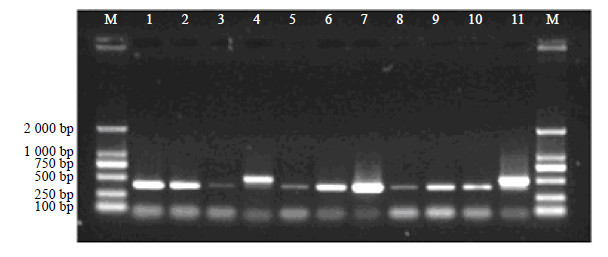
取上述DNA,采用“2.2”项下的方法进行分析,结果如图 7所示,人参的特征条带为388 bp,西洋参的特征条带为501 bp,与文献一致。结果发现11种商品中,序号为1、2、3、4、6、7、8、10的样品与商品描述相符合;序号为11的样品(标签成分为西洋参)除了出现西洋参特征条带,也出现了人参特征条带,提示有掺伪情况;序号为5、9的样品(标签成分为西洋参),只出现了人参特征条带,但并没有出现应该具备的西洋参特征条带,提示商品中只含有人参而无西洋参,这与商品标签中所述的成分描述并不相符。
 | 图 7 人参成药制剂MAS-PCR琼脂糖凝胶分析Fig.7 MAS-PCR agarose gel analysis on ginseng preparations |
上述结果也说明本研究建立的优化方法可以提取得到DNA,并成功用于成药制剂的分子鉴定,使本优化方法的效果得到了验证。
3 讨论 3.1 创新的实验方法设计CTAB法提取中成药或含中药材保健品的DNA过程中遇到困难,是一个已经被关注但没有被解决的问题。本研究在使用传统CTAB法提取人参类成药制剂并对其进行分子鉴定时,因为DNA提取困难,无检测结果,其剂型主要为颗粒剂、粉剂。经过分析,发现其原因在于中成药中所含的淀粉与CTAB在加热条件下反应生成高极性富含正电荷的复合物,并影响了的DNA沉淀效果,进一步发现采用甲醇处理可以有效去除这种复合物的影响。以人参类成药制剂为例阐述成药制剂DNA提取技术优化过程,最终建立的优化方法有效避免传统CTAB法用于中成药时,因为提取得到的DNA量少质差而无法跑出理想DNA电泳条带的缺陷,采用该优化方法提取得到的DNA可成功用于含人参中成药的人参药材分子鉴定,使得该DNA提取技术更有说服力。
3.2 优化的CTAB法DNA提取技术的应用前景CTAB法提取DNA主要优势在于能够很好的去除多糖[11],且操作步骤简单,所以植物样品的DNA提取多选用此法。对于成药制剂来说,多种糖类辅料的添加及深加工,也是影响其DNA提取质量的重要影响因素,因此CTAB法还是首选方案。崔光红等[4]于2006年就发现了淀粉和多糖影响DNA的提取,但当时只是从改变氯化钠的浓度来降低其对DNA提取的影响。本研究首次发现淀粉与CTAB缓冲液在DNA提取过程中发生反应,生成了CTAB淀粉复合物,其极性较大且不溶于70%乙醇及异丙醇,但能与水互溶,其在碱性溶液中能与带负电荷的DNA大量结合并溶解,所以极大地影响了成药制剂DNA的提取。本实验首次使用甲醇作为沉淀剂,比较了其与乙醇的沉淀效果,证明了使用70%甲醇作为沉淀剂,能够解决CTAB淀粉复合物的影响,其DNA沉淀效果更优于乙醇。
通过统计《中国药典》2010年版一部[12]收载的943种粉末剂、颗粒剂、胶囊剂、丸剂、片剂、口服剂等6种剂型的中成药,发现其中添加了淀粉辅料或原药材中含有大量淀粉(如山药[13]、粉葛[14]、天花粉[15]、白蔹[16]等)的剂型数(以下称为目标数)共有203种,占总数的21.53%,其中颗粒剂则占到了77.69%,不同剂型中目标数占总数的具体情况如表 3所示。
| 表 3 各剂型中目标数占总数的比例 Table 3 Percentage of targets in each preparation form |
由表 3可知,基于甲醇沉淀DNA开发出简单易行且安全无毒的方法用于成药制剂DNA提取,并用于成药制剂的分子鉴定,有很广的应用面,也有助于提高中药质量评价技术的准确性,这将产生积极的社会效益,也能产生很好的经济价值,具有很好的应用前景。
| [1] | 梁晓春. 合理使用中成药规避不良反应[J]. 中华全科医师杂志, 2009, 8(5): 292-294. |
| [2] | 颜 杰, 刘志强, 程振田. 中成药及中药保健策食品中非法添加化学药品现状与对策[J]. 中国药学杂志, 2007, 42(9): 716-718. |
| [3] | 张海燕, 邬伟魁, 宋民宪, 等. 《中国药典》2010年版药用辅料标准探讨[J]. 中国实验方剂学杂志, 2011, 17(11): 289-291. |
| [4] | 崔光红, 唐晓晶, 黄璐琦. 利用多重等位基因特异PCR鉴别人参、西洋参[J]. 中国中药杂志, 2006, 31(23): 1940-1943. |
| [5] | 陈士林, 姚 辉, 宋经元, 等. 基于DNA barcoding (条形码) 技术的中药材鉴定[J]. 世界科学技术—中医药现代化, 2007, 9(3): 7-12. |
| [6] | 夏 至, 李贺敏, 张红瑞, 等. 紫苏及其变种的分子鉴定和亲缘关系研究[J]. 中草药, 2013, 44(8): 1027-1032. |
| [7] | 崔占虎, 蒋 超, 李旻辉, 等. 连翘败毒丸中原料药材的分子鉴别[J]. 药学学报, 2013, 48(4): 590-596. |
| [8] | Coghlan M L, Haile J, Houston J, et al. Deep sequencing of plant and animal DNA contained within traditional Chinese medicines reveals legality issues and health safety concerns[J]. PLoS Genet, 2012, 8(4): e1002657. |
| [9] | 崔光红, 唐晓晶, 黄璐琦. 含淀粉及多糖类中药材DNA的提取方法研究[J]. 中国中药杂志, 2006, 31(16): 1365-1367. |
| [10] | Wang H T, Kim M K, Kwon W S, et al. Molecular authentication of Panax ginseng and ginseng products using robust SNP markers in ribosomal external transcribed spacer region[J]. J Pharm Biomed Anal, 2011, 55(5): 972-976. |
| [11] | Amani J, Kazemi R, Abbasi A R, et al. A simple and rapid leaf genomic DNA extraction method for polymerase chain reaction analysis[J]. Iran J Biotechnol, 2011, 9(1): 69-71. |
| [12] | 中国药典 [S]. 一部. 2010. |
| [13] | 李 丹, 吕洪艳, 陆海民. 不同品种怀山药中山药多糖和淀粉积累动态比较[J]. 中草药, 2009, 40(增刊): 250-253. |
| [14] | Wang Q, Xu H H, Shen S. Leaflet morphology of Pueraria (Leguminosae) from the miocene Shanwang formation of Shandong Province and its palaeoecological implications[J]. Bot Res, 2012, 1(2): 13-22. |
| [15] | 王 宁. 天花粉的本草考证[J]. 中医文献杂志, 2006(3): 19-22. |
| [16] | 王 晖, 张艳军. 半夏和白蔹分别与生川乌合煎过程中淀粉类成分对生川乌生物碱类成分溶出的影响[J]. 中草药, 2014, 45(11): 1545-1550. |
 2015, Vol. 46
2015, Vol. 46


