野甘草(sweet broom weed)为玄参科(Scrophulariaceae)野甘草属Scoparia L. 植物野甘草Scoparia dulcis L. 全株。野甘草的茎叶放口中嚼之有甜味,因此又有称为“冰糖草”。野甘草草本或亚灌木状,直立,30~80 cm,锯齿状叶子,小白花。其主要分布于全球热带和亚热带地区,在我国主要分布于广西、广东、福建、云南、台湾等省。传统中医认为野甘草具有健胃、利尿、镇咳、解热、解毒功效,被用于治疗胃病、糖尿病、炎症、支气管炎、高血压等疾病。在我国南方,野甘草不仅是一种草药,同时又是一种凉茶和有保健功效的草本饮料。此外,许多民族的传统医学典籍都有野甘草的记载,如我国的壮药、傣药等,印度、巴西、尼加拉瓜、巴拉圭民间流传其用法。野甘草的使用主要集中在亚太地区、非洲、中美洲、南美洲和印度。我国对其研究较少,而近年来印度、日本、巴西的学者对其关注较多。在20世纪90年代,野甘草研究主要集中在化学成分上,近几年的研究侧重于药理活性方面,相继发现野甘草在抗氧化、治疗糖尿病和胃溃疡方面有较好疗效,同时也有抗菌、抗癌、抗HIV、镇痛等方面的报道。这些现代研究也为野甘草在民间用来治疗糖尿病、高血压、牙痛、胃病等疾病提供了理论依据。
1 应用历史及功效 1.1 野甘草的本草考证[1]野甘草多收录于民间草药或民族药中,作用偏向于清热解毒,使用方法有内服、外用以及代茶饮用。其本草考证见表 1。
| 表 1 野甘草在中国的本草记载 Table 1 Herbal records on S. dulcis in China |
野甘草为广西壮族民间验方组成之一,壮医药理论认为其性凉、味甘,具有调水道、清热毒、消肿的功效,可用于治疗肺热咳嗽、咽喉肿痛、湿热黄疸、热痱、暑热泄泻、脚气浮肿、小儿麻痹、麻疹、痧病、湿疹、丹毒等症[2]。傣族《雅解》中称之为牙海补乌,主要分布于云南省西双版纳地区,具有清热解毒、利尿消肿等作用。
1.3 野甘草在世界其他地区的民间应用巴西用其治疗呼吸道疾病、胃病、肝功能障碍和炎症[3]。印度用其治疗糖尿病、高血压、牙痛、淋病和胃病。尼加拉瓜土著部落用其治疗疟疾、肠胃功能紊乱、月经失调、昆虫叮咬、发烧、心脏疾病、肝病和性病。巴拉圭用其治疗胃病和肝功能障碍等[4]。
2 野甘草的化学成分研究到目前为止,从野甘草中分离出的化学成分有80多种(表 2),包括二萜、生物碱、黄酮、三萜等。野甘草主要的活性成分为二萜类,分为labdane型、scopadulan型和aphidicolane型,其中scopadulane型二萜因具有独特的碳骨架和多种生物活性,一直是研究的重点。二萜类化合物的结构见图 1~3。
| 表 2 野甘草的化学成分 Table 2 Chemical components of S. dulcis |
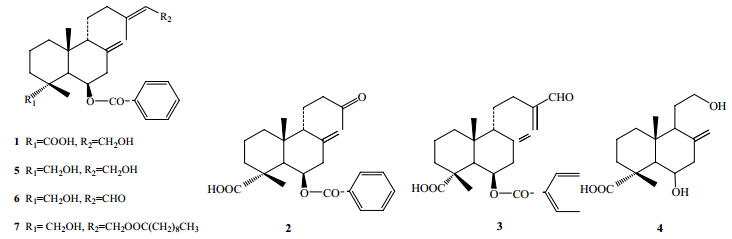 | 图 1 野甘草中labdane型二萜类化合物Fig. 1 Labdane-type diterpenes in S. dulcis |
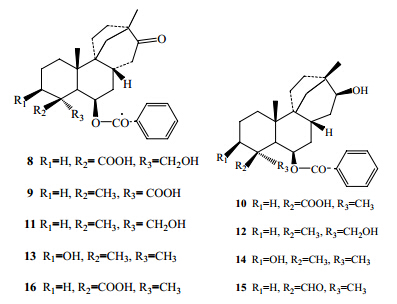 | 图 2 野甘草中scopadulan-type二萜类化合物Fig. 2 Scopadulan-type diterpenes in S. dulcis |
 | 图 3 野甘草中aphidicolin-type二萜类化合物Fig. 3 Aphidicolin-type diterpenes in S. dulcis |
至今为止,对野甘草的药理研究已有初步成果,主要集中在粗提物的药理功效上,也有部分实验研究了其中某些单体成分的药理活性。通过现有85篇文献统计表明,野甘草的药理活性研究主要集中在抗糖尿病、抗炎镇痛、抗氧化和抗微生物等方面。
3.1 抗糖尿病来自印度的Latha等[19]对野甘草的抗氧化和降血糖活性进行了一系列研究。2003年研究了野甘草提取物(水、乙醇、氯仿)对链脲菌素诱导的糖尿病大鼠的作用,使用其提取物后观察到肝、肾、脑中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽转移酶(GST)、还原型谷胱甘肽(GSH)、胰岛素、维生素C和维生素E的水平显著上升。此外,治疗组大鼠血糖水平、硫代巴比妥酸反应物质和氢过氧化物的生成显著降低,表明野甘草对脂质过氧化引起的膜损伤具有保护作用。说明其提取物尤其是水提物,对链脲佐菌素(STZ)诱导的糖尿病大鼠是通过减轻脂质过氧化而发挥调节血糖的作用[19]。
2004年Pari等[20]研究了野甘草水提物对链脲菌素诱导的雄性糖尿病大鼠的血糖、胰岛素和一些多元醇途径酶方面的影响。通过检查糖尿病大鼠的肝来探讨其水提物在多元醇途径和脂质过氧化方面的影响。野甘草提取物(200 μg/kg)和阳性对照药物格列本脲(600 μg/kg)连续6周ig糖尿病大鼠,结果发现,相比于格列本脲组,野甘草提取物组大鼠血糖、山梨糖醇脱氢酶、糖基化血红蛋白、硫代巴比妥酸反应物和氢过氧化物水平显著降低,而血浆胰岛素、GSH-Px、GST和GSH水平显著提高。该提取物的作用可能是由于减少葡萄糖流入多元醇途径,导致抗氧化酶和胰岛素活性增强和山梨糖醇脱氢酶活性降低。
2009年,在STZ诱导的糖尿病雄性Wistar大鼠上评估了野甘草的乙醇提取物中分离出的1种二萜——scoparic acid D(SAD)的抗高血糖作用。15 d口服给药SAD分别是10、20和40 mg/kg,与对照组相比,实验组血糖水平下降。SAD处理的大鼠的血糖水平的改善与胰岛素水平显著增加相关联。此外,使用SAD对STZ诱导的大鼠胰岛细胞系(RINm5F细胞)和体外分离的胰岛进行了测试。
20 mg/kg剂量的SAD诱发胰岛素分泌的双重刺激,表明胰岛素的分泌活动。RINm5F细胞中,SAD减轻STZ介导的细胞毒性和减少一氧化氮(NO)的产生。研究证实了SAD的抗高血糖作用,也表现出持续强劲的细胞保护性能[6]。
3.2 抗氧化作用通过测量氧化损伤程度及抗氧化防御系统的状态,来指示糖尿病大鼠大脑氧化应激的程度。实验表明野甘草具有抗过氧化的功能[21]。野甘草的己烷、氯仿和甲醇提取物通过酶在多种抗氧化模型介导(黄嘌呤氧化酶和脂氧合酶)或非介导(DPPH、铁离子的还原能力、β-胡萝卜素褪色法、脂质过氧化法)展现出良好的抗氧化能力。这与提取物所含有多酚和类胡萝卜素有关。其中氯仿提取物所含的化学成分最多且在不同的抗氧化系统中均具有较高的抗氧化能力。所有的提取物对黄嘌呤氧化酶表现出小于的50%抑制,对脂质过氧化反应和脂氧合酶表现出大于50%的抑制[22]。
3.3 镇痛及抗炎作用研究发现野甘草水提物(WE)和乙醇提取物(EE)具有镇痛、抗炎和解热的作用。口服2种提取物均能延长由戊巴比妥诱导的小鼠睡眠时间,EE比WE更有效。给麻醉大鼠注射EE(0.5~2 mg/kg)可引起与剂量相关的可被α-阻滞剂抑制的高血压,但口服处理并没有引起高血压。小鼠口服EE(0.25~1 g/kg)可减轻乙酸所致的扭体。EE中的主要三萜成分β-粘霉烯酮(30 mg/kg)能产生相同效果。2种提取物均未影响小鼠的尾拍打反应。大鼠口服EE(0.5和1 g/kg)和β-粘霉烯酮(30 mg/kg)能减轻角叉菜胶诱发的足肿胀和胸膜炎,但只有EE(1 g/kg)能减轻右旋糖酐或组胺引起的足肿胀。以上结果表明野甘草提取物具有镇痛作用,这些效应主要与β-粘霉烯酮和黄酮类化合物在急性炎症过程的早期阶段发挥作用有关[23]。观察野甘草70%乙醇提取物(SDE)的抗炎活性及桦木酸对角叉菜胶引起的小鼠足肿胀作用。结果表明,给药3、4和5 h后,SDE(0.5、1.0 g/kg)和桦木酸(20、40 mg/kg)可减轻足肿胀[24]。
3.4 保肝作用用四氯化碳诱导的急性肝损伤小鼠来评估野甘草70%乙醇提取物的保肝作用。小鼠连续5 d口服野甘草乙醇提取物(0.1、0.5和1.0 g/kg),然后用剂量为0.2%的四氯化碳(10 mL/kg)ip诱导小鼠急性肝损伤,结果表明野甘草醇提物可明显降低血清中丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)的水平。病理组织切片显示,野甘草乙醇提取物能减少四氯化碳诱导的肝损伤,包括空泡形成、中性粒细胞浸润和坏死减少。此外,与模型组相比,野甘草乙醇提取物降低了肝组织中丙二醛(MDA)水平,升高了GSH的量,并提高肝抗氧化酶活性,包括SOD、GSH-Px、GST和谷胱甘肽还原酶(GRd)。因此,野甘草的保肝机制可能是通过防止肝脏SOD、GSH-Px、GRd和GST等抗氧化酵素活性下降,引起MDA量的下降和GSH量的提高,减少脂质过氧化的伤害[4]。
3.5 抗溃疡大鼠口服野甘草水提物,剂量分别为50、100和200 mg/kg,5 min后均口服吲哚美辛(50 mg/kg)诱导胃黏膜损伤,野甘草水提物能明显抑制吲哚美辛诱导的胃溃疡形成,并呈现剂量依赖性,从而表明其具有保护胃黏膜的功能。证明了野甘草在民族医学中被用于治疗胃病的正确性[25]。Wistar大鼠均以醋酸烧灼法制备胃溃疡模型,实验组给予野甘草乙醇提取物1 g/kg,喂30 d后剖腹取胃,测定溃疡的面积大小,与模型组比较,实验组胃溃疡面积明显缩小,然后切除胃窦部,刮下胃黏膜,测定胃H+,K+-ATP酶活性,实验组大鼠胃H+,K+-ATP酶活性低于模型组,并且有统计学差异[26]。
3.6 抗菌作用通过纸片扩散法评估野甘草乙醇提取物对12种人类致病细菌菌株及3株真菌的体外抗菌活性。与对照药物卡那霉素(30 μg/disc)和制霉菌素(20 μg/disc)比较,野甘草乙醇提取物对金黄色葡萄球菌和甲型副伤寒沙门菌均有抑制作用,最低抑菌浓度均为256 mg/mL[27]。
研究野甘草的氯仿-甲醇成分在不同浓度下抗细菌和抗真菌作用。分别检测分离出的组分对不同的细菌如伤寒菌、金黄色葡萄球菌、黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、铜绿假单胞菌、普通变形杆菌,真菌菌株如棉黑斑病菌、白色念珠菌、黑曲霉和尖孢镰刀菌的抑制作用。与对照药物相比,分离出的组分表现出显著的抗细菌和抗真菌活性[28]。
3.7 抗肿瘤研究scopadulcic acid B(SDB)对体外正常人体组织或肿瘤细胞衍生的细胞系的细胞毒活性,及体内对抗艾氏腹水瘤细胞作用,并用5-Fu作为对照药。体外实验显示,从野甘草中分离的SDB有强细胞毒性,对肿瘤组织的细胞系IC50为0.068~0.076 μg/mL。用接种艾氏腹水瘤细胞的小鼠来研究SDB体内抗肿瘤活性,口服25或100 mg/kg的SDB能延长动物的平均存活时间[29]。野甘草的粗提物对6种人胃癌细胞系SCL、SCL-6、SCL-37′6、SCL-9、Kato-3和NUGC-4测试后发现具有细胞毒活性[7]。
3.8 神经保护作用野甘草甲醇提取物能明显增强PC12D细胞中神经生长因子介导的神经突触的活性[30]。
4 毒性研究中枢神经系统毒理实验表明:当大鼠腹腔给药剂量大于半数致死量(LD50),不同剂量的野甘草甲醇和水提取物停药后对大脑进行解剖及病理组织学分析。有毒剂量的野甘草提取物显示促炎效应从而有导致脑水肿的倾向。这是由于细胞代谢紊乱造成神经胶质细胞膜中的钠和钾泵不能充分运转,导致钠和水的潴留。大脑的灰质和白质有肿胀的星形胶质细胞。毒性临床病例证实野甘草在脑水肿的治疗上应当按指导进行,因为大脑是体内最易受影响的器官之一,在高剂量使用时具有潜在的毒性[31]。
传统使用野甘草作为流产或避孕药物,且其根的水提取物对大鼠子宫有刺激作用,因此在怀孕和哺乳期间不能使用该药物。
5 结语与展望野甘草分布广泛,易生长,常生于荒地及路边,但近年来由于没有得到重视和保护,其资源日益减少。此外,国内对野甘草的研究较少,大家对其认识不足,致使其没有得到较好的开发。野甘草是一种应用历史悠久的民族药(中国、日本、印度、巴拉圭等),所流传下来的功效和适应症也是多种多样的。从文献统计表明,近年来对野甘草的药理学和植物学研究较多,其中药理学研究主要集中在抗糖尿病、抗氧化、镇痛消炎方面,另外抗溃疡、抗病毒、抗肿瘤方面也有报道。化学成分和药理作用等方面的研究进一步证实了野甘草的药用价值。野甘草水提物展现了良好的抗氧化性能,并且有甜味,口感好的特点,在我国南方有将其制成保健茶饮的用法,起到抗衰老的作用。野甘草的降血糖作用一直是印度研究学者Latha和Pari的研究重点,十多年的研究证明野甘草具有较好的降血糖作用,是理想的治疗糖尿病的药物。其机制可能与抗氧化相关,也可能是通过减少葡萄糖流入多元醇通路的途径,增强抗氧化酶和胰岛素活性。
然而,野甘草在高剂量使用时具有潜在的毒性。高剂量的野甘草水提物和甲醇提取物都有促炎效应和引起脑水肿的倾向。但到目前为止鲜见对于野甘草的毒理研究,为数不多的毒理研究数据并不能完全说明其毒性问题,且实验仅说明在高剂量使用时野甘草才产生毒性,野甘草有被作为茶饮的习惯,所以其每日饮用的剂量范围应当引起重视。因此研究者和医生应当对野甘草的使用剂量引起关注。建议后续能开展毒理方面的研究。尤其应该注意的是在国外记载的传统使用中有将野甘草作为流产或避孕药物使用,但并没有现代药理实验证明这种使用方法的正确性,因此迫切需要进一步研究证明。
野甘草在中国的药用历史悠久,且被多个国家作为各自的民族药使用,但由于国内对其研究及认识不足,其资源在渐渐消失。因此希望引起研究者的重视,充分挖掘和利用野甘草的药用功效,丰富我国的药用资源宝库。
| [1] | 冉先德. 中华药海 [M]. 哈尔滨: 哈尔滨出版社, 1993. |
| [2] | 朱 华. 中国壮药志 (第1卷) [M]. 南宁: 广西民族出版社, 2003. |
| [3] | Latha M, Ramkumar K M, Pari L, et al. Phytochemical and antimicrobial study of an antidiabetic plant: Scoparia dulcis L. [J]. J Med Food, 2006, 9(3): 391-394. |
| [4] | Tsai J C, Peng W H, Chiu T H. Hepatoprotective effect of Scoparia dulcis on carbon tetrachloride induced acute liver injury in mice [J]. Am J Chin Med, 2010, 38(4): 761-775. |
| [5] | Hayashi T. Biologically active diterpenoids from Scoparia dulcis L. (scrophul-ariaceae) [J]. Studies Nat Prod Chem, 2000, 21B: 689-727. |
| [6] | Latha M, Pari L, Ramkumar K M, et al. Antidiabetic effects of scoparic acid D isolated from Scoparia dulcis in rats with streptozotocin-induced diabetes [J]. Nat Prod Res, 2009, 23(16): 1528-1540. |
| [7] | Ahsan M, Islam S N, Gray A I, et al. Cytotoxic diterpenes from Scoparia dulcis [J]. J Nat Prod, 2003, 66(7): 958-961. |
| [8] | Ahsana M, Haquea M R, Islamb S K N. New labdane diterp-enes from the aerial parts of Scoparia dulcis L. [J]. Phytochem Lett, 2012, 5(3): 609-612. |
| [9] | Phan M G, Phan T S, Matsunami K, et al. Chemical and biological evaluation on scopadulane-type diterpenoids from Scoparia dulcis of Vietnamese origin [J]. Chem Pharm Bull, 2006, 54(4): 546-549. |
| [10] | Saikia R, Choudhury M D, Talukdar A D, et al. Antidiabetic activity of Ethno medicinal plant Scoparia dulcis L. (Family: Scrophulariaceae): A review [J]. Assam Univ J Sci Technol, 2011, 7(1): 173-180. |
| [11] | Mahato S B, Das M C, Sahu N P. Triterpenoids of Scoparia dulcis [J]. Phytochemistry, 1981, 20(1): 171-173. |
| [12] | 李奇勋, 李运昌, 聂瑞麟, 等. 野甘草的薏苡素和白桦脂酸 [J]. 云南植物研究, 1981, 3(4): 475-477. |
| [13] | Babincová M, Schronerová K, Sourivong P. Antiulcer activity of water extract of Scoparia dulcis [J]. Fitoterapia, 2008, 79(7/8): 587-588. |
| [14] | Kamperdick C, Lien T P, Sung T V, et al. 2-Hydroxy-2 H-1, 4-benzoxazin-3-one from Scoparia dulcis [J]. Pharmazie, 1997, 52(12): 965-966. |
| [15] | Wu W H, Chen T Y, Lu R W, et al. Benzoxazinoids from Scoparia dulcis (sweet broomweed) with antiproliferative activity against the DU-145 human prostate cancer cell line [J]. Phytochemistry, 2012, 83: 110-115. |
| [16] | Kawasaki M, Hayashi T, Arisawa M, et al. 8-Hydroxytricetin 7-glucuronide, a β-glucuronidase inhibitor from Scoparia dulcis [J]. Phytochemistry, 1988, 27(11): 3709-3711. |
| [17] | Li Y, Chen X, Satake M, et al. Acetylated flavonoid glycosides potentiati-ng NGF action from Scoparia dulcis [J]. J Nat Prod, 2004, 67(4): 725-727. |
| [18] | Satyanar K. Chemical examination of Scoparia dulcis (Linn). [J]. J Indian Chem Soc, 1969, 46(8): 765-766. |
| [19] | Latha M, Pari L. Modulatory effect of Scoparia dulcis in oxidative stress-induced lipid peroxidation in streptozotocin diabetic rats [J]. J Med Food, 2003, 6(4): 379-386. |
| [20] | Latha M, Pari L. Effect of an aqueous extract of Scoparia dulcis on blood glucose, plasma insulin and some polyol pathway enzymes in experimental rat diabetes [J]. Brazilian J Med Biol Res, 2004, 37(4): 577-586. |
| [21] | Pari L, Latha M. Protective role of Scoparia dulcis plant extract on brain antioxidant status and lipid peroxidation in STZ diabetic male wsitar rats [J]. BMC Complem Alternat Med, 2004, 4(16):1-8. |
| [22] | Coulibaly A Y, Kiendrebeogo M, Kehoe P G, et al. Antioxidant and anti-inflammatory effects of Scoparia dulcis L. [J]. J Med Food, 2001, 14(12): 1576-1582. |
| [23] | De Farias Freire S M, Da Silva Emim J A, Lapa A J, et al. Analgesic and anti-inflammatory properties of Scoparia dulcis L. extracts and glutinol in rodents [J]. Phytother Res, 1993, 7(6): 408-414. |
| [24] | Tsai J C, Peng W H, Chiu T H, et al. Anti-inflammatory effects of Scoparia dulcis L. and betulinic acid [J]. Am J Chin Med, 2011, 39(5): 943-956. |
| [25] | Babincová M, Schronerová K, Sourivong P. Antiulcer activity of water extract of Scoparia dulcis [J]. Fitoterapia, 2008, 79(7): 587-588. |
| [26] | 刘 波. 野甘草乙醇提取物对大鼠胃溃疡的治疗作用及对胃H+, K+-ATP酶活性作用研究 [D]. 沈阳: 中国医科大学, 2001. |
| [27] | Zulfiker A H M, Ripa F A, Rahman M M. Antidiabetic and antioxidant effect of Scoparia dulcis in alloxan induced albino mice [J]. Int J PharmTech Res, 2010, 2(4): 2527-2534. |
| [28] | Hayashi K, Hayashi T, Morita N. Cytotoxic and antitumour activity of scopadulcic acid from Scoparia dulcis L. [J]. Phytother Res, 1992, 6(1): 6-9. |
| [29] | Esume C O. Toxicological effects of extracts of the leaves of Scoparia dulcis on the brain of rats [J]. Continental J Pharmacol Toxicol Res, 2011, 4(1): 30-34. |
| [30] | Hayashi T. Investigation on traditional medicines of guarany indio and studies on diterpenes from Scoparia dulcis [J]. Yakugaku Zasshi, 2011, 131(9): 1259-1269. |
| [31] | Mesía-Vela S, Bielavsky M, Torres L M B, et al. In vivo inhibition of gastric acid secretion by the aqueous extract of Scoparia dulcis L. in rodents [J]. J Ethnopharmacol, 2007, 111(2): 403-408. |
 2015, Vol. 46
2015, Vol. 46


