2. 杭州市中医院 骨科, 浙江 杭州 310007;
3. 台州学院医药化工学院, 浙江 椒江 318000;
4. 台州学院生命科学学院, 浙江 椒江 318000
2. Department of Orthopaedics, Hangzhou Hospital of Traditional Chinese Medicine, Hangzhou 310007, China;
3. College of Pharmaceutical and Chemical Engineering, Taizhou University, Jiaojiang 318000, China;
4. College of Life Science, Taizhou University, Jiaojiang 318000, China
堇菜属Viola L. 植物为多年生或二年生草本,稀半灌木,生于灌丛、路边、林缘和草地,广布于温带、热带及亚热带,全世界有500余种,我国有100多种,其中的不少种类具有药用价值,在民间被广泛使用[1]。堇菜属药用植物富含类黄酮、香豆素类、萜类和挥发油等成分,具有清热解毒、生肌接骨和消肿排脓等功效,用于治疗跌打损伤、风热咳嗽、咽喉肿痛、无名肿毒、风湿和哮喘等[2]。堇菜Viola verecunda A. Grey、紫花地丁V. philippica Cav.、鸡腿堇菜V. acuminata Ledeb. 和七星莲V. diffusa var. brevibarbata Ging. 等都是民间常见的中草药,如堇菜可全草入药,具清热解毒、散瘀和止咳功效,用于治疗疖肿、结膜炎和上呼吸道感染等;紫花地丁则有凉血消肿、清热解毒和散瘀作用,可治疗目赤、咽喉肿痛和黄疸性肝炎等[3, 4]。近年来,有关堇菜属药用植物的研究涉及化学成分、药理作用、资源调查、形态学分类、遗传多样性、组织培养和遗传转化等方面[5, 6, 7, 8, 9, 10, 11]。不同堇菜属药用植物的成分和功效有一定差异,而在药材市场中常出现混淆现象,为临床正确应用带来了一定的麻烦。形态学鉴定是中草药识别的常规方法,但易受基因型、环境和加工程度等因素的干扰。核糖体DNA内转录间隔区(internal transcribed spacer,ITS)序列因长度保守、信息位点丰富,在中草药鉴定中有着广泛的应用[12, 13, 14]。本研究以采自浙江的11种堇菜属植物为材料,通过测定和比较它们的ITS序列,以期为该属药用植物的分子鉴定提供参考。
1 材料与仪器 1.1 材料堇菜V. verecunda A. Grey、紫花堇菜V. grypoceras A. Gray、戟叶堇菜V. betonicifolia J. E. Smith、白花堇菜V. lactiflora Nakai、七星莲V. diffusa var. brevibarbata Ging.、南山堇菜V. chaerophylloides (Regel) W. Beck.、紫花地丁V. philippica Cav.、鸡腿堇菜V. acuminata Ledeb.、柔毛堇菜V. fargesii H. Boissieu、长萼堇菜V. inconspicua Blume和辽宁堇菜V. rossii Hemsl. ex Forbes et Hemsl. 均由笔者鉴定,采集地点和海拔等信息见表 1;每个物种采集4个单株的叶片,带回实验室后用自来水洗净,再用无菌水冲洗2~3次,置于-80 ℃低温冰箱中备用。
| 表 1 堇菜属植物来源 Table 1 Sources of plants in Viola L. |
BIO-RAD C1000型PCR仪;北京六一DYY-12型电泳仪和电泳槽;BIO-RAD Gel Doc XR+凝胶成像系统;SANYO MDF-382E型超低温冰箱;Eppendorf移液枪;超净工作台;BECKMAN Allegra 64R高速冷冻离心机;37 ℃恒温摇床。
2 方法 2.1 基因组DNA的提取基因组DNA的提取采用试剂盒法,试剂盒购自北京鼎国昌盛生物技术有限责任公司(北京鼎国),操作根据“新型植物基因组DNA快速提取试剂盒”说明书进行。基因组DNA经电泳检测后,置于-20 ℃冰箱中保存备用。
2.2 ITS序列的克隆、转化和测序ITS序列的克隆采用通用引物,上、下游引物分别为5’-TATGCTTAAAYTCAGCGGGT-3’和5’-AACAAGGTTTCCGTAGGTGA-3’,由生工生物工程(上海)股份有限公司合成,纯化方式为PAGE。20 μL反应体系中依次加入2 μL 10×PCR缓冲液(含20 mmol/L Mg2+)、0.50 μL dNTPs(Genview)、各0.40 μL上、下游引物(20 μmol/L)、35 ng基因组DNA和0.50 μL的Taq DNA聚合酶(2 U/μL,北京鼎国),最后加无菌ddH2O至终体积。反应在BIO-RAD C1000型PCR仪上进行,扩增程序为94 ℃预变性5 min,94 ℃变性45 s,54.8 ℃退火45 s,72 ℃延伸90 s,循环次数为33。
2.3 PCR产物的回收、连接和测序制备1.2%琼脂糖凝胶用于PCR产物的电泳,在紫外灯下用洁净刀片割取含目的条带的胶块。DNA回收采用快速凝胶回收纯化试剂盒(北京鼎国),操作根据说明书进行。各取2 μL经纯化的目的片段,用p-GEM T-easy试剂盒(Promega)连接,室温放置2 h,将连接产物转入DH5α感受态细胞,经蓝白斑筛选和PCR验证后,每个单株各取3份阳性菌液测序。
2.4 序列分析序列比对采用ClustalX 1.81软件[15];系统发育树的构建用MEGA 3.1软件[16],建树方法为NJ(Neighbor Joining,邻接法),经1 000次自举检测。
3 结果与分析 3.1 ITS序列的克隆利用通用引物,用PCR方法从11种堇菜属植物中克隆到各自的rDNA ITS序列。测序结果表明,每种植物4个单株的测序结果完全一致。11种堇菜属植物的ITS序列全长为612~638 bp,紫花堇菜和鸡腿堇菜的序列最短,均为612 bp,柔毛堇菜次之,为628 bp,白花堇菜的ITS序列最长。ITS1与ITS2的长度为251~265 bp和198~211 bp,白花堇菜的ITS1序列最长,紫花地丁次之,为264 bp,鸡腿堇菜和紫花堇菜最短;长萼堇菜的ITS2序列最长,白花堇菜和紫花地丁次之,为210 bp,紫花堇菜和鸡腿堇菜最短。11种堇菜属植物的5.8 S长度均为163 bp,与ITS1和ITS2相比,长度十分保守(表 2)。
| 表 2 堇菜属植物ITS序列的长度及GC量 Table 2 Sequence length and GC contents of ITS from plants in Viola L. |
5.8 S的GC值为53.4%~54.6%,堇菜、紫花堇菜、鸡腿堇菜和柔毛堇菜的GC值最高,戟叶堇菜、七星莲、南山堇菜、紫花地丁和辽宁堇菜的GC值次之,均为54.0%,白花堇菜和长萼堇菜的最小。ITS1和ITS2的GC值均高于5.8S,ITS1的GC值为63.4%~68.0%,柔毛堇菜的GC值最大,堇菜和辽宁堇菜次之,为67.2%,七星莲的GC值最小。ITS2的GC值为60.3%~67.7%,变异幅度较ITS1和5.8S大,鸡腿堇菜的GC值最大,其次为紫花堇菜,GC值为67.2%,七星莲的GC值最小(表 2)。
3.2 5.8 S序列的比较分析利用ClustalX 1.81对11种堇菜属药用植物的ITS序列进行比对,并借助MEGA 3.1计算5.8S的变异位点及信息位点。结果表明(图 1),11种堇菜属植物的5.8 S序列有5个可变位点(Variable sites),其中信息位点(parsimony informative sites)3个。戟叶堇菜、七星莲、南山堇菜和辽宁堇菜的5.8 S序列完全一致;堇菜和柔毛堇菜及紫花堇菜和鸡腿堇菜的5.8 S序列相同,与前述4种仅一个碱基的差异,分别位于132 bp和131 bp处;白花堇菜和长萼堇菜与前述4种也只有一个碱基的差异,分别在59 bp和122 bp处。
 | 图 1 堇菜属11种药用植物的5.8 S序列Fig. 1 5.8 S sequences of 11 medicinal plants in Viola L. |
11种堇菜属植物的ITS1序列差异较大,存在转换、颠换、插入或缺失现象。比对结果表明,ITS1有可变位点87个,信息位点50个。紫花堇菜和鸡腿堇菜的序列较其他9种短,在60~68 bp、75~80 bp和263~264 bp均有缺失现象,但在122 bp有一个碱基的插入;与白花堇菜相比较,其他植物在60和66 bp均有1个碱基的缺失;除紫花地丁和白花堇菜外,其余物种在263和264 bp均有2个碱基的缺失(图 2)。ITS1中,转换和颠换现象十分普遍,与其他10条序列相比,七星莲的7 bp和紫花地丁的8 bp均发生颠换,碱基由C变为A;南山堇菜、紫花地丁、戟叶堇菜和长萼堇菜在35 bp处发生转换,碱基由C变为T(图 2)。
 | 图 2 堇菜属11种药用植物的ITS1序列Fig. 2 ITS1 sequences of 11 medicinal plants in Viola L. |
与ITS1类似,11种植物ITS2序列之间的变异较大,共有54个可变位点,其中信息位点23个。与其他9种堇菜属植物相比,紫花堇菜和鸡腿堇菜有较多的缺失现象,分别发生在14~17、34~35、44~48、88~89和196 bp处;除长萼堇菜外,其他10条序列在45和46 bp位置有2个碱基的缺失;白花堇菜和紫花地丁在196 bp处有1个碱基的插入。ITS2序列的转换与颠换现象也十分普遍,如柔毛堇菜在6 bp处发生颠换,碱基由C变为A;戟叶堇菜和南山堇菜在19 bp处发生转换,碱基由C变为T;七星莲ITS2序列在79、84、180和201 bp位置的C转换成T,121 bp处碱基C颠换成A,而132和181 bp位置的G均转换成T(图 3)。
 | 图 3 堇菜属11种药用植物的ITS2序列Fig. 3 ITS2 sequences of 11 medicinal plants in Viola L. |
以蜜花堇属Melicytus药用植物蜜花堇M. ramiflorus 为外类群,利用Mega软件计算遗传距离,结果表明(图 4),11种堇菜属植物的总遗传距离为0.078,其中紫花堇菜和鸡腿堇菜的遗传距离最小,仅0.015,戟叶堇菜和长萼堇菜次之,遗传距离为0.025;紫花堇菜与七星莲的遗传距离最大,为0.137,鸡腿堇菜和七星莲次之,遗传距离为0.129。从系统发育树上看,戟叶堇菜、长萼堇菜、白花堇菜和紫花地丁聚为一组,在植物分类学上,它们同属合生托叶组;紫花堇菜和鸡腿堇菜聚为一组,它们同属鸟嘴柱状组;裂叶堇菜组的南山堇菜和蔓茎堇菜组的七星莲分别处于不同分支;堇菜、辽宁堇菜和柔毛堇菜聚为一组;外类群蜜花堇单独聚为一组,它与11种堇菜属植物的遗传距离为0.284~0.327。
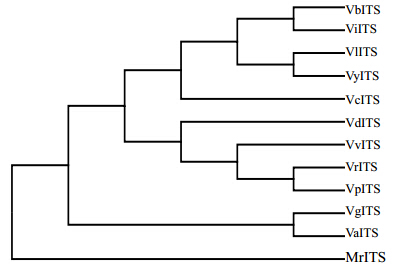 | 图 4 基于ITS序列构建的系统发育树Fig. 4 Phylogenetic tree constructed based on ITS sequences |
正确鉴别中草药原植物、药材和成药是中药现代化生产的基础,也是保证疗效和维系人们健康的保障。部分药用植物在形态上十分相似,不同产地或环境条件也会造成外观上的差异,加工炮制后的药材用常规方法鉴定更难[17]。而植物基因组DNA性质稳定,没有器官、组织和细胞的特异性,其组成和结构也不受发育阶段及外界环境的影响,新鲜样品、干燥材料甚至加工后的药材也可用于DNA的提取,因此DNA分子标记已成为中草药鉴定的常用技术,其中以rDNA ITS标记最为普遍,近年来有广泛应用[18]。魏艺聪等[13]以不同居群草珊瑚和5种金粟兰属近缘种为材料,扩增到各自的ITS序列,经比对,发现序列中存在多个特异性信息位点,可用于这些样品的区分。彭梓等[15]以杜仲及其混淆品扶芳藤、冬青卫矛和紫花络石等为材料,通过比较ITS2二级结构,发现杜仲及其混伪品在螺旋区的茎环数目、大小和位置等均存在差异。朱爽等[19]利用ITS结合RFLP技术研究毛钩藤和无柄果钩藤之间的关系,为钩藤属植物的鉴定提供了分子依据。
本研究以11种常见的堇菜属药用植物为材料,在克隆ITS全长的基础上进行了序列比对和分析。堇菜属植物的5.8 S十分保守,全长均为163 bp,这是因为5.8 S在进化过程中所受的选择压力较大所致,植物5.8 S的长度通常为163或164 bp[20],也有长度为154、155和162 bp的报道[21, 22, 23, 24]。11种堇菜属植物的ITS1和ITS2序列长度变异较大(612~638 bp),序列中的信息位点丰富,在漫长的进化过程中,由于ITS1和ITS2受到的选择压力非常小,能容许更多变异的存在,最终导致序列长度和碱基组成产生差异,ITS1和ITS2已广泛应用于近缘种的分子鉴定[25]。堇菜属11种药用植物共有141个变异位点和73个信息位点,这些信息位点可将它们完全区分开,可作为这些物种鉴定的分子标记。堇菜属药用植物ITS序列的克隆,为遗传多样性研究、地理学和鉴定提供了分子依据。
| [1] | 中国科学院中国植物志编辑委员会. 中国植物志 (第51卷) [M]. 北京: 科学出版社, 1991. |
| [2] | 徐国兵. 堇菜属植物药用研究进展 [J]. 基层中药杂志, 1995, 9(2): 36-38. |
| [3] | 姚振生, 傅骞峰, 曹 岚. 江西省堇菜属药用植物资源及利用 [J]. 江西科学, 2001, 19(2): 104-107. |
| [4] | Pan Y Y. Antipyretic effects of liposoluble fractions of Viola yedoensis [J]. Chin Herb Med, 2015, 7(1): 80-87. |
| [5] | 吴建芳, 李炳奇, 薛 梅, 等. 天山堇菜中总黄酮和多糖的微波提取与含量测定 [J]. 时珍国医国药, 2010, 21(5): 1105-1107. |
| [6] | 徐凤文. 东北堇菜抗炎作用的实验研究 [J]. 吉林中医药, 2005, 25(12): 61-61. |
| [7] | 李彦连. 山东省堇菜属药用植物资源及利用 [J]. 北方园艺, 2008(1): 237-238. |
| [8] | 李连方, 尹祖棠. 堇菜属植物花粉及叶表皮超微形态多样性的研究 [J]. 中国农业大学学报, 2000, 5(3): 6-12. |
| [9] | 王旭红, 秦民坚, 吴永强. 南京地区6种堇菜属植物叶表皮的显微结构比较 [J]. 中药材, 2003, 26(10): 706-709. |
| [10] | 李 昂, 王可青, 葛 颂. 不同采样策略对细距堇菜遗传多样性估算的影响 [J]. 植物学报, 2000, 42(10): 1069-1074. |
| [11] | 朱锦懋, 代容春, 林国宇, 等. 蔓茎堇菜愈伤组织分化再生植株 [J]. 福建师范大学学报: 自然科学版, 2001, 17(1): 79-83. |
| [12] | 代容春, 林荣华, 何文锦, 等. 农杆菌介导白藜芦醇合酶基因转化蔓茎堇菜的研究 [J]. 生物技术, 2009, 19(4): 16-17. |
| [13] | 魏艺聪, 陈 莹, 牛广俊, 等. 不同居群草珊瑚的ITS序列分析及模式识别研究 [J]. 中草药, 2014, 45(20): 2982-2986. |
| [14] | 倪梁红, 赵志礼, 孟千万, 等. ITS和psbA-trnH序列鉴别绿绒蒿属藏药植物 [J]. 中草药, 2014, 45(4): 541-545. |
| [15] | 彭 梓, 朱金国, 谭建锡, 等. 基于ITS2序列的杜仲及其主要混伪品的鉴定 [J]. 中草药, 2013, 44(21): 3042-3047. |
| [16] | Thompson J D, Gibson T J, Plewniak F, et al. The CLUSTAL_X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools [J]. Nucl Acids Res, 1997, 25(24): 4876-4882. |
| [17] | Kumar S, Tamura K, Nei M. MEGA3: Integrated software for molecular evolutionary genetics analysis and sequence alignment [J]. Brief Bioinform, 2004, 5(2): 150-163. |
| [18] | 李文强, 黄士良, 牛玉璐, 等. DNA分子标记技术在中草药鉴别中的应用 [J]. 河北师范大学学报: 自然科学版, 2005, 29(6): 617-622. |
| [19] | 朱 爽, 周 林, 黄楷鸿, 等. 毛钩藤和无柄果钩藤的ITS序列分析研究 [J]. 中草药, 2010, 41(10): 1696-1700. |
| [20] | Baldwin B G, Sanderson M J, Porter J M, et al. The ITS region of nuclear ribosomal DNA: A valuable source of evidence of angiosperm phylogeny [J]. Ann Mol Bot Gard, 1995, 82: 247-277. |
| [21] | 李小刚, 王有科, 李 捷, 等. 基于nrDNA-ITS序列的10种枸杞属植物亲缘关系研究 [J]. 中国农学通报, 2014, 30(25): 128-135. |
| [22] | 朱英杰, 陈士林, 姚 辉, 等. 重楼属药用植物DNA条形码鉴定研究 [J]. 药学学报, 2010, 45(3): 376-382. |
| [23] | 宁璇璇, 纪 灵, 王 刚, 等. 烟台海域暴发浒苔ITS及5.8 S rDNA的克隆及序列分析 [J]. 海洋通报, 2010, 29(1): 91-95. |
| [24] | 袁长春, 黎培新, 王燕芳, 等. 用核糖体ITS区序列验证自然杂交种Meconopsis×cookei G. Taylor [J]. 遗传学报, 2004, 31(9): 901-907. |
| [25] | Nolan M J, Cribb T H. The use and implications of ribosomal DNA sequencing for the discrimination of digenean species [J]. Adv Parasitol, 2005, 60: 101-163. |
 2015, Vol. 46
2015, Vol. 46

