接骨草Sambucus chinensis Lindl. 又名陆英、八棱麻、蒴藋等,属于忍冬科(Caprifoliaceae)接骨木属Sambucus L. 多年生草本植物,在我国分布广泛,资源丰富。接骨草主要用于治疗跌打损伤,是一种传统中草药,近年研究发现其有抗氧化[1]、抗病毒[2]和抗肿瘤[3]等功效,尤其是治疗黄疸型和病毒性肝炎,效果显著且无毒性[4]。研究认为乌索酸是接骨草治疗肝炎的主要活性成分[5],齐墩果酸能有效治疗传染性黄疸肝炎[6]。乌索酸和齐墩果酸均属萜类化合物。在高等植物中,萜类化合物主要由甲羟戊酸(MVA)途径合成,MVA为萜类合成的前体。3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)是MVA途径中的首个重要限速酶,催化3-羟基-3-甲基戊二酰辅酶A不可逆的形成MVA,是萜类物质代谢中的关键调控位点[7]。目前,已在大戟[8]、茅苍术[9]、桑[10]、球药隔重楼[11]、建泽泻[12]、秦艽[13]、南京椴[14]、刺五加[15]、雷公藤[16]、人参[17, 18]等药用植物中成功分离、克隆得到HMGR基因,然而接骨草HMGR基因未见相关报道。
本研究拟克隆接骨草HMGR基因cDNA序列,利用生物信息学对其推导的氨基酸序列进行分析,检测该基因在不同组织器官中的表达特异性。为进一步研究该基因的分子调控机制并阐明其在接骨草萜类合成途径中的重要作用提供理论基础。
1 材料与方法 1.1 材料与试剂样品于2014年6月5日采自怀化学院植物种植园,经怀化学院伍贤进教授鉴定为接骨草Sambucus chinensis Lindl. 的根状茎、地上茎、叶片、花,洗净后,乙醇擦拭,经焦碳酸二乙酯(DEPC)处理水及蒸馏水冲洗后,放入液氮中保存,带回实验室,于-80 ℃冰箱保存备用。
RNA提取试剂盒、cDNA合成试剂盒、高保真DNA聚合酶Prime STARHS DNA Polymerase、克隆载体pMD 18-T Vector、质粒提取试剂盒、DNA回收纯化试剂盒、菌种JM109、DNA相对分子质量标记,T4 DNA连接酶、荧光定量试剂盒SYBR Prime ScriptTM RT-PCR Kit及电泳类试剂等,均购自TaKaRa公司。
1.2 方法 1.2.1 RNA的提取接骨草根状茎、地上茎、叶片及花RNA提取方法按照Trizol试剂说明书进行,提取后进行电泳检测,测定纯度及浓度;并于-80 ℃保存备用。
1.2.2 cDNA链合成根据试剂盒说明书进行,反转录产物合成后置于-20 ℃保存备用。
1.2.3 引物设计通过分析接骨草高通量转录组数据,发现一个被注释为HMGR的转录本,同已报道的其他植物[长春花(M96068)、马铃薯(L01400)、龙虎草(EF062569)、蒲公英(HQ857601)]HMGR基因的核苷酸序列进行比对,应用Oligo 6软件设计引物。上游引物HMGR-F:5’-ATGGACGTCCGA-CGGCGATCA-3’;下游引物HMGR-R:5’-TTAAG-AGGCAGCTTTGGTGAT-3’,由生工生物工程(上海)股份有限公司合成。
1.2.4 PCR扩增反应体系和反应条件参照文献报道[19],其中退火温度为58 ℃。
1.2.5 扩增片段的克隆测序、序列分析及HMGR生物信息学分析对PCR产物进行回收,连接载体pMD 18-T Vector,并转化感受态细胞JM109,蓝白筛选后,过夜培养白色菌落,提取质粒并鉴定,然后送生工生物工程(上海)股份有限公司测序。采用DNAStar软件包分析与处理序列,在NCBI网站上Blast比对及BioEdit软件分析,并用Mega6软件[20]进行UPMAG聚类分析。采用ExPASy Proteomics Server提供的在线工具对接骨草HMGR基因编码蛋白的理化性质及结构与功能进行预测[21, 22, 23]。
1.2.6 相对荧光定量PCR表达分析利用实时荧光定量PCR的方法检测HMGR基因在接骨草根状茎、地上茎、叶、花中的相对表达量,采用美国ABI7500实时PCR检测系统,上游引物qHMGR-F序列为:5’-CTCTTCTTCTCCGTGGTT-3’,下游引物qHMGR-R序列为:5’-GTAGATAAGGGTATGG-GTTC-3’。实时PCR 检测的反应体系如下:5 μL 2×SYBR® Premix Ex TaqTM,正反向引物均为0.3 μL,cDNA模板2 μL;加ddH2O至10 μL,反应程序:95 ℃、5 min,95 ℃、20 s,58 ℃、20 s,72 ℃、30 s,40个循环,实时PCR反应以接骨草18 S rDNA为内参,18 S rDNA序列设计引物18S-F:5’-CGGAAGGTCTGGG-TAATC-3’和18S-R:5’-ACGTAATCAACGCAAGCT-3’,产物大小为147 bp,每个反应重复3次。
2 结果与分析 2.1 接骨草HMGR基因克隆以总RNA反转录所得到的第一链cDNA为模板,用引物HMGR-F和HMGR-R进行PCR扩增。电泳检测发现在1 782 bp处有一条亮带,见图 1。
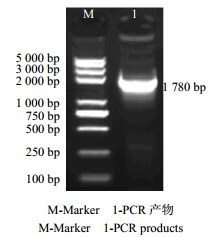 | 图 1 接骨草HMGR的PCR扩增Fig. 1 PCR amplification of HMGR of S. chinensis |
对扩增产物进行测序,其结果经Blast确定为接骨草HMGR 基因序列,经ORF Finder预测,该序列含有一个完整的开放阅读框,推测编码593个氨基酸,见图 2。
 | 划框部分为HMGR结合基序;划实线部分为NADPH结合基序 HMGR binding motif segment marked with frame,NADPH binding motif segment marked with full line图 2 接骨草HMGR基因的核苷酸序列及推测的氨基酸序列Fig. 2 New components isolated from mistletoe medium for PSB biotransforming |
接骨草HMGR基因预测编码593个氨基酸,利用ExPASy在线软件对其蛋白的理化性质进行预测分析。推测其分子式为C2508H4047N681O764S26,相对分子质量为56 798.3,等电点(pI)为5.97。该蛋白的不稳定系数(instability index)为36.89,属于稳定蛋白质。脂肪系数(aliphatic index)为98.09,亲水性系数(grand average of hydropathicity)为0.143,该蛋白不含信号肽,但含2个跨膜区,第1个跨膜区是第32~54位,第2个跨膜区是第489~511位(图 3)。
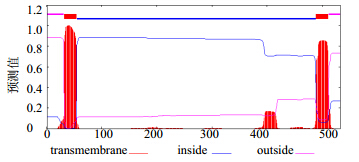 | 图 3 接骨草HMGR跨膜预测Fig. 3 Prediction of transmembrane regions of HMGR protein |
预测HMGR蛋白的二级结构如图 4所示,该蛋白的二级结构中α-螺旋占46.21%、β-折叠占6.65%、无规则卷曲占32.72%、延伸链占14.42%。由SWISS-MODEL预测HMGR的三级结构如图 5所示。
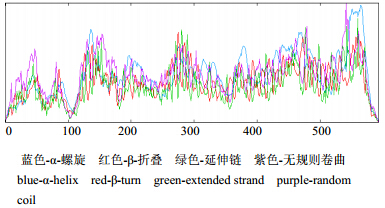 | 蓝色-α-螺旋 红色-β-折叠 绿色-延伸链 紫色-无规则卷曲 blue-α-helix red-β-turn green-extended strand purple-random coil 图 4 HMGR蛋白二级结构预测图Fig. 4 Secondary structure prediction of HMGR protein |
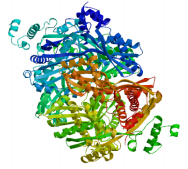 | 图 5 HMGR蛋白三级结构预测图Fig. 5 Tertiary structure prediction of HMGR protein |
推导氨基酸序列比较结果表明,接骨草HMGR与橡胶树(BAF98282)、长春花(AAA33108)、马铃薯(AAA93498)、龙虎草(ABK56831)、蒲公英(AEA92686)、球药隔重楼(AGC13078)、罗汉果(AEM42971)、青钱柳(ABX82838)和红豆杉(AAQ82685)HMGR蛋白质分子的相似度分别为75.3%、74.9%、74.0%、72.2%、71.8%、70.6%、69.6%、69.5%和62.1%,不同物种HMGR氨基酸序列同源性在62.1%~75.3%。UPMAG聚类分析表明,接骨草与长春花和马铃薯亲缘关系最近,与红豆杉亲缘关系最远,见图 6。
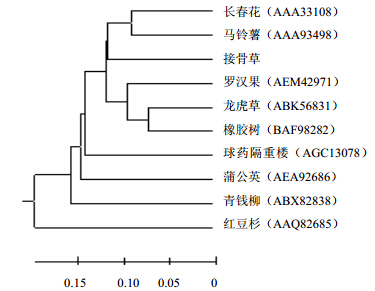 | 图 6 接骨草与其他植物HMGR的UPGMA进化树Fig. 6 UPGMA dendrogram of HMGR of S. chinensis and other |
利用实时荧光定量PCR检测HMGR基因在根状茎、地上茎、叶、花等器官中的表达特异性,结果表明该基因主要在花和地上茎中表达,在叶中的表达量较低,根状茎的表达量最低(图 7)。
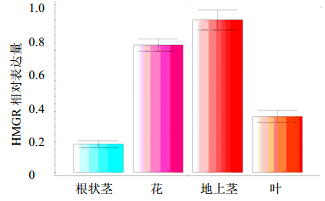 | 图 7 接骨草不同组织中HMGR基因的相对表达量Fig. 7 Relative quantity of HMGR expression in different organs of S. chinensis |
植物萜类化合物具有重要的商业价值,被广泛用于工业、医药卫生等领域[24]。萜类化合物是绝大部分中药材的重要药用成分,HMGR在萜类化合物合成途径中发挥重要作用。许多学者对其生物学功能进行了研究,Enfissi等[25]将拟南芥hmgr-1基因转入番茄,发现甾醇量提高2.4倍;Schaller等[26]将橡胶树hmg1基因转入烟草,发现HMGR的活性增加了4~8倍,且甾醇量增加6倍;武莹等[16]证明雷公藤HMGR基因的表达可能调控着萜类物质的合成代谢;Alam等[27]克隆HMGR基因,在黄花蒿中过表达并分析其活性对青蒿素量的影响,结果发现青蒿素含量的增加与HMGR的活性相关;Wang等[28]在拟南芥中过表达印度芥菜HMGS基因,发现拟南芥HMGR、SMT2、DWF1、CYP710A1和BR6OX2等基因表达上调,同时甾醇量明显增加。在药用植物中,HMGR作为萜类化合物合成途径中的关键酶,其活性高低与量的多少决定着许多有效药用活性成分产量的多少。如何利用HMGR的表达提高有效药用活性成分在植株中的量,将成为提高中药材品质的有效手段。
本研究利用RT-PCR技术首次克隆了接骨草HMGR基因的全长cDNA序列,其完整开放阅读框为1 782 bp,编码593个氨基酸。对推导的氨基酸序列的结构和功能进行生物信息学分析,发现其氨基酸序列长短与其他植物相近,HMGR蛋白特有的4个保守的活性位点,2个HMGR-CoA结合位点(EMPVGYVQIP与TTEGCLVA)(图 2中划框部分)和2个NADP(H)结合位点(DAMGMNM与GTVGGGT)[29](图 2中划实线部分),提示接骨草HMGR蛋白质功能与其他植物的功能相类似。不同植物中HMGR蛋白质行使相似的功能,说明不同植物的HMGR分子结构可能十分相似,从接骨草HMGR氨基酸序列与其他植物的HMGR同源性比较得到的结果,发现该蛋白在不同物种进化过程中具有一定的保守性,也提示HMGR蛋白质在不同植物生命活动过程中所发挥的作用基本相似。
本研究结果,将为进一步构建接骨草HMGR基因过表达载体和遗传转化体系,为实现重要药用活性成分在植株中高效表达,为开展接骨草及类似以萜类化合物为主要药用活性成分植物药的药材品质改善奠定基础。
| [1] | 吴丽霞, 吴铁松, 郑 敏. 陆英煎剂对小鼠镇痛作用的实验研究 [J]. 今日药学, 2012, 22(8): 481-483. |
| [2] | 王文静, 王 军, 饶高雄. 接骨草的两种提取物对小鼠的抗炎镇痛作用 [J]. 华西药学杂志, 2011, 26(3): 247-249. |
| [3] | 农朝赞, 黄华艺. 黄酮类化合物抗肿瘤作用的研究应用 [J]. 中国药房, 2004, 15(9): 568-569. |
| [4] | 王明时, 李景荣, 徐丽仙, 等. 陆英抗肝炎活性成分的化学研究 [J]. 南京药学院学报, 1985, 16(3): 15. |
| [5] | 黄电波, 黄清松. 陆英与乌索酸对大鼠全血黏度和红细胞沉降率的影响 [J]. 实用临床医学, 2012, 13(6): 10-12. |
| [6] | 曾琳玲, 杨 威, 王茜莎, 等. 陆英颗粒对CCl4致小鼠急性肝损伤保护作用研究 [J]. 中国实用医药, 2007, 2(22): 12-14. |
| [7] | Chappell J. Biochemistry and molecular biology of the isoprenoid biosynthetic pathway in plants [J]. Plant Mol Biol, 1995, 46(1): 521-547. |
| [8] | 曹小迎, 蒋继宏, 刘 群, 等. 大戟甲羟戊酸途径关键酶基因hmgr [J]. 武汉植物学研究, 2007, 25(2): 123-126. |
| [9] | 刘 群, 曹小迎, 蒋继宏, 等. 茅苍术HMGR基因保守区片段的克隆与分析 [J]. 中草药, 2007, 38(10): 1551-1554. |
| [10] | 雷 桅, 汤绍虎, 周启贵, 等. 桑萜类生物合成酶HMGR的生物信息学分析 [J]. 蚕业科学, 2008, 34(3): 393-399. |
| [11] | 江雪梅, 刘学端, 尹华群, 等. 球药隔重楼HMGR功能基因保守区序列的克隆与分析 [J]. 中草药, 2011, 42(6): 1190-1193. |
| [12] | 谷 巍, 席蓓莉, 吴启南, 等. 建泽泻HMGR基因保守区片段克隆与组织分布研究 [J]. 中药材, 2011, 34(9): 1335-1339. |
| [13] | 郑 鹏, 化文平, 王喆之. 秦艽HMGR基因家族的克隆及序列分析 [J]. 陕西师范大学学报, 2012, 40(6): 67-72. |
| [14] | 郑竹君, 曹小迎, 刘 群, 等. 南京椴HMGR基因的克隆和功能验证 [J]. 植物研究, 2012, 32(2): 198-203. |
| [15] | 邢朝斌, 吴 鹏, 龙月红. 刺五加HMGR基因的克隆与表达分析 [J]. 江苏农业学报, 2012, 28(6): 1258-1262. |
| [16] | 武 莹, 李 威, 祝传书, 等. 雷公藤HMGR基因克隆、序列分析及诱导表达 [J]. 西北农林科技大学学报, 2012, 40(11): 103-111. |
| [17] | 郜玉钢, 杨 鹤, 于 英, 等. 人参HMGR基因的克隆与序列分析 [J]. 吉林农业大学学报, 2010, 32(5): 500-504. |
| [18] | 罗红梅, 宋经元, 李雪莹, 等. 人参皂苷合成生物学关键元件HMGR基因克隆与表达分析 [J]. 药学学报, 2013, 48(2): 219-227. |
| [19] | 付 明, 魏 麟, 余 娟, 等. 显齿蛇葡萄查耳酮合成酶基因cDNA克隆及蛋白质序列分析 [J]. 中草药, 2013, 44(1): 85-89. |
| [20] | Koichiro T, Glen S, Daniel P, et al. MEGA6:Molecular evolutionary genetics analysis Version 6.0 [J]. Mol Biol Evol, 2013, 30(12): 2725-2729. |
| [21] | Arnold K, Bordoli L, Kopp J, et al. The SWISS-MODEL workspace: A web-based environment for protein structure homology modeling [J]. Bioinformatics, 2006, 22(2): 195-201. |
| [22] | Schwede T, Kopp J, Guex N, et al. SWISS-MODEL:an automated protein homology-modeling server [J]. Nucl Acids Res, 2003, 31(13): 3381-3385. |
| [23] | Guex N, Peitsch M C. SWISS-MODEL and the Swiss-PdbViewer: An environment for comparative protein modeling [J]. Electrophoresis, 1997, 18(15): 2714-2723. |
| [24] | 占爱瑶, 由香玲, 詹亚光. 植物萜类化合物的生物合成及应用 [J]. 生物技术通讯, 2010, 21(1): 131-135. |
| [25] | Enfissi E M A, Fraser P D, Lois L M, et al. Metabolic engineering of the mevalonate and non-mevalonate isopentenyl diphosphate-forming pathways for the produ ction of health-promoting isoprenoids in tomato [J]. Plant Biotechnol J, 2005, 3(1): 17-27. |
| [26] | Schaller H, Grausem B, Benveniste P, et al. Expression of the Hevea brasiliensis (H.B.K.) Mull. arg. 3-hydroxy-3-methyl glutaryl-coenzyme A reductase 1 in tobacco results in sterol overproduction [J]. Plant Physiol, 1995, 109(3): 761-770. |
| [27] | Alam P, Abdin M Z. Over-expression of HMG-CoA reductase and amorpha-4,11-diene synthase genes in Artemisia annua L. and its influence on artemisinin content [J]. Plant Cell Rep, 2011, 30(10): 1919-1928. |
| [28] | Wang H, Nagegowda D A, Reetika R, et al. Overexpression of Brassica juncea wild-type and mutant HMG-CoA synthase 1 in arabidopsis up-regulates genes in sterol biosynthesis and enhances sterol production and stress tolerance [J]. Plant Biotechnol J, 2012, 10(1): 31-42. |
| [29] | Caelles C, Ferrer A, Balcells L, et al. Isolation and structural characterization of a cDNA encoding Arabidopsis thaliana 3-hydroxy-3-methylglutaryl coenzyme Areductase [J]. Plant Mol Biol, 1989, 13(6): 627-638. |
 2015, Vol. 46
2015, Vol. 46


