2. 温州医科大学药学院, 浙江 温州 325035
2. School of Pharmaceutical Sciences, Wenzhou Medical University, Wenzhou 325035, China
成纤维细胞生长因子受体(fibroblast growth factor receptors,FGFR)是酪氨酸激酶受体家族中的一员,bFGF/FGFR信号转导在促进肿瘤细胞有丝分裂和肿瘤血管生成过程中起着重要的作用,与肿瘤的发生发展密切相关[1]。研究表明,FGFR在多种肿瘤细胞中高表达,如肺癌[2]、胰腺癌[3]、乳腺癌[4]、肝癌[5]、头颈癌[6]和黑色素瘤[7],促进了肿瘤细胞的增殖分裂、肿瘤血管的生成以及肿瘤的浸润转移[8]。因此以FGFR为靶点的抗肿瘤药物开发成了靶向肿瘤治疗药物研发的热点。
姜黄素是姜黄、郁金和莪术中的主要活性成分[9],研究显示,姜黄素可以被用于预防和治疗肿瘤[10],但其结构中的β-二酮基团导致其存在化学结构不稳定且体内代谢快等缺点,严重影响了姜黄素临床上的进一步应用[11]。因此,对姜黄素进行结构改造研究具有重要现实意义[12]。研究发现3,5-双(2-氟苯亚甲基)哌啶-4-酮(EF24,图 1)为一种人工合成不含β-二酮结构的单羰基姜黄素类似物,其活性远远高于姜黄素[13],并在体内外都显示出良好的抗肿瘤作用[14]。但EF24在体内抗肿瘤作用的确切靶点仍不明确。本课题组前期深入研究了EF24对FGFR1酪氨酸激酶的抑制活性,发现其半数抑制浓度(IC50)达到14 μmol/L,由于其对激酶有效抑制浓度较大,尚未达到理想值。因此,以EF24为先导化合物,对其进行合理的结构改造获得了对FGFR1酪氨酸激酶有更好抑制活性的EF24类似物[3,5-双(2-溴苯亚甲基)哌啶-4-酮,B6,图 1],本实验进一步比较EF24和B6体外抗肿瘤活性,并探讨其抗肿瘤活性与碱性成纤维生长因子(bFGF)/FGFR信号通路的关系,为寻找具有抗肿瘤作用的高效低毒姜黄素类似物提供依据。
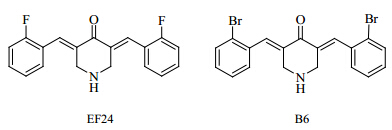 | 图 1 EF24及其类似物B6的化学结构Fig. 1 Chemical structures of EF24 and its analogue B6 |
正常人肝细胞HL7702、4种肿瘤细胞(人大细胞肺癌NCI-H460、人胃癌细胞SGC-7901、人小细胞肺癌A549、人星形胶质瘤细胞株U251)均购买于中国科学院上海细胞生物学研究所。
1.2 试剂胎牛血清,Gibco公司;p-FGFR1(Tyr 653/654)抗体购买于Cell Signal Technology公司;磷酸化丝氨酸/苏氨酸蛋白激酶[p-AKT(Ser437)]、磷酸化细胞外调节蛋白(p-ERK1/2)、成纤维细胞生长因子受体1(FGFR1)、丝氨酸/苏氨酸蛋白激酶(AKT)、细胞外调节蛋白(ERK)和甘油醛-3-磷酸脱氢酶(GAPDH)均购买于Santa Cruz公司;Caspase-3试剂盒购买于碧云天生物技术有限公司。4-羟乙基哌嗪乙磺酸缓冲液(HEPES)、十二烷基聚乙二醇醚(Brij-35)、二硫苏糖醇(DTT)、羧基荧光素(FAM)、四乙酸乙二胺(EDTA)和氯化镁(MgCl2)均购买于Sigma公司。
1.3 药物EF24(质量分数大于98%,批号B434770)购买于百灵威公司;N-[2-[[4-(二乙基氨基)丁基]氨基]-6-(3,5-二甲氧基苯基)吡啶并[2,3-D]嘧啶-7-基]-N′-叔丁基脲(PD173074,质量分数99.61%,批号S126404)购买于Selleck公司;B6自制,质量分数大于98%。
1.4 仪器EnVision®Multilabel Reade(PerkinElmer);倒置显微镜(日本尼康);Spectra Max M2多功能酶标仪(Molecular Devices);凝胶成像系统(Bio-rad)。
2 方法 2.1 FGFR1酪氨酸激酶抑制活性检测采用Caliper Mobility Shift Assay方法检测酪氨酸激酶抑制活性,该方法是以微流体芯片技术的迁移率检测技术为核心的检测系统。首先配制1.25×激酶反应缓冲液(62.5 mmol/L HEPES,pH 7.5;0.001 875% Brij-35;12.5 mmol/L MgCl2;2.5 mmol/L DTT)和激酶反应终止液(100 mmol/L HEPES,pH 7.5;0.015% Brij-35;0.2% Coating Reagent #3);在5 μL的不同浓度的化合物溶液(用DMSO溶解,用水稀释10倍)中加入10 μL的2.5×FGFR1激酶溶液(在1.25×激酶反应缓冲液中加激酶),室温孵育10 min后再加入10 μL的2.5×底物肽溶液(在1.25×激酶反应缓冲液中加FAM标记肽和ATP),在28 ℃下反应特定时间后加入25 μL激酶反应终止液。在Caliper上测试荧光度(F),计算激酶活性抑制率。以DMSO为溶剂对照,以不加激酶为阴性对照。测定IC50时每种样品设5个稀释度(0.01、0.1、1.0、10、100 μmol/L)各3个复孔,重复3次实验。
激酶活性抑制率=(FDMSO对照-F样品)/(FDMSO对照-F阴性对照)
2.2 MTT法检测细胞增殖抑制活性HL7702、NCI-H460、SGC-7901、A549、U251细胞均为贴壁生长,U251使用DMEM高糖培养基,其他细胞均使用RPMI 1640培养基,培养基中均含有10%胎牛血清和1%的青-链霉素。细胞于恒温37 ℃含5% CO2饱和湿度的细胞培养箱中培养。用含EDTA的胰酶消化处于对数期生长的细胞,离心,各取HL7702、NCI-H460、SGC-7901、A549和U251细胞悬液100 μL接种于96孔板(每孔细胞数约3 000个),用含有10%胎牛血清的完全培养基进行培养,待细胞贴壁过夜后换液加药。设置空白组、阴性对照(DMSO)组、阳性对照EF24(10/27、10/9、10/3、10、30 μmol/L)组和受试药B6(10/27、10/9、10/3、10、30 μmol/L)组,每组3个复孔。药物作用72 h后,观察细胞存活情况,并在每孔各加入25 μL MTT(5 mg/mL)溶液,置于37 ℃、5% CO2培养箱培养4 h以上,弃上清,用DMSO溶解结晶,室温下避光振荡10 min,在酶标仪490 nm处读取吸光度(A)值,计算细胞增殖抑制率,计算IC50值。
增殖抑制率=(加药组A平均值-空白组A平均值)/(阴性对照组A平均值-空白组A平均值)
2.3 Western blotting检测bFGF/FGFR下游信号蛋白表达用含EDTA的胰酶消化处于对数期生长的NCI-H460细胞,并离心,取细胞悬液接种于六孔板(4×105个/孔),用含有10%胎牛血清的完全培养基进行培养,待细胞贴壁过夜后换饥饿培养基(不含胎牛血清)饥饿作用24 h,加药,设置阴性对照(DMSO)组、DMSO+bFGF组、bFGF+EF24(2.5、5.0、10.0 μmol/L)组和bFGF+B6(2.5、5.0、10.0 μmol/L)组,药物作用1 h,bFGF终质量浓度为30 ng/mL,刺激10 min后收蛋白。考马斯亮蓝测定细胞总蛋白浓度,配置上样缓冲液,蛋白凝胶电泳后敷一抗(p-FGFR1、p-AKT、p-ERK1/2、FGFR1、AKT、ERK2和参比GAPDH),室温摇床2 h,4 ℃摇床孵育过夜后TBST洗一抗,二抗室温摇床1 h后TBST洗二抗,凝胶成像仪显色。
2.4 Caspase-3试剂盒检测Caspase-3因子的表达取对数期生长的NCI-H460细胞悬液铺于60 mm的皿中(1×106个/皿),含有10%胎牛血清的完全培养基贴壁过夜后换液加药,设置阴性对照(DMSO)组、EF24(5 μmol/L)组和B6(5 μmol/L)哎,37 ℃,5% CO2培养箱作用12 h;用胰酶消化贴壁细胞,并收集至备用的细胞液中。600×g 4 ℃离心5 min收集细胞,除上清,PBS重悬,加入裂解液,重悬沉淀,水浴裂解15 min,4 ℃、16 000~20 000×g离心10~15 min,把上清转移到冰浴预冷的离心管中,用考马斯亮蓝法测定样品蛋白浓度,使蛋白的质量浓度达到1~3 mg/mL;同时测定游离硝基苯胺(pNA)标准曲线;根据Caspase-3试剂盒说明书检测蛋白样品中其酶的活性(以GAPDH为参比蛋白),并计算1个样品单位质量蛋白中所含的Caspase-3的酶活力单位。
2.5 统计学方法所有实验数据均来自3次重复实验,并输入 GraphPad Prism 5.0 统计软件包进行统计分析。
3 结果 3.1 对FGFR1酪氨酸激酶的抑制活性从激酶活性的结果(表 1)看,FGFR抑制剂PD173074对FGFR1酪氨酸激酶抑制作用的IC50值为2.9×10-3 μmol/L;溴取代的EF24类似物B6表现出很好的抑制活性,对于FGFR1酪氨酸激酶的IC50为8.1 μmol/L,较先导化合物EF24(IC50=14 μmol/L)抑制效果有明显提高和改善,推测有可能化合物中的卤素与蛋白形成卤鍵的强弱不同,使得化合物与FGFR1的结合能力有差异。
| 表 1 EF24及其类似物B6的FGFR1酪氨酸激酶抑制活性 Table 1 Inhibition of EF24 and its analogue B6 on FGFR1 kinase activity |
表 2为先导化合物EF24及其类似物B6对正常细胞HL7702及4种肿瘤细胞NCI-H460、SGC-7901、A549及U251的IC50值,药物作用时间为72 h。从表 2中可以看出EF24及其类似物B6对4种肿瘤细胞的IC50值均达到微摩尔级别,但是EF24类似物B6对正常肝细胞HL7702的抑制作用较弱,表现出较弱的细胞毒性作用,相对EF24有较高的安全性。从结果还发现类似物B6对NCI-H460的IC50值相对其他肿瘤细胞要低很多,说明EF24类似物B6对NCI-H460的增殖抑制具有很好的细胞选择性。
| 表 2 EF24及其类似物B6的细胞增殖抑制活性 Table 2 Inhibitory activity of EF24 and its analogue B6 on cell proliferation |
为了进一步探索EF24类似物B6对FGFR1的作用机制,在肿瘤细胞NCI-H460中检测其对FGFR1活化的影响,EF24或B6作用细胞1 h后,加bFGF刺激10 min,采用Western blotting技术检测。图 2结果显示,B6对NCI-H460中FGFR1及其下游信号分子AKT及ERK1/2活化有明显抑制作用,并且抑制效果较先导化合物EF24好。且随着化合物浓度的增加(2.5、5.0、10.0 μmol/L),对FGFR1及其下游信号分子AKT及ERK1/2活化的抑制作用逐渐增强,表现出很好的剂量依赖性。上述结果进一步证明了EF24类似物B6确实是通过阻断bFGF/FGFR1通路起作用的。
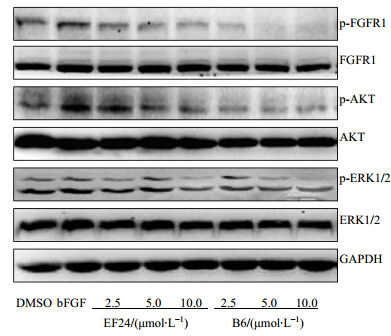 | 图 2 EF24及其类似物B6对NCI-H460细胞中FGFR1信号通路的抑制作用Fig. 2 Effect of EF24 and its analogue B6 on inhibiting FGFR1 signaling in NCI-H460 cells |
从图 3可以看出5 μmol/L B6作用于NCI-H460细胞12 h后能有效地诱导Caspase-3的表达,且强于先导化合物EF24。凋亡蛋白Caspase-3酶的活性较阴性对照组有明显增强。
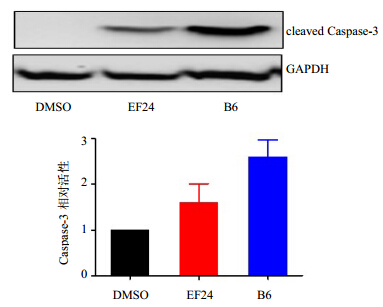 | 图 3 EF24及其类似物B6对NCI-H460细胞的促凋亡作用Fig. 3 Apoptosis-promoting effect of EF24 and its analogue B6 on NCI-H460 cells |
FGFR1是FGFR家族中的一员,该家族中另外3个成员分别为FGFR2、FGFR3、FGFR4[15],均能被bFGF激活,从而激活细胞内相关信号通路,对细胞增殖信号通路的激活有重要意义。据报道很多肿瘤细胞(H460、A549、SGC7901和U251)中由于FGFR的高表达从而导致细胞恶性增殖[16, 17, 18, 19]。因此通过阻断肿瘤细胞内bFGF/FGFR1信号通路已经成为治疗某些肿瘤的靶点之一。人工合成的单羰基姜黄素类似物EF24对结肠癌和卵巢癌等都具有良好的体内外抗肿瘤活性[14],但由于其体内靶点不明确,因此以EF24为先导化合物设计并获得其结构类似物B6,通过体外FGFR1酪氨酸激酶抑制活性实验验证了B6可以抑制FGFR1酪氨酸激酶活性,因此将其进行进一步的体外抗肿瘤活性研究。
在体外抗肿瘤活性实验中,发现EF24类似物B6有效地抑制了多种肿瘤细胞的增殖,并且对NCI-H460有较好的选择性,且具有很高的安全性。细胞内信号分子检测发现EF24类似物B6对bFGF/FGFR信号通路中FGFR1以及下游信号蛋白AKT和ERK1/2的活化具有很强的抑制作用,并呈现出良好的剂量依赖性,因此表明该类似物B6不仅可以抑制FGFR1激酶的活性,同时还可以抑制bFGF/FGFR信号通路中FGFR1以及下游的信号蛋白AKT和ERK1/2的活化,说明了类似物B6确实是FGFR1的抑制剂。进一步Western blotting实验结果表明B6能有效地诱导Caspase-3的表达,同时Caspase-3试剂盒的检测结果也进一步验证了这一点。
通过先导物EF24设计改构获得的类似物B6体外对多种肿瘤细胞有增殖抑制作用,尤其是对NCI-H460细胞;对FGFR1激酶有很好的抑制活性,也能明显抑制了FGFR1及下游增殖信号蛋白AKT及ERK1/2的活化,促进肿瘤细胞的凋亡,其效果较先导化合物有明显提高和改善,并具有更好的安全性。证明了以EF24为先导化合物合成靶向FGFR1的小分子抑制剂的思路是可行的,并具有很好的研发前景。
| [1] | Fiorio Pla A, Maric D, Brazer S C, et al. Canonical transient receptor potential 1 plays a role in basic fibroblast growth factor (bFGF)/FGF receptor-1-induced Ca2+ entry and embryonic rat neural stem cell proliferation [J]. J Neurosci, 2005, 25(10): 2687-2701. |
| [2] | Volm M, Koomagi R, Mattern J, et al. Prognostic value of basic fibroblast growth factor and its receptor (FGFR-1) in patients with non-small cell lung carcinomas [J]. Eur J Cancer, 1997, 33(4): 691-693. |
| [3] | Ohta T, Yamamoto M, Numata M, et al. Expression of basic fibroblast growth factor and its receptor in human pancreatic carcinomas [J]. Br J Cancer, 1995, 72(4): 824-831. |
| [4] | Yiangou C, Gomm J J, Coope R C, et al. Fibroblast growth factor 2 in breast cancer: occurrence and prognostic significance [J]. Br J Cancer, 1997, 75(1): 28-33. |
| [5] | Wang J, Su H, Han X, et al. Inhibition of fibroblast growth factor receptor signaling impairs metastasis of hepatocellular carcinoma [J]. Tumour Biol, 2014, 35(11): 11005-11011. |
| [6] | Dellacono F R, Spiro J, Eisma R, et al. Expression of basic fibroblast growth factor and its receptors by head and neck squamous carcinoma tumor and vascular endothelial cells [J]. Am J Surg, 1997, 174(5): 540-544. |
| [7] | Knights V, Cook S J. De-regulated FGF receptors as therapeutic targets in cancer [J]. Pharmacol Ther, 2010, 125(1): 105-117. |
| [8] | Grose R, Dickson C. Fibroblast growth factor signaling in tumorigenesis [J]. Cytokine Growth Factor Rev, 2005, 16(2): 179-186. |
| [9] | Taylor R A, Leonard M C. Curcumin for inflammatory bowel disease: a review of human studies [J]. Altern Med Rev, 2011, 16(2): 152-156. |
| [10] | Bansal S S, Goel M, Aqil F, et al. Advanced drug delivery systems of curcumin for cancer chemoprevention [J]. Cancer Prev Res (Phila), 2011, 4(8): 1158-1171. |
| [11] | Anand P, Kunnumakkara A B, Newman R A, et al. Bioavailability of curcumin: problems and promises [J]. Mol Pharm, 2007, 4(6): 807-818. |
| [12] | 姜程曦, 林良义, 宋 娇, 等. 姜黄素类似物抑制炎症反应缓解1型糖尿病肾损伤实验研究 [J]. 中草药, 2015, 46(12): 1785-1790. |
| [13] | Mosley C A, Liotta D C, Snyder J P. Highly active anticancer curcumin analogues [J]. Adv Exp Med Biol, 2007, 595: 77-103. |
| [14] | Adams B K, Cai J, Armstrong J, et al. EF24, a novel synthetic curcumin analog, induces apoptosis in cancer cells via a redox-dependent mechanism [J]. Anticancer Drugs, 2005, 16(3): 263-275. |
| [15] | Hatch N E. FGF signaling in craniofacial biological control and pathological craniofacial development [J]. Crit Rev Eukaryot Gene Expr, 2010, 20(4): 295-311. |
| [16] | Armstrong K, Ahmad I, Kalna G, et al. Upregulated FGFR1 expression is associated with the transition of hormone-naive to castrate-resistant prostate cancer [J]. Br J Cancer, 2011, 105(9): 1362-1369. |
| [17] | Ogawa T, Takayama K, Takakura N, et al. Anti-tumor angiogenesis therapy using soluble receptors: enhanced inhibition of tumor growth when soluble fibroblast growth factor receptor-1 is used with soluble vascular endothelial growth factor receptor [J]. Cancer Gene Ther, 2002, 9(8): 633-640. |
| [18] | Ye Y W, Zhou Y, Yuan L, et al. Fibroblast growth factor receptor 4 regulates proliferation and antiapoptosis during gastric cancer progression [J]. Cancer, 2011, 117(23): 5304-5313. |
| [19] | Fukai J, Yokote H, Yamanaka R, et al. EphA4 promotes cell proliferation and migration through a novel EphA4-FGFR1 signaling pathway in the human glioma U251 cell line [J]. Mol Cancer Ther, 2008, 7(9): 2768-2778. |
 2015, Vol. 46
2015, Vol. 46


