2. 中药固体制剂制造技术国家工程研究中心, 江西 南昌 330006
2. National Pharmaceutical Engineering Center for Solid Preparation in Chinese Herbal Medicine, Nanchang 330006, China
五味子是中国传统的安神药[1, 2],植物基源主要有五味子Schisandra chinensis (Turcz.) Baill. 和华中五味子Schisandra sphenanthera Rehd. et Wils. 的干燥成熟果实,前者习称“北五味子”,后者为“南五味子”。《中国药典》自2000年版,虽将两者分别收录,但记载功效相同,均具益气敛肺、生津滋肾涩精止泻、宁心安神之功[3]。《本草纲目》记载:“五味子今有南北之分,南产者红,北产者黑,入滋补药,必用北者乃良”[4]。
从历史沿革上看,由于地区习用和资源利用的关系,二者在长期的临床实践中常常混用,均被收录。但由于南、北五味子在地理分布、化学组成上不尽相同,性状差异较大,因此药效也存在一定差异[5, 6]。由于五味子药用价值很高,其作为常用中药具有悠久历史,是应用面较广、用量较大的中药材品种,市场需求量大。但在实际使用的过程中,由于药材来源复杂,且南、北五味子的市场价位相差很大,因此常有互混、互代、以假充真现象存在。所以,区分南、北五味子,寻找两者的差异成分,是对2种五味子产生不同功效的物质基础的正确理解,同时对保证临床疗效和维持药材市场秩序有重要意义。
对南、北五味子的鉴别,多集中在药材性状、显微鉴别、薄层色谱(TLC)及高效液相色谱(HPLC)特征等传统方法[7, 8, 9, 10, 11],也有研究者采用了随机扩增引物DNA法与红外光谱法等[12, 13]。目前,随着高分辨质谱的发展,在快速分析鉴定中药化学成分方面的优势明显,使其日渐成为中药材区分鉴定的重要手段。本实验采用超高效液相色谱-飞行时间质谱(UPLC-Q-TOF-MSE)技术首次对南、北五味子的化学成分进行快速识别,并结合正交偏最小二乘法(OPLS-DA)判别模式实现了2种五味子特征差异性标志物的区分,为南、北五味子的快速鉴定、质量控制与临床合理应用提供了基础。
1 仪器与材料Waters Acquity I-CLASSTM UPLC超高效液相色谱系统(Waters Corporation,Milford,MA,美国);Synapt G2-SiTM高分辨率飞行时间质谱仪(Waters Corporation,Manchester,英国)。
乙腈、甲醇(色谱纯,Fisher Scientific,Fairlawn,NJ,美国);甲酸(色谱纯,Sigma-Aldrich Co.,Ltd.,St Louis,MO,美国);水为纯净水(杭州娃哈哈集团),其余试剂为分析纯。南、北五味子分别产自辽宁省本溪市和陕西省商洛市,经南昌市食品药品检验所主管药师吴蓓分别鉴定为木兰科植物五味子Schisandra chinensis (Turcz.) Baill. 和华中五味子Schisandra sphenanthera Rehd. et Wils. 的干燥成熟果实。
2 方法与结果 2.1 南、北五味子样品制备分别取南、北五味子药材样品粉碎,过80目筛。精密称取1.0 g粉末置150 mL锥形瓶中,加甲醇80 mL,超声处理(功率250 W,频率30 kHz)30 min后滤过,滤液离心10 min(16 000 r/min),上清液合并转移至100 mL量瓶中,加甲醇稀释至刻度,摇匀,作为储备液;进样前将储备液用甲醇稀释10倍,经0.22 μm微孔滤膜滤过,即得。
2.2 UPLC色谱条件采用Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm,Waters公司);柱温为40 ℃,体积流量为0.4 mL/min;进样量为2 μL;流动相为0.1%甲酸水(A)-乙腈(B)。B相比例随时间变化:0~5 min,15%~40% B;5~12 min,40%~60% B;12~25 min,60%~90% B;25~30 min,90% B;30~35 min,90%~15% B并保持5 min。
2.3 质谱条件采用电喷雾离子源(ESI),正离子模式,数据获取为centroided,雾化气(N2)体积流量为800 L/h,脱溶剂气温度为600 ℃,离子源温度120 ℃,毛细管电压3.0 kV。锥孔电压(Sampling Cone)40 V,补偿电压(Source offset)80 V。MSE扫描模式检测,低能量扫描时(function 1)传输碰撞能量为4 eV,高能量扫描时(function 2)传输碰撞能量为20~50 eV,喷雾器压力为6.5×105 Pa,气帘气体积流量(Cone gas flows)为50 L/h,扫描范围m/z 100~1 200。亮氨酸-脑啡肽(m/z 554.261 5)作为外标(Lock SprayTM)进行质量实时校正,体积流量设为5 μL/min。
2.4 数据采集与分析采用MassLynx4.1对正离子模式总离子流图进行处理,结合Mass值、相对保留时间和分子式匹配软件Elemental compositionTM,化合物结构匹配软件MassFragmentTM及UNIFITM数据处理系统对各主要分子离子峰进行归属。采用MarkerLynx 4.1软件对正离子模式下南、北五味子的质谱峰进行分析,OPLS-DA判别模式分析化合物之间的差异,得到差异性标志物。
2.4.1 目标数据库的建立及数据处理方法根据Scifinder、Chemspider等相关数据库的检索结果并结合相关文献报道,在UNIFITM软件平台上建立五味子化学成分的目标数据库,将采集的centroided原始数据导入UNIFITM定性分析软件,对各主要分子离子峰进行识别、校正,与已建立的目标数据库匹配,最终确定峰1~33的化合物信息,包括各化合物的保留时间、相对分子质量及在质谱中的裂解后的碎片离子,结果见表 1,其中联苯环辛烯类木脂素27个。所鉴定的33个化合物的相对分子质量信息,误差均小于5×10-6。
| 表 1 正离子模式下南、北五味子的化学成分鉴定结果 Table 1 Identification of chemical constituents from fruits between S.sphenanthera and S.chinensis in positive mode |
由正离子模式下,两种五味子样品的总离子流(图 1)与镜像对比图(图 2)可见,南五味子和北五味子之间存在许多相同的化学成分,但相同化合物在量上存在明显的差异,其中五味子醇甲、五味子醇乙在北五味子中的量显著高于南五味子。
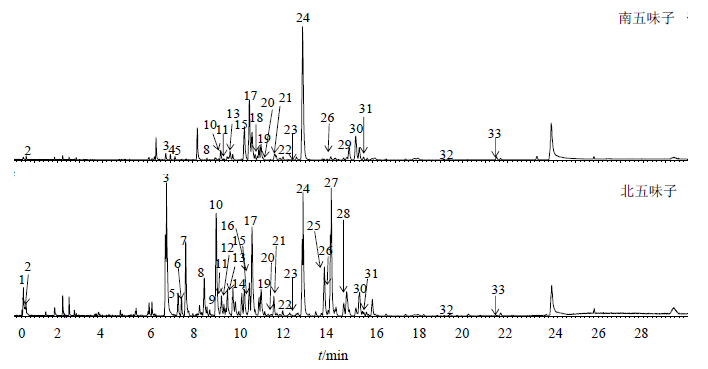 | 图 1 南五味子和北五味子UPLC-Q-TOF-MSE的总离子流图 Fig.1 sphenanthera and S. chinensis by UPLC-Q-TOF-MSE |
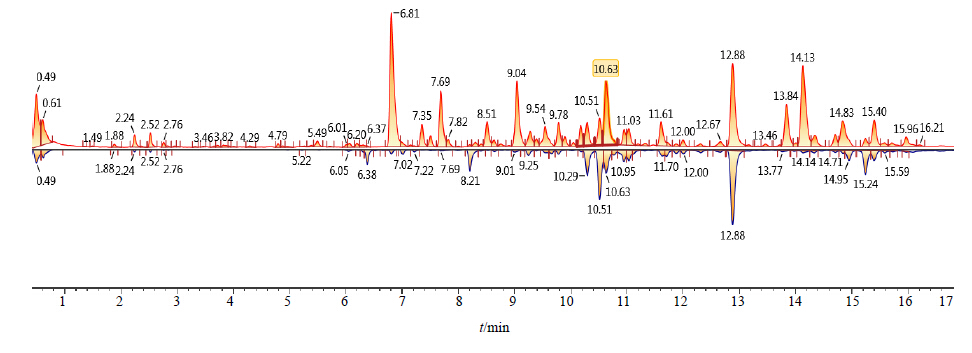 | 图 2 南、北五味子在正离子模式下的镜像对比图 Fig.2 Image contrast of chromatograms of fruit of S. sphenanthera and S. chinensis in positive mode |
通过对照品比对鉴定峰3、7、17、24和27分别为五味子醇甲、五味子醇乙、五味子酯甲、五味子甲素和五味子丙素。其他色谱峰根据低能量通道中一级质谱图能够提供精确的相对分子质量信息,并结合MassFragmentTM确定化合物的相对分子质量和可能分子式;通过高能量扫描时产生的碎片离子明确碎片的元素组成,结合化合物的碎片峰信息,并结合已建立的目标数据库,推测了色谱峰可能的化合物结构,相关离子推断见表 1。
以m/z 432.211 7为例,在低能量图谱中,与455.212 6整数部分相差23,与m/z 471.176 3相差39,推测后两个离子峰分别为m/z 432.211 7与钠离子和钾离子结合的加合离子峰。在ESI源正离子条件下,一般产生单电荷离子;根据氮律规则,不含氮或含偶数个氮的中性分子其整数部分为偶数,其 [M+H]+、[M+Na]+ 及 [M+K]+ 峰的整数部分均为奇数。反之,如果离子峰整数部分为偶数,其可以有2种原因:该化合物含奇数个氮或者该化合物为自由基离子(失去1个电子后带正电),由于五味子中含氮的化学成分较少,故考虑m/z 432.211 7为中性分子失去电子后的自由基离子。Mass FragmentTM处理后,该化合物的分子式为C24H32O7。经目标数据库匹配,初步鉴定为五味子醇甲。在高能量通道下,再根据一系列显著的碎片离子峰,415.218 7 [M-H2O+H]+,400.184 4 [M-H2O-CH3+H]+,384.189 2 [M-H2O-OCH3+H]+等碎片离子信息,碎片裂解途径见图 3,进一步确定该化合物为五味子醇甲。
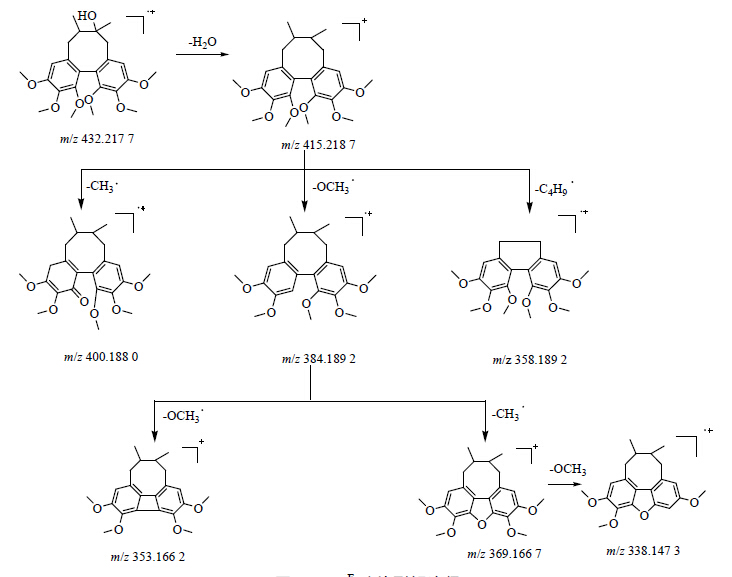 | 图 3 MSE碎片裂解途径Fig.3 Fragmentation pathway under MSE |
按“2.1”项方法,制备5个批次的南、北五味子2组醇提液样品(每组5份样品,共10份),在“2.2”及“2.3”项中的液相和质谱条件下采集样品,将采集到的2组原始数据导入Markerlynx 4.1进行OPLS-DA分析,结果显示两组数据出现明显差异。如图 4-a所示,南五味子和北五味子样品显著分成2群(左侧为南五味子组,右侧为北五味子组),结果提示2种五味子中化学成分存在显著差异。为了找出这些存在差异的标识物,进一步分析2组数据的整体差异性,得到散点图OPLS-DA/S-plot。如图 4-b所示,在图中S型曲线上的每一个点代表 1个化合物,靠近中间部分为2组样品中差异较小的成分,靠近上下两侧部分为2组样品中差异较大的成分,左下方的成分在南五味子中的量较高,右上方的成分在北五味子中的量较高。总体而言,在S型曲线两端的数据点分别代表了样品中可信度最高的特征化合物,因此,图中点1~15代表南、北五味子中具有显著差异的化合物,即差异性标志物,这可为南、北五味子的鉴定提供依据。进一步对上述差异点进行识别,分别标记对应总离子流图中峰标记号,并给出保留时间和荷质比,识别差异标志物,结果见表 2。
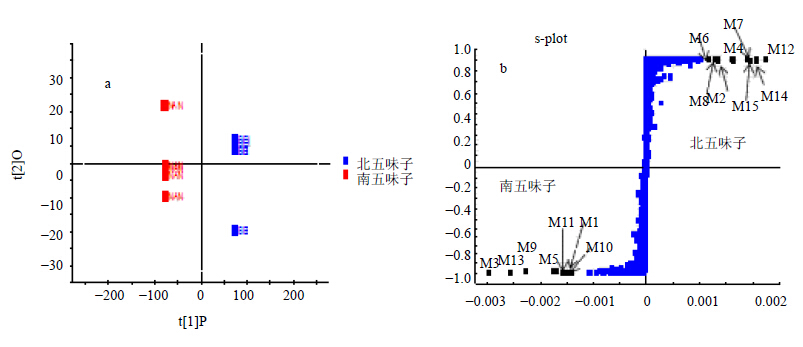 | 图 4南、北五味子正离子模式下的score plot图(a)和S-plot图(b)Fig.4Score plot (a) and S-plot (b) in fruits of S.sphenanthera and S. chinensis in positive ion mode |
| 表 2 南、北五味子中具有明显差异的化合物的鉴定结果 Table 2 dentification of marker compounds with significant difference in fruits of S. sphenanthera and S. chinensis |
对获得的差异性标志物在南北五味子中的分布进行比较,如图 5所示,五味子醇甲、五味子醇乙、五味子乙素、巴豆酰戈米辛H、γ-五味子醇甲、五味子丙素、戈米辛D和五味子酯甲在北五味子中的量较大;而五味子甲素、表戈米辛O、五味子酯丁、苯甲酰异戈米辛O、当归酰戈米辛O、巴豆酰戈米辛P和当归酰戈米辛Q在南五味子中的量较高。
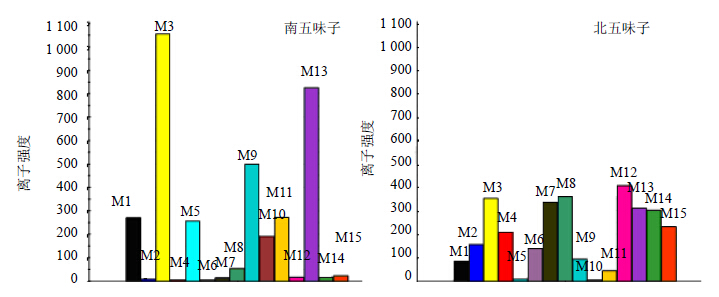 |
各标识物的信息(差异性标志物M1~M15)详见表 2 Details of each marker compound (compounds M1—M15) are shown in Table 2 图 5 差异显著的标识物在两组样品中的分布Fig.5Distribution of marker compounds with significant difference in two sample groups |
预试验中,分别以甲醇-水和乙腈-水2种体系为流动相按照“2.2”中梯度进行考察,结果表明乙腈的洗脱效果明显优于甲醇,故选择乙腈作为有机相。同时考察水相中不同浓度的甲酸量对质谱响应的影响,结果显示甲酸浓度在0.1%时大多数成分的质谱响应比较好。因此,采用0.1%甲酸水溶液作为水相。质谱扫描模式分别比较了正、负离子2种扫描模式,结果发现正离子模式下质谱响应更强,故实验最终选择在正离子模式下进行。
UPLC-Q-TOF-MSE技术可以提供良好的分离效果及提供强大的化合物结构信息,已广泛运用到中药复杂成分的研究中,利用UPLC-Q-TOF-MSE分析方法,能一次性对中药材中多个复杂成分快速定性及定量分析。MSE是一种新的质谱数据采集方法,能够在超短时间内实现低能量和高能量2个通道下快速的切换,低能量通道下(2~4 eV碰撞能)的质谱信息的一级质谱数据能够提供化合物的相对分子质量和分子式等信息;高能量通道下(20~50 eV碰撞能)的二级质谱数据则提供化合物的二级碎片,能够帮助推测化合物的结构信息。与传统的LC/TOF-MS/MS相比,MSE采集模式具有更高的灵敏度,同时能够确保数据的全面性。在数据处理过程中,本实验使用UNIFI软件平台,建立目标数据库,对数据进行采集后分析,能够快速鉴定相关化合物。
本实验的研究结果显示南、北五味子具有相似的化学成分,但其这些化学成分存在量上的显著差异。图 2的南、北五味子镜像对比图中可以直观地看出差异性成分。为了高效、准确地搜寻并鉴定这些存在明显差异的化合物,对南、北五味子样品进行OPLS-DA分析,最终获得15个差异性标志物,均为联苯环辛烯类木脂素。本实验为化学成分相似的中药材的鉴定提供了一种快速、可靠的方法,同时也为南、北五味子药效物质基础的阐明提供了重要依据。
| [1] | 徐丽华, 黄芳, 孙萌, 等. 南北五味子镇静催眠活性部位共有成分的分析 [J]. 分析化学, 2009, 37(6): 828-834. |
| [2] | Wei B, Li Q, Fan R, et al. Determination of monoamine and amino acid neurotransmitters and their metabolites in rat brain samples by UFLC-MS/MS for the study of the sedative-hypnotic effects observed during treatment with S. chinensis [J]. J Pharm Biomed Anal, 2014, 88: 416-422. |
| [3] | 中国药典 [S]. 一部. 2010. |
| [4] | 江苏新医学院. 中药大辞典 [M]. 上海: 上海科学技术出版社, 1986. |
| [5] | 史琳, 王志成, 冯叙桥. 五味子化学成分及药理作用的研究进展 [J]. 药物评价研究, 2011, 34(3): 208-212. |
| [6] | 陶淑娟. 北五味子与南五味子的比较鉴别 [J]. 人参研究, 2001, 13(2): 42. |
| [7] | 胡双丰, 杨志芬. 北五味子与南五味子的鉴别 [J]. 中医学报, 2010(6): 1149-1150. |
| [8] | 胡敏, 项雪燕, 陈巧华. 北五味子与南五味子的鉴别 [J]. 海峡药学, 2012, 24(12): 38-39. |
| [9] | 张辉, 颉维民. 南, 北五味子的鉴别研究综述 [J]. 中国药师, 2008, 11(11): 1375-1376. |
| [10] | 高建平, 王彦涵, 陈道峰. 南五味子类药材的鉴别研究 [J]. 中草药, 2003, 34(7): 646-649. |
| [11] | 刘芷, 贾英, 赵旭. 五味子的UPLC指纹图谱研究 [J]. 中草药, 2014, 45(11): 1631-1633. |
| [12] | 王培训, 李劲平. 南, 北五味子的RAPD鉴别研究 [J]. 中药新药与临床药理, 2002, 13(2): 98-99. |
| [13] | 田进国, 何心亮. 南, 北五味子的红外光谱鉴别 [J]. 中药材, 1995, 18(6): 284-285. |
 2015, Vol. 46
2015, Vol. 46


