补骨脂又名破故纸,为豆科(Leguminosae)植物补骨脂Psoralea corylifolia L. 的干燥成熟果实[1]。该植物分布于四川、云南、河南、安徽、山西、陕西等地,资源丰富[2]。自古以来其就作为温肾助阳的常用中药,有补肾壮阳、温脾止泻之功效,为《中国药典》收载的中药。现代药理学研究表明该药有扩张冠状动脉、抗菌、抗衰老的作用,对平滑肌有双向调节作用,还有雌激素样作用以及抗肿瘤等药理活性[3]。补骨脂含有多种活性成分,如香豆素类(主要为呋喃香豆素类、补骨脂素psoralen和异补骨脂素isopsoralen等);拟雌内酯类(如补骨脂定psoralidin等);黄酮类(主要有补骨脂甲素corylifolin、补骨脂乙素corylifolinin、补骨脂异黄酮corylin、补骨脂查耳酮bavachalcone等);酚萜类(如补骨脂酚bakuchiol)等[4]。为充分利用我国丰富的资源,进一步寻找新的活性天然产物化学成分;本实验对补骨脂果实的化学成分进行了研究,并从中分离得到1个具有细胞毒活性的二氢异黄酮类新化合物,3R-6-羟基-8-羟甲基-4′,7-二甲氧基-二氢异黄酮(1),命名为补骨脂异黄酮A。
1 材料与材料UV-2401A紫外光谱仪(日本岛津公司);JascoJ-810圆二色光谱仪(日本分光公司);Bio-Rad FTS-185傅里叶变换红外光谱仪(美国伯乐BIO-RAD公司公司);DRX-500高分辨核磁共振仪(瑞士布鲁克公司);半制备HPLC分析仪器为岛津LC-8A型高效液相色谱仪,色谱柱为安捷伦公司Zorbax PrepHT GF(250 mm×21.2 mm,7 μm)和安捷伦Zorbax C18(250 mm×9.4 mm,5 μm)。
拌样用硅胶(80~100目)、柱色谱分离用硅胶(200~300目)、GF254(100 mm×100 mm)薄层硅胶板均为青岛海洋化工厂产品;MCI-gel CHP-20P(75~150 μm)反相微孔树脂,日本三菱公司;Sephadex LH-20凝胶,美国GE公司;工业用三氯甲烷、丙酮、甲醇、醋酸乙酯、石油醚,天津化学试剂厂提供;色谱纯乙腈、四氢呋喃,美国Fisher公司提供;超纯水,实验室用美国GE EDI超纯水处理器制备。
补骨脂药材2002年9月购自昆明菊花村药材市场,产地为云南西双版纳,经云南中医学院中药学院袁琳博士鉴定为豆科植物补骨脂Psoralea corylifolia L. 的干燥果实,标本(YNMZ0952)保存于云南民族大学民族药资源化学重点实验室。急性早幼粒细胞白血病细胞(NB4)、人肺腺癌细胞(A549)、人神经母细胞瘤细胞(SHSY5Y)、人前列腺癌细胞(PC3)和人乳腺癌细胞(MCF7),均购于上海拜力生物科技有限公司。
2 提取与分离补骨脂成熟的果实4.5 kg粉碎到30目,然后用95%乙醇提取4次;每次提取乙醇用量为5.0 L,超声4次(每次30 min)后滤过;合并4次提取液减压浓缩得浸膏185 g。浸膏选用MCI脱色,然后经硅胶柱色谱,氯仿-丙酮(20∶1、9∶1、8∶2、7∶3、6∶4、5∶5)洗脱分成6个部分。选取氯仿-丙酮6∶4洗脱部分用HPLC进行进一步分离,采用Agilent Zorbax PrepHT GF反相柱,以45%甲醇为流动相,体积流量为15 mL/min,进样量100 μL,检测波长为308 nm,收集25.2~26.8 min流出的组分可得化合物粗品。粗品再次用甲醇溶解,以甲醇为流动相,用葡聚糖凝胶柱色谱纯化可得化合物1(12.8 mg)。
3 结构鉴定化合物1:浅黄色胶状物,[α]D24.6 -41.6° (c 0.25,MeOH);UVλmaxMeOH(nm): 210 (4.05),242 (3.32),308 (3.20);CD (c 0.2,MeOH) λmax: 248 (+1.58),346 (+1.22);IRυmaxKBr(cm-1): 3 428,2 947,2 880,1 647,1 610,1 532,1 478,1 368,1 226,1 047,957,862。HR-ESI-MS显示其准分子离子峰为353.100 1 [M+Na]+(计算值353.100 1,C18H18NaO6),结合1H-和13C-NMR确定分子式为C18H18O6。其红外光谱显示化合物中有羟基(3 428 cm-1)、羰基(1 647 cm-1)和芳环(1 610,1 532,1 478 cm-1)信号,紫外光谱在210、242和308 nm有最大吸收也证实化合物中存在芳环结构。化合物的1H-和13C-NMR谱(表 1)显示其含有18个碳和18个氢,包括1个五取代的苯环 (δC 117.2 d、142.5 s、155.8 s、124.5 s、149.0 s和119.2 s,δH 7.38 s);1个1,4-二取代苯环 [δC 129.7 s、131.1 d (2C)、115.2 d (2C) 和161.5 s;δH7.70 (d,J = 8.6 Hz),δH6.86 (d,J = 8.6 Hz)];1个氧化的亚甲基 [δC 73.1 t;δH4.54 (dd J = 11.2,6.4 Hz),4.74 (t,J = 11.2 Hz)];1个次甲基 (δC 47.3 d;δH 4.22,dd,J = 11.2,6.4 Hz);1个羟甲基 (δC 54.0 t;δH 4.45 s);2个甲氧基 (δC 61.1 q和56.0 q;δH 3.85 s和3.81 s);1个羰基 (δC 196.2 s) 信号,以及1个酚羟基 (δH10.92 s)。2个苯环基及化合物中二氢异黄酮类化合物特征信号(C-2~4)可初步推测化合物为二氢异黄酮类化合物[5]。根据H-2和C-9、C-3、C-4、C-1′,以及H-3和C-1′、C-2′,C-6′、C-2、C-4、C-10的HMBC(图 1)相关和进一步确定化合物为二氢异黄酮类化合物。进一步分析其HMBC相关信号,根据甲氧基氢 (δH 3.85 s 和3.80 s) 分别和C-7 (δC 120.7)和C-4′ (δC 161.0) 有HMBC相关可证实2个甲氧基分别取代在C-6和C-4′位,根据羟甲基氢H-1″和C-7、C-8和C-9有HMBC相关可证实羟甲基取代在C-8位。酚羟基取代在C-6位可由酚羟基信号和C-5、C-6和C-7的HMBC相关得到确认。根据化合物中C-2和C-3的核磁共振数据、化合物的旋光度和CD谱数据和已报道过的同类化合物(3R构型的异黄酮旋光度为左旋,CD谱在250和344 nm有正cotton效应;而3S构型的异黄酮旋光度为右旋,CD谱在230和326 nm有负cotton效应)对比[6, 7],确认化合物中的手性碳C-3为R构型。至此,鉴定化合物1的结构为3R-6-羟基-8-羟甲基-4′,7-二甲氧基-二氢异黄酮,为1个新化合物,命名为补骨脂异黄酮A。
| 表 1 化合物1的1H- 和13C-NMR数据(500/125 MHz,C5D5N) Table 1 1H- and 13C-NMR data of compound 1 (500/125 MHz,C5D5N) |
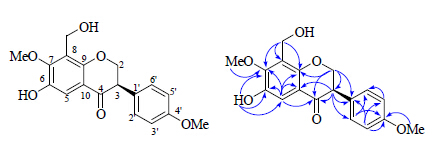 |
图 1 化合物1的结构及主要HMBC相关 Fig.1 Structure and key HMBC correlations Fig.1 Structure and key HMBC correlations  of compound 1 of compound 1 |
由于有文献报道补骨脂中的黄酮类化合物具有明显的细胞毒活性,因此对化合物1进行了细胞毒活性筛选。细胞毒活性检测采用改良的MTT法[8],测试细胞株为NB4、A549、SHSY5Y、PC3、MCF7。结果表明,化合物1对所选的5株细胞的IC50值分别为12.6、5.3、15.5、4.8和11.2 μmol/L;以紫杉醇为阳性对照(其对各细胞株的IC50值分别为0.03、0.02、0.10、0.10、0.05 μmol/L),化合物1表现出一定的细胞毒活性。
| [1] | 郭晏华, 罗志冬, 贾天柱. 补骨脂炮制前后补骨脂素和异补骨脂素的变化 [J]. 中草药, 2006, 37(11): 1652-1654. |
| [2] | 吴疆, 魏巍, 袁永兵. 补骨脂的化学成分和药理作用研究进展 [J]. 药物评价研究, 2011, 34(3): 217-219. |
| [3] | 刘桦, 白焱晶, 陈亚云, 等. 中药补骨脂化学成分的研究 [J]. 中国中药杂志, 2008, 33(12): 1410-1412. |
| [4] | 曹金一, 刘京晶, 黄文华, 等. 补骨脂药理作用与临床应用研究进展 [J]. 中药药理与临床, 2008, 24(6): 89-92. |
| [5] | 江洪波, 田祥琴, 胡小兵, 等. 麦冬中几种二氢高异黄酮的立体结构 [J]. 华西药学杂志, 2006, 21(5): 416-419. |
| [6] | Hu, Q F, Niu D Y, Zhou B, et al. Isoflavanones from the stem of Cassia siamea and their anti-tobacco mosaic virus activities [J]. Bull Korean Chem Soc, 2013, 34(10): 3013-3016. |
| [7] | Huang X Z, Bai X S, Liang H, et al. Cytotoxic isoflavanones from Uraria clarkei [J]. Bull Korean Chem Soc, 2013, 34(5): 1421-1424. |
| [8] | Hu Q F, Zhou B, Ye Y Q, et al. Cytotoxic deoxybenzoins and diphenylethylenes from Arundina graminifolia [J]. J Nat Prod, 2013, 76(10): 1854-1859. |
 2015, Vol. 46
2015, Vol. 46


