血吸虫病(schistosomiasis)是严重危害人类身体健康的传染性疾病。血吸虫病疫区的水资源不能放心应用于人民群众的生产和生活,严重制约着血吸虫病疫区的经济发展[1]。钉螺(oncomelania)是日本血吸虫Schistosoma japonicum的唯一中间寄主,是血吸虫病传播不可缺少的环节,但钉螺也是血吸虫生活周期中最脆弱的一环,杀灭钉螺将有效地遏制血吸虫病的传播[2]。近半个世纪以来,灭螺工作倍受重视,成为血吸虫病控制的中心工作。
灭螺的药物多种多样,根据其来源主要分为3类:化学药物、微生物和植物提取物。目前,血吸虫病疫区控制钉螺广泛采用的方法是化学药物,广泛使用的杀螺化学药物主要有五氯酚钠、氯硝柳胺、烟酰苯胺、溴乙酰胺、杀螺胺、杀螺胺乙醇胺盐、四聚乙醛、聚醛•甲萘威。其中杀螺胺乙醇胺盐、四聚乙醛属于低毒,其他杀螺剂杀螺作用虽强,但对鱼和人、畜的毒性大,其中吗啉、沙蚕毒素类因为毒性大已撤销登记。改造和突破现有杀螺药物的结构,寻找效果好、毒性小、成本低、使用方便的新型杀螺药物显得尤为重要。
近年来,国内外研究者从植物源天然产物中发现了大量具有杀灭钉螺活性的化合物,并对这些化合物的理化性质、化学结构和构效关系等进行了深入研究,为天然灭螺药物的研究开发打下了扎实的基础。这些化合物包括皂苷类、生物碱类、蒽醌类、黄酮类、萜类和鞣质酸等,主要分布在百合科(Liliaceae)、薯蓣科(Dioscoreaceae)、蒺藜科(Zygophyllaceae)、夹竹桃科(Apocynaceae)、五加科(Araliaceae)、报春花科(Primulaceae)、菊科(Asteraceae)、大戟科(Euphorbiaceae)、夹竹桃科(Apocynaceae)、商陆科(Pytolaccaceae)、漆树科(Anacardiaceae)、蓼科(Polygonaceae)等。
1 皂苷类化合物来源于毛茛科白头翁Pulsatilla chinensis (Bunge) Regel的三萜皂苷有很强的抑螺活性,从中分离到15个单体化合物,它们分属3种类型(结构见图 1-1~3)。其混合提取物杀螺活性24 h的半数致死浓度(LC50)为0.48 mg/L,效果和0.16 mg/L的氯硝柳胺(niclosamide)相当,但目前尚不清楚是哪几种单体化合物在起作用。经提取物处理后,钉螺肝脏和头足部的胆碱脂酶(ChE)、乳酸脱氢酶(LDH)、丙氨酸转氨酶(ALT)、碱性磷酸酶(ALP)的活性均显著下降[3]。
研究结果表明[4],来源于大戟科的三萜皂苷显示出高效的杀螺活性。从大戟属植物Euphorbia retusa Forssk.分离得到的3-O-α-L-xylopyranosyl (1→3)-α-L-xylopyranosyl (1→2)-β-D-glucopyranosyl- lup-1,12-diene-3,21-diol(4)和从Euphorbia paralais L. 中分离得到的3-O-syringic acid (1→4)-α-L- xylopyranosyl (1→3)-β-D-rahminopyranosyl hederagenin(5)、3-O-syringic acid (1→4)-β-D-rahminopyranosyl (1→3)-β-D-rahminopyranosyl hederagenin(6)属于三萜皂苷,具有较强的杀螺活性。
丝兰Yucca smalliana Fern. 的水和甲醇提取物具有很高的杀螺活性,从中分离鉴定了2种新的甾体皂苷(7、8),它们对双脐螺致死质量浓度分别为6 mg/L和11 mg/L。不同皂苷类成分对钉螺的致死浓度不同,这主要取决于皂苷中的糖链,如糖链的单糖数目、单糖的排列顺序、糖苷键的连接方式和糖的取代方式。化合物7和8的苷元部分相同,但因为糖链上单糖的数目和组成不同而导致其抑螺活性不同[5]。
四季米仔兰Aglaia duperreana Merii. 的甲醇提取物对钉螺的LC50为33.4 μg/mL,从其醋酸乙酯提取物中分离得到15个化合物,其中柚皮素三甲醚(naringenin trimethyl ether,9)、(2R,3R)-(+)-4′,5,7- trimethoxydihydroflavonol(10)对钉螺的LC50分别是3.9、10.6 μg/mL,柚皮素三甲醚显示出比茶皂素(LC50=4.5 μg/mL)更高的灭螺活性[6]。
来源于夹竹桃Nerium indicum Mill. 的夹竹桃糖苷配基(nerium aglycone,11)呈现较强的杀螺活性,其LC50具有时间依赖性,24、48、72、96 h的LC50分别为80.76、20.12、5.89、3.71 mg/L,其效力可与四聚乙醛(72 h,LC50=3.88 mg/L)相媲美。钉螺经夹竹桃提取液处理后,随着时间的推移其糖原量以及同工酶活性降低;在24和48 h内蛋白质的总量不会发生改变,但是在72和96 h后会有一个非常显著的下降,ChE的量先上升然后下降。这表明夹竹桃提取液严重损害钉螺的生理功能,造成其体内主要的生化物质发生改变。强心苷处理钉螺24~48 h能导致其肝脏细胞核溶解破碎、核膜缺损、细胞器变性、胞膜解体等不可逆损伤,特别是其内质网与解毒作用密切相关,内质网的破损,降低了肝脏的解毒能力[7, 8, 9]。
从吉祥草Reineckia triandra H. Karst. 中提取分离的甾体皂苷类化合物(化学结构尚未确定),当质量浓度为17.5 mg/L时,经72和120 h处理后,钉螺死亡率分别达到86.0%和100.0%;质量浓度在130 mg/L时,168 h鱼死亡率为0,显示该化合物对鱼的毒性非常小[10]。从无患子科塞战藤属植物Serjania salzmanniana Schlecht. 中分离出4种化合物:齐墩果酸(oleanolic acid,12)、白头翁皂苷D(pulsatilla saponin D,13)、salzman- nianoside A(14)、salzmannianoside B(15)。这4种皂苷都具有较强的杀螺活性,质量分数为1×10−5时对双脐螺的致死率达到70%~100%,其中齐墩果酸和白头翁皂苷D的杀螺活性更强,salzman- nianoside A杀螺效果具有浓度依赖性,salzman- nianoside B的杀螺效果具有时间依赖性,时间越长效果越好[11]。
采用水蒸气蒸馏法从道格拉斯菊Atemisia douglasiana L. 中得到vulgarone B(16),其能引起溶血,24 h对福寿螺的LC50为30 μmol/L[12]。
从报春花科植物琉璃繁缕Aglaia duperreana L.中提取得到2种皂苷类化合物desglucoanagalloside B(17)和anagalloside B(18)。Desglucoanagalloside B在质量分数6.25×10−7时对光滑双脐螺有较好的活性,1.25×10−6时所有被测的钉螺全部死亡,表现出非常强的杀螺活性[13]。李桂玲等[14]从商陆Phytolacca acinosa Roxb. 中提取的皂苷在24 h内对钉螺的致死浓度为125 mg/L,其杀螺效果与10 mg/L的五氯酚钠相当。该研究同时确定了最适杀螺温度为28 ℃,最适合的杀螺季节是秋季。具有杀螺活性的皂苷类化合物见图 1。
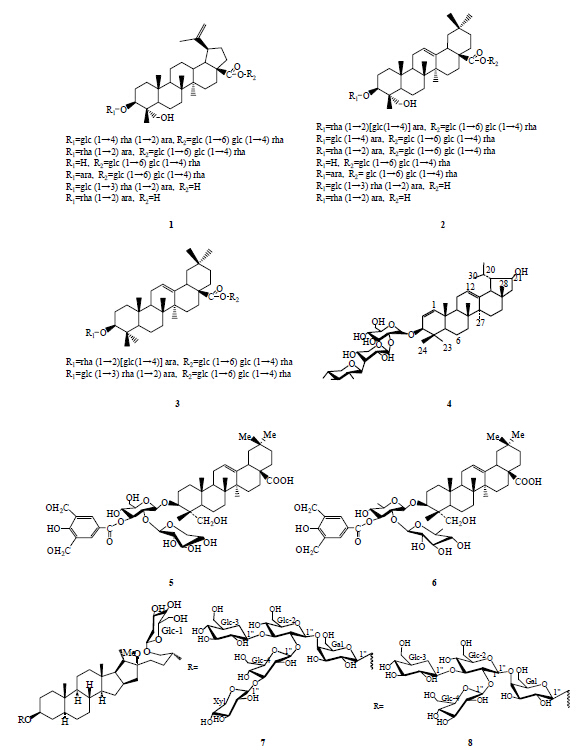 | 图 1 具有杀螺活性的皂苷类化合物Fig.1Saponins with molluscicidal activity |
从罂粟科植物血水草Eomecon chionantha Hance提取的血水草总碱(Eomecon chionantha alkaloids,ECA)具有杀螺活性,其杀灭钉螺的主要活性成分是白屈菜红碱(chelerythrine,19),抑制肝细胞生长和损害肝功能是血水草生物碱致钉螺死亡的主要原因[15]。从ECA中分离得到白屈菜红碱、血根碱(sanguinarine,20)、原托品碱(protopine,21)、α-别隐品碱(α-allocyptopine,22)、氧化血根碱(oxysanguinarine,23)和羽扇豆醇乙酯(lupenyl acetate,24)等。钉螺在ECA质量浓度为2.5 mg/L,温度为25 ℃的情况下浸72 h,死亡率达到100%。ECA能显著促进钉螺足跖平滑肌张力增加、收缩幅度减小、收缩频率加快,且有明显的量效关系。ECA兴奋钉螺足跖平滑肌,导致其紧张性收缩或痉挛性麻痹的作用机制可能是通过mAChR介导,激活受体依赖性钙通道(ROCC),促外Ca2+内流和内钙释放。ALT水平是肝细胞受损的一个敏感指标,经过ECA处理24~36 h后,ALT在肝组织中的量升高,且ECA浓度越高上升越快,48~72 h内下降,ECA浓度越高下降的也越快。24 h内,温度和ECA浓度对钉螺死亡率的影响显著。在30 ℃时,ECA对钉螺的死亡率具有时间和浓度依赖性 [16]。
边缘茄碱(α-solamarrgine,25)来源于黄果茄Solanum xanthocarpum Schrad. et Wendl.[17]。在28 ℃、质量浓度为0.2 mg/L,浸泡48 h,钉螺死亡率为100%,显示出很强的杀螺活性。黄果茄果实粉120 mg/L浸泡钉螺,24 h对钉螺的抑爬率达93.3%,黄果茄果实乙醇浸提总生物碱4.32 mg/L浸泡钉螺,24 h的死亡率为96.7%,48 h的死亡率为100%[18]。野生黄果茄广泛分布于我国南方丘陵地带,还有人工栽培。
喜树Camptotheca acuminate Decne. 是一种亚热带植物。尹蔚琳等[19]将喜树叶烘干、研磨、浓缩、萃取并结晶得到喜树碱(camptothecine,26),并对其进行了杀螺活性及其机制研究。结果发现,200、400、800 mg/L喜树碱处理钉螺,第4天钉螺死亡率均达到80%以上。
谭苹等[20]应用酶组织化学染色法研究槟榔碱(arecoline,27)的灭螺作用机制,发现槟榔碱的作用机制在于阻断钉螺体内氧化磷酸化偶联生成ATP,进而影响能量代谢,最终因ATP生成障碍而使钉螺丧失机械运动及生物合成等生命功能而死亡。
天南星Arisaema heterophyllum Blume var. typicum Makino根和叶提取物中含有生物碱,具有很强的灭螺活性,浸液处理后,可引起钉螺肝脏丙二醛(MDA)水平显著升高,且随处理浓度的升高和处理时间的延长,MDA水平进一步升高,表明天南星生物碱成分通过引起钉螺肝脏的过氧化损伤而发挥杀螺活性[21]。
分别对一把伞南星Arisaema erubescens (Wall.) Schott石油醚、氯仿、醋酸乙酯、正丁醇提取物进行杀螺活性检测[22]。结果发现,其正丁醇提取物(NBE)的杀螺效果最好,48 h的IC50和LC90分别为60.2、145.6 mg/L;石油醚提取物(BZE)最差,48 h的IC50和LC90分别为486.2、1136.8 mg/L。经NBE处理后钉螺中的ChE和ALP活性显著下降,同工酶电泳实验显示,钉螺肝脏中的同工酶 [酯酶(EST)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)]水平相对于头足对NBE提取物更加敏感。NBE处理72 h后,钉螺肝脏中EST活性降低,一些酯酶(EST1和EST4)消失,但是SOD和GSH-Px水平在NBE提取物处理48 h后升高。钉螺肝脏解毒能力下降以及氧化损伤是一把伞南星灭螺的主要机制之一。具有杀螺活性的生物碱类化合物见图 2。
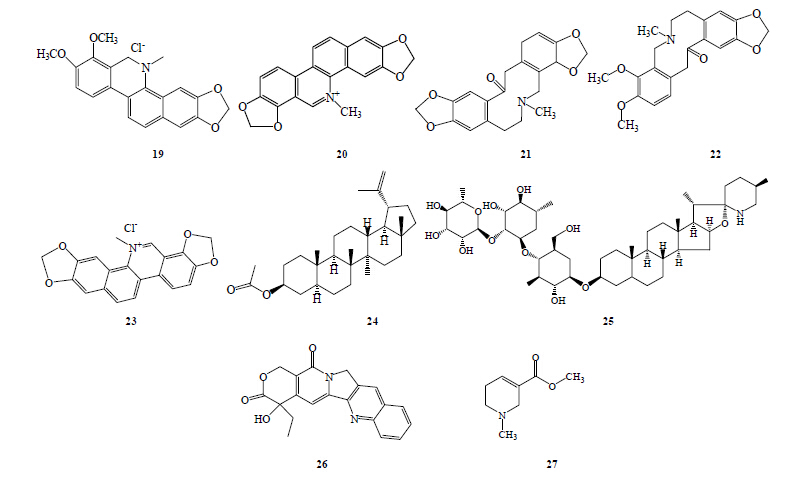 | 图 2 具有杀螺活性的生物碱类化合物Fig.2Alkaloids with molluscicidal activity |
蓼科植物掌叶大黄Rheum palmatum L. 中含有蒽醌类化合物,如大黄素(rheumemodin,28)、大黄酚(chrysophanol,29)、大黄素甲醚(physcion,30)和大黄酸(rhein,31)[23]。大黄酸和大黄酚杀螺活性最好,且对所有钉螺都有毒杀作用,LC50为0.03%。大黄酚对小泡螺和钉螺有活性,对双脐螺没有灭杀作用。Chrysophanol anthron(32)是合成大黄酚的先导物,对所有钉螺都具有灭杀活性,对双脐螺的灭杀作用最强。蒽醌类化合物杀螺作用机制主要是干扰细胞信号通路[24]、影响Na+, K+-ATPase和刺激腺苷酸环化酶。腺苷酸环化酶是cAMP信号通路重要的酶。一些蒽醌类物质亲脂,所以能够通过自由扩散通过细胞膜,而大黄酸和franguloside(33)虽然亲水性强,但是化学性质依然不够活跃。蒽醌类化合物通过调节Na+, K+-ATPase的活性来发挥杀螺活性。萘醌类化合物7-甲基胡桃醌(7-methyljuglone,34)和白花丹素(plumbagin,35)互为同分异构体,二者杀螺LC50分别为5×10−6和3×10−6。
羊蹄Rumex japonicus Houtt. 的正丁醇提取物和水提物具有较强的灭螺活性,其根中含有大黄酚、大黄素、酸模素等,哪种物质活性最强正在研究之中。羊蹄生长迅速,植物材料易于获得,而且羊蹄水提物的灭螺活性相对较强,这将为实际应用中有效成分的提取以及灭螺环境的形成带来方便[25]。
从大戟属植物Euphorbia retusaForssk. 分离得到glucopyranosyl(36)、5,7,8,3′,4′-pentahydroxy-3- methoxyflavone(37)和从大戟科大戟属植物Euphorbia paralais L. 中分离得到的3,5,3′- trihydroxy-6,7-dimethoxy-4′-(7″-hydroxygeranyl-1″-ether) flavone(38)的黄酮类化合物具有较强的杀螺活性。何首乌Fallopia multiflora (Thunb.) Haraldson叶子含有槲皮素(quercetin,39),在1.0×10−5质量分数下,处理24 h可导致椎实螺的死亡率达到100%。
鬼针草Bidens pilosa L.含有具有杀卵和灭螺活性的黄酮类、鞣质酸和皂苷类化合物。钉螺经鬼针草提取物浸泡后,体内的细胞色素P450(cytochrome P450)酶活性降低,该酶是在解毒过程中代谢各种外源有害物质[26]。
研究表明,崖豆藤属植物Millettia thonningii Roxb. 提取液杀螺活性显著[27],其主要有效成分是猫尾草异黄酮(alpinumisoflavone,40),为吡喃异黄酮类化合物;黄花夹竹桃Thevetia peruviana (Pers.) K. Schum. 具有杀螺活性,其主要活性成分为芹菜素-5-甲基醚(apigenin-5-methyl ether,41)和三萜皂苷。从蓼科植物Polygonum senticosum (Meisn.) Franch. et Sav. 中提取的没食子酰基类黄酮也具有杀螺活性[28]。具有杀螺活性的蒽醌和黄酮类化合物见图 3。
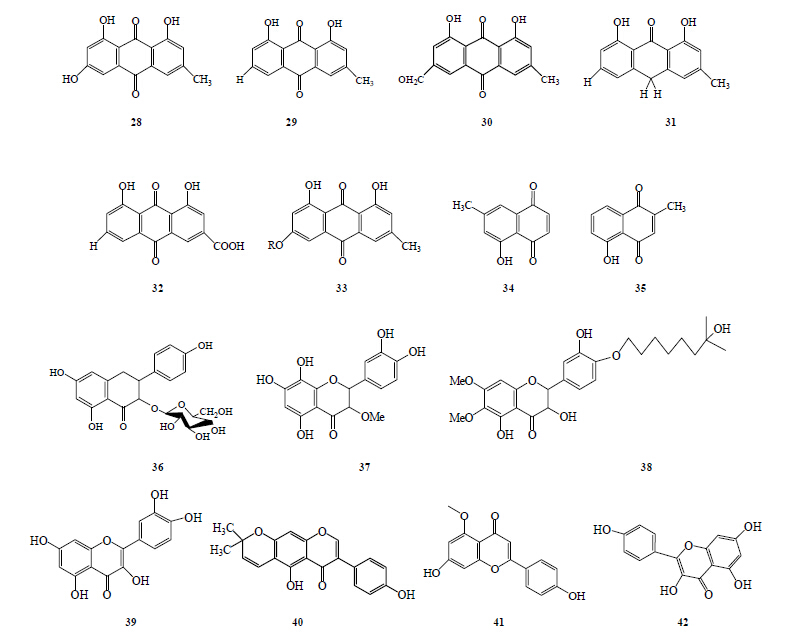 | 图 3 具有杀螺活性的蒽醌和黄酮类化合物Fig.3 Anthraquinones and flavonoids with molluscicidal activity |
鞣质类是复杂的酚类化合物,从黄酮类物质衍生而来,具有一定的杀螺作用[29]。山毛榉科(Fagaceae)、蔷薇科(Rosaceae)、含羞草科(Mimosaceae)、桃金娘科(Myrtaceae)、茜草科(Rubiaceae)等植物的甲醇和水提取物含有鞣质类化合物。
彭旦明等[30]在探究不同生境下枫杨Pterocarya stenoptera C. DC.、乌桕Sapium sebiferum (L.) Roxb.对钉螺的影响实验中发现,2个月内钉螺糖原量无明显变化,4个月时,糖原量则明显下降。从乌桕叶分离出4种抑螺化学物质,分别为山柰酚(kaempherol,42)、没食子酸乙酯(ethyl gallate,43)、槲皮素(quercetin,39)、没食子酸(gallic acid,44)[31]。
白果富含银杏酸(ginkgolic acid,45)[32],质量分数为5.46%,表现出强烈的杀螺活性(LD50=1.49×10−6)。在24 h内其石油醚、醋酸乙酯、乙醇提取物的LD50分别为7.81、27.33、64.14 mg/L。通过高效液相色谱分析,银杏酸包括3种类型:C13:0、C15:1和C17:1,考察三者对钉螺杀灭活性,钉螺死亡率分别为45%(C13:0)、65%(C15:1)、0(C17:1),烷基侧链的长度对杀螺效果有重要影响。具有杀螺活性的鞣质类、烷基水杨酸和没食子酸类化合物见图 4。
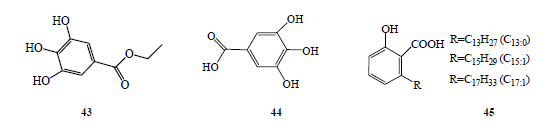 | 图 4 具有杀螺活性的鞣质、烷基水杨酸和没食子酸类化合物Fig.4 Tannins, alkyl salicylic acids, and gallic acids flavonoids with molluscicidal activity |
过江藤属Phyla Lour. 植物中含有灭杀光滑双脐螺的单萜类化合物百里酚(thymol,46)、香芹酚(carvacrol,47)、柠檬烯(cinene,48)。从海南蒲桃 Syzygium hainanense Chang & Miau叶提取的精油中富含单萜类化合物(87.12%),包括31.85%的α-蒎烯(α-pinene,49),28.98% (Z)-β-罗勒烯 [(Z)-β-ocimene,50] 和11.71% (E)-β-罗勒烯[(E)-β-ocimene,51]。海南葡桃叶精油48 h对光滑双脐螺和亚马逊利什曼原虫的LC50分别为9×10−5和6×10−5,对预防血吸虫病和利什曼病有很好的开发前景。但对于到底是那种化合物起主要作用或者是哪几种成分起到协同作用还未清楚[33]。
佛波醇酯(phorbol esters,52)是新发现的二萜类化合物,来源于麻风树Jatropha curcas L.。麻风树的种子对双脐螺和钉螺均有作用,但对钉螺更为敏感,研究表明,麻风树种子中含有的佛波醇酯发挥了灭螺作用,质量分数为0.001%时即能杀死这2种钉螺。麻风树果的外壳和内壳的甲醇提取物比水提物有更强的杀螺活性,且对湖北钉螺的活性最强[23],从其内核的甲醇提取物中分离得到的化合物4β-phorbol-13-decanoate(53)表现出最强的杀螺活性,其LC50为1×10−5,而4β-phorbol-12-myristate- 13-acetate(54)活性较弱,没有酯基团的4α-phorbol(55)也表现出相对较弱的活性。由此可见,佛波醇酯至少含有一条脂肪酸侧链才具有杀螺活性。佛波醇酯还可以通过刺激蛋白激酶C,干扰磷酸肌醇/ Ca2+信号通路来实现杀螺[34]。佛波醇酯的碳链骨架称为巴豆萜烷[35],包括A、B、C、D 4个环,在不同的位置羟基化以及在酯部结合不同的酸可形成不同的佛波醇酯化物。佛波醇酯分为2类α型和β型,它们的不同在于C环上的羟基位置不同,这将导致D环的空间位置影响构象。天然来源的佛波醇酯不稳定,在分离的过程中容易发生氧化、水解、酯交换以及差相异构等反应,所以分离必须在无氧的环境下进行。
从大戟属植物Euphorbia paralias L. 中提取到9个具有一定杀螺活性的二萜类化合物。化合物56具有最强的杀螺活性,质量分数为1.5×10−5和1×10−5时杀螺率分别为100%和30%。在质量分数为5×10−5时,化合物56~59均具有100%杀螺活性,在2.5×10−5时只有化合物56有100%杀螺活性[36]。
倍半萜烯warburganal(60)及其同系物和倍半萜烯内酯二氢豚草素(damsin,61)及其衍生物表现出高效的杀螺活性,其中2×10−6的warburganal在24 h内可以杀灭所有实验钉螺。从斑鸠菊族植物中分离得到16种具有杀螺活性的倍半萜烯内酯,其中10种化合物(65、67、68、70、71、72、74、75、76、77)在质量浓度小于100 mg/mL时表现出很好的杀螺活性;化合物62、63、64、69、72、73表现稍差的杀螺活性。16种化合物属于4种化学结构类型:hirsutinolide型(62~66)、glaucolide型(67~69),goyazensolide型(70~73)和isogoyazensolide型(74~77)。其中goyazensolide型和isogoyazen- solide型(除76、77外)有exomethylidene-γ-lactone结构。通过杀螺活性结果显示,不是所有具有exomethylidene- γ-lactones结构的化合物都具有杀螺活性,因此,这个功能结构对于杀螺活性也许是必需的但还不够充分。Isogoyazensolide类化合物中C4=C15双键以及exomethylidene-γ-lactone部分具有的C7=C11双键在杀螺活性上起到了重要作用。所以推断合成衍生物77是因为2个双键都被还原,而不具有杀螺活性(LD50>100 mg/mL)。Goyazensolide类化合物杀螺活性依靠C-8上的酯链,化合物67具有甲基丙烯酸酯,杀螺活性最高;glaucolide类化合物67和68有一个C1=O双键。Hirsutinolide类化合物65和66也具有杀螺活性,发现这2种化合物在C-1和C-10位上有2个相邻的羟基。由此可见,倍半萜内酯的杀螺活性主要与大根香叶内酯骨架以及相关的官能团相关[37]。石胡荽Centipeda minima (L.) A. Braun & Asch. 的水提物和醇提物均具有灭螺作用,其水提物灭螺效果优于醇提物,石胡荽中灭螺的有效成分是倍半萜内酯类和甾醇类,但石胡荽的灭螺有效成分对钉螺作用较缓慢,浸泡处理钉螺3 d后其死亡率才明显上升,可能其毒性存在一个蓄积的过程[38]。具有杀螺活性的萜类化合物见图 5。
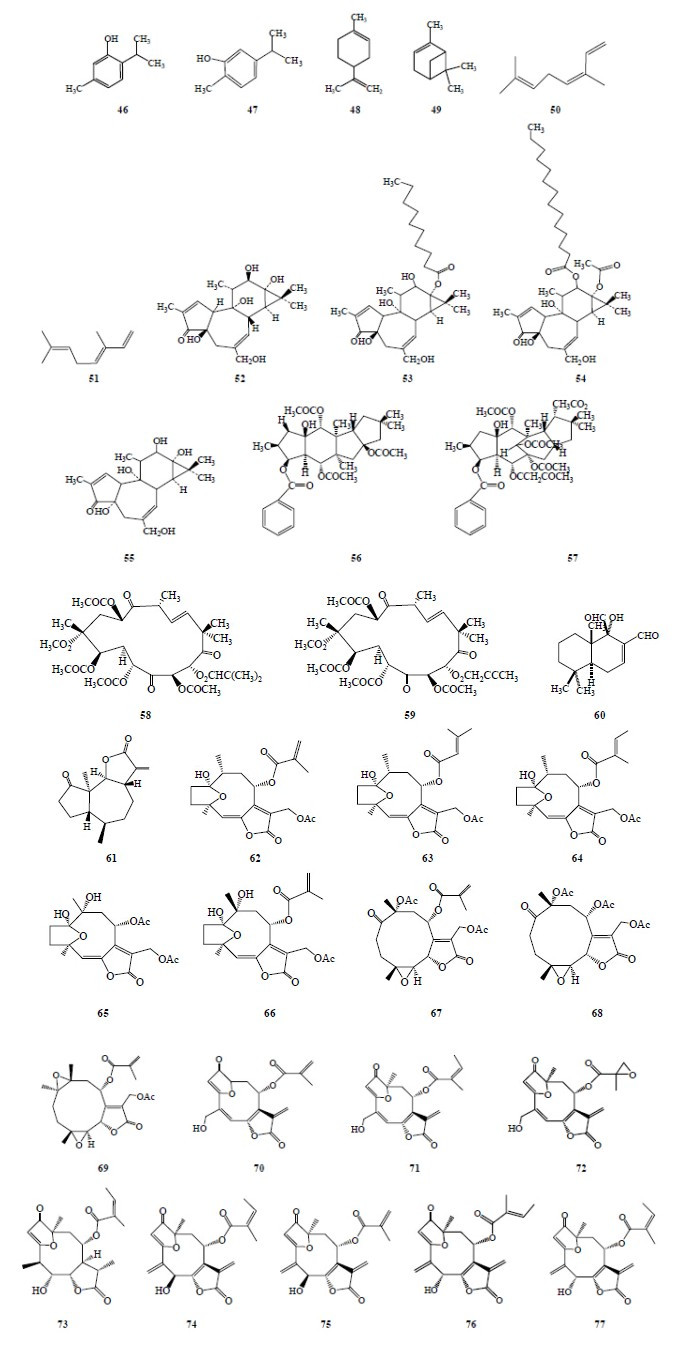 | 图 5 具有杀螺活性的萜类化合物Fig.5 Terpenes with molluscicidal activity |
研究发现,质量浓度大于10 mg/L的蛇床子总香豆素溶液处理钉螺3~4 d可100%杀死钉螺,且处理液浓度和处理时间与钉螺的死亡率呈显著的正相关[39]。从橄榄科植物没药Commiphora myrrha (Nees) Engl. 中提取的精油比树脂具有更高的杀椎实螺活性,精油在24、48、96 h的LC50分别为5×10−6、4×10−6和3×10−6。但树脂具有更高的灭杀尾蚴的能力,其15 min的100%致死浓度为2.5×10−6[40]。研究表明,豚草Ambrosia artemisiifolia L. 籽醇提取制成浓缩液,将浓缩液稀释至0.1、0.5、1 g/L,进行钉螺浸杀实验。结果显示,质量浓度大于0.5 g/L的豚草籽提取液具有抑制钉螺上爬和毒杀效果,处理72 h钉螺死亡率达100%[41]。桉树叶和挥发油可入药,有消炎、杀菌、健胃、祛痰、驱风之效。通过对5种桉树叶进行灭螺活性实验,发现5种挥发油(10 mg/L)浸杀48 h后钉螺的死亡率均≥60%,柠檬桉和尾叶桉挥发油的效果比其他3种好。但是现在并不知道是桉树叶里的哪种有效成分具有杀螺作用[42]。富贵草Pachysandra terminalis Sieb. et Zucc. 粉及提取物(PT-I)具有较好的杀灭钉螺和抑制钉螺上爬的作用,且对鱼的毒性小。富贵草粉2.19、4.38 mg/L浸泡钉螺42 h,其抑制钉螺上爬率分别达到63.3%和100.0%;PT-I 1.4 mg/L浸泡钉螺72 h,钉螺死亡率达到96.7%[43]。
从马尾藻Sargassum natans J. Agargh. 中获得的化合物ricciocarpin A(78)和ricciocarpin B(79)具有很强的杀光滑双脐螺活性,LC50分别是1.1×10−5和4.3×10−5[44]。大多数楝属植物的根中含有川楝素(80)[45],它能通过抑制K+通道的和促进L型Ca2+通道进行杀螺。喜旱莲子草Alternanthera philoxeroides (Mart.) Griseb. 水提液表现出明显的迅速麻醉钉螺的作用,抑制钉螺上爬效果与化学灭螺剂相似,这点在目前所知植物灭螺水浸液中是非常独特的。1%喜旱莲子草水浸液即表现出明显的抑螺效果,钉螺一浸入到提取液中立即静止不动,一直延续24 h均如此,但大多数并未死亡,其主要是通过抑制胆碱酯酶活性和ATP酶活性来发挥作用[46]。具有杀螺活性的其他类化合物见图 6。
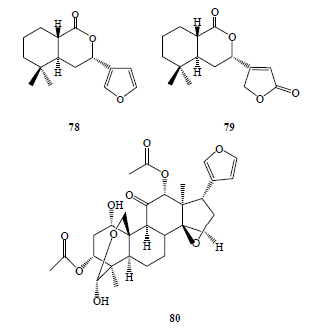 | 图 6 具有杀螺活性的其他类化合物Fig.6 Others components with molluscicidal activity |
早期人们对植物灭螺剂的研究多数是使用植物粉末或者植物提取物直接灭螺,对具有灭螺活性的具体化学成分的研究较少[47]。目前,人们对灭螺天然产物的研究则更加注重于化合物的分离纯化、结构鉴定和作用机制研究,力图明确成分分子中的哪些官能团在起决定性的作用,通过检测化学处理后钉螺超微结构以及生化指标的改变来阐明活性成分的作用机制。对灭螺机制的研究主要是通过研究钉螺生理学特征、生物化学参数、组织化学等方面的变化,进而探讨植物灭螺剂的灭螺机制,找出植物灭螺剂作用的靶器官[48]。然而,在研究过程中,钉螺的某些生理学特征可能不仅受植物灭螺剂的影响,还受到其他外界因素如温度、湿度和季节等的干扰,而且某些生理学特征的改变往往是多种因素共同作用的结果,因此单纯从钉螺的生理特征的变化还不足以了解植物灭螺剂确切的灭螺机制,仍需借助其他方法做进一步研究。
开发一种新的植物灭螺剂必须考虑到以下3个方面问题:(1)具有较好的杀螺以及摇尾幼虫效果,且对非靶生物的毒杀作用小,最好是无影响;(2)植物资源必须丰富,并且对有效成分的提取分离、纯化成本不高;(3)灭螺机制探究要透彻,掌握钉螺超微结构以及生理生化上的改变。现阶段研究成果表明,有些药物能够明显抑制钉螺上爬,有些药物能够很好地杀灭摇尾幼虫,有些药物刺激性小能够有效防止钉螺合靥,有些药物的杀螺活性和时间呈正比与浓度关系不大,有些药物的杀螺活性与浓度呈正相关但与时间的关系不大。还有一些研究发现湖北钉螺中的血蓝蛋白很可能和钉螺有相同的碳水化合物抗原,这样日本血吸虫可以逃避钉螺的免疫攻击[49]。
为了有效地研发新型灭螺药物,主要可以从以下3方面着手:(1)加强植物灭螺剂化学成分的分析,找出关键灭螺化学成分及有效的功能基团和构象,为研制仿生植物灭螺剂提供依据;(2)综合多种有效的化学成分,找到最佳的杀螺混合比例;(3)寻找免疫原刺激钉螺产生灭杀钉螺的抗体,打破钉螺和血吸虫的系统。
| [1] | 蒲真清, 黄继山, 刘 俊, 等. 植物灭螺机理研究进展 [J]. 安徽农业科学, 2008, 36(14): 5724-5726. |
| [2] | Wang L D, Guo J G, Wu X H, et al. China's new strategy to block Schistosoma japonicum transmission: experiences and impact beyond schistosomiasis [J]. Tropical Med Int Health, 2009, 14(12): 1475-1483. |
| [3] | Chen Y Q, Xu Q M, Liu Y L, et al. Laboratory Evaluation of the molluscicidal activity of Pulsatilla chinensis (Bunge) Regel saponins against the snail Oncomelania hupensis [J]. Biomed Envir Sci, 2012, 25(2): 224-229. |
| [4] | Refahy L A G. Study on flavonoids and triterpenoids content of some Euphorbiaceae plants [J]. J Life Sci, 2011, 5: 100-107. |
| [5] | Diab Y, Ioannou E, Emam A, et al. Desmettianosides A and B, bisdesmosidic furostanol saponinswith molluscicidal activity from Yucca desmettiana [J]. Nat Instit Health, 2012, 77(6): 686-690. |
| [6] | Zhang H, Xu H H, Song Z J, et al. Molluscicidal activity of Aglaia duperreana and the constituents of its twigs and leaves [J]. Fitoterapia, 2012, 83(6): 1081-1086. |
| [7] | Dai L, Wang W, Dong X, et al. Molluscicidal activity of cardiac glycosides from Nerium indicum against Pomacea canaliculata and its implications for the mechanisms of toxicity [J]. Envir Toxicol Pharmacol, 2011, 32(2): 226-232. |
| [8] | 王万贤, 杨 毅, 王 宏, 等. 夹竹桃强心总甙灭螺活性与机理 [J]. 生态学报, 2006, 26(3): 954-959. |
| [9] | 王万贤, 杨 毅, 王 宏, 等. 夹竹桃对钉螺的毒杀作用及机理研究 [J]. 水生生物学报, 2007, 31(3): 448-452. |
| [10] | 冯玉文, 李文新, 刘 实, 等. 吉祥草中杀灭钉螺化合物的提取分离 [J]. 中国血吸虫病防治杂志, 2006, 18(3): 178-181. |
| [11] | Ekabo O A, Farnsworth N R, Henderson T O, et al. Antifungal and molluscicidal saponins from Serjania salzmanniana [J]. J Nat Prod, 1996, 59(4): 431-435. |
| [12] | Duke S O, Cantrell C L, Meepagala K M, et al. Natural toxins for use in pest management [J]. Toxins, 2010, 2(8): 1943-1962. |
| [13] | Abdel Gawad M M, ElAmin S M, Ohigashi H, et al. Molluscicidal saponins from Anagallis arvensis against schistosome intermediate hosts [J]. Japn J Infect Dis, 2000, 53(1): 17-19. |
| [14] | Li G, He C, Wang X, et al. Extraction of phytolacca acinosa and its mulloscacidal effects [J]. J Tongji Med Univ, 1998, 18(2): 69-71. |
| [15] | 彭 飞. 血水草白屈菜红碱灭螺效果及对钉螺肝脏损伤机理的研究 [D]. 长沙: 湖南师范大学, 2012. |
| [16] | Peng F, Liu M, Huang Q, et al. Molluscicidal effect of Eomecon chionantha alkaloids against Oncomelania hupensis snails [J]. Southeast Asian J Tropical Med Public Health, 2011, 42(2): 289-296. |
| [17] | 李 洲, 程 溪, 王春静, 等. 黄果茄杀灭钉螺有效成分的分离提纯及其效果观察 [J]. 中国寄生虫学与寄生虫病杂志, 2006, 23(4): 206-208. |
| [18] | 李娟娟, 祁 超, 刘 实, 等. 黄果茄果实的灭螺活性及其有效成分的提取分离 [J]. 农药, 2009(9): 644-646. |
| [19] | 尹蔚琳, 王万贤, 吴明煜, 等. 珙桐科植物喜树灭螺机理研究 [J]. 湖北大学学报: 自然科学版, 2009, 31(2): 184-188. |
| [20] | 谭 苹, 何昌浩. 槟榔碱与杀螺药合用对钉螺头足部影响的扫描电镜观察 [J]. 中国血吸虫病防治杂志, 2001, 13(1): 21-23. |
| [21] | 柯文山, 杨金莲, 孟 珍, 等. 天南星有效成分的杀螺活性分析 [J]. 中国媒介生物学及控制杂志, 2008, 19(2): 130-131. |
| [22] | Ke W, Yang J, Meng Z, et al. Evaluation of molluscicidal activities of Arisaema tubers extracts on the snail Oncomelania hupensis [J]. Pesticide Biochem Physiol, 2008, 92(3): 129-132. |
| [23] | Liu S Y, Sporer F, Wink M, et al. Anthraquinones in Rheum palmatum and Rumex dentatus (Polygonaceae), and phorbol esters in Jatropha curcas (Euphorbiaceae) with molluscicidal activity against the schistosome vector snails Oncomelania, Biomphalaria, and Bulinus [J]. Tropical Medi Int Health, 1997, 2(2): 179-188. |
| [24] | Alberts P. Effects of N-6,2'-O-dibutyryladenosine 3',5'-cyclic monophosphate, adenosine, and of oxotremorine and 3-isobutyl-1-methylxanthine on the electrically evoked [3H] acetylcholine secretion in the guineapigileum myenteric plexus [J]. Acta Physiol Scandinav, 1989, 137(4): 489-496. |
| [25] | 王 宏, 温和秀. 羊蹄灭螺活性初步研究 [J]. 咸宁医学院学报, 2002, 16(1): 1-2. |
| [26] | Souza B A, Silva L C, Chicarino E D, et al. Preliminary phytochemical screening and molluscicidal activity of the aqueous extract of Bidens pilosa Linné (Asteraceae) in Subulina octona (Mollusca, Subulinidade) [J]. Anais Acad Brasileira Ciências, 2013, 85(4): 1557-1566. |
| [27] | Perrett S, Whitfield P J, Sanderson L, et al. The plant molluscicide Millettia thonningii (Leguminosae) as a topical antischistosomal agent [J]. J Ethnopharmacol, 1995, 47(1): 49-54. |
| [28] | Hostettmann K. On the use of plants and plant-derived compounds for the control of schistosomiasis [J]. Naturwissenschaften, 1984, 71(5): 247-251. |
| [29] | Singh S K, Yadav R P, Singh A. Molluscicides from some common medicinal plants of eastern Uttar Pradesh, India [J]. J Appl Toxicol, 2010, 30 (1): 1-7. |
| [30] | 彭旦明, 彭镇华. 枫杨, 乌桕对钉螺毒性的研究 [J]. 应用生态学报, 1995, 6(3): 301 -304. |
| [31] | 王富乾, 张锦文, 姚广民, 等. 乌桕叶化学成分研究 [J]. 中国药学杂志, 2013, 48(22): 1908-1912. |
| [32] | Yang X, Chen S, Xia L, et al. Molluscicidal activity against Oncomelania hupensis of Ginkgo biloba [J]. Fitoterapia, 2008, 79(4): 250-254. |
| [33] | Dias C N, Rodrigues K A F, Carvalho F A A, et al. Molluscicidal and leishmanicidal activity of the leaf essential oil of Syzygium cumini Skeels from Brazil [J]. Chem Biodiv, 2013, 10(6): 1133-1141. |
| [34] | Rug M, Ruppel A. Toxic activities of the plant Jatropha curcas against intermediate snail hosts and larvae of schistosomes [J]. Tropical Med Int Health, 2000, 5(6): 423-430. |
| [35] | Goel G, Makkar H P S, Francis G, et al. Phorbol esters: structure, biological activity, and toxicity in animals [J]. Int J Toxicol, 2007, 26(4): 279-288. |
| [36] | Abdelgaleil S A M, El-Aswad A F, Nakatani M. Molluscicidal and antifeedant activities of diterpenes from Euphorbia paralias L. [J]. Pest Management Sci, 2002, 58(5): 479-482. |
| [37] | Borkosky S, de León S P, Juárez G, et al. Molluscicidal sesquiterpene lactones from species of the tribe Vernonieae (Compositae) [J]. Chem Biodiv, 2009, 6(4): 513-519. |
| [38] | 倪 红, 马安宁, 张 云, 等. 石胡荽有效成分灭螺的初步研究 [J]. 中国寄生虫学与寄生虫病杂志, 2009, 27(4): 377-378. |
| [39] | 张新勇, 张勇耀, 徐国余, 等. 中药蛇床子提取液杀灭钉螺的活性成分研究 [J]. 中国血吸虫病防治杂志, 2004, 15(6): 462. |
| [40] | De S Luna J, Dos Santos A F, De Lima M R F, et al. A study of the larvicidal and molluscicidal activities of some medicinal plants from northeast Brazil [J]. J Ethnopharmacol, 2005, 97(2): 199-206. |
| [41] | 汪平姚, 杨建明, 吴春红, 等. 豚草籽提取液灭螺效果研究 [J]. 湖北大学学报: 自然科学版, 2006, 28(2): 202-204. |
| [42] | 陈婷婷, 周晓农, 朱 丹, 等. 桉树叶提取物杀灭钉螺筛选试验 [J]. 中国血吸虫病防治杂志, 2012, 24(6): 694-696. |
| [43] | 王莹莹, 李文新, 王 庆, 等. 富贵草杀灭钉螺效应研究 [J]. 植物科学学报, 2007, 25(3): 394-397. |
| [44] | Held C, Fröhlich R, Metz P. Enantioselective synthesis of the ricciocarpins A and B [J]. Angewandte Chemie International Edition, 2001, 40(6): 1058-1060. |
| [45] | 施玉樑, 王文萍. 川楝素对K+, Ca2+通道活动及细胞内Ca2+浓度的调控 [J]. 生物化学与生物物理进展, 2007, 34(2): 132-137. |
| [46] | 杨建明, 汪平尧, 肖瑞芬, 等. 喜旱莲子草灭钉螺实验研究 [J]. 湖北大学学报: 自然科学版, 2005, 27(1): 71-73. |
| [47] | 黄炳生, 李明亚. 植物源灭钉螺药的研究进展 [J]. 中药材, 2012, 35(6): 1010-1013. |
| [48] | Han B, Guo D, Chen J. Effects of AIBL on Oncomelania hupensis, the intermediate snail host of Schistosoma japonicum: An enzyme histochemical study [J]. Asian Pacific J Tropical Med, 2012, 5(12): 966-969. |
| [49] | Guo D, Zhang Y, Zeng D, Wang H, Li Y, Fan X. Functional properties of hemocyanin from Oncomelania hupensis, the intermediate host of Schistosoma japonicum [J]. Exp Parasitol, 2009, 123(3): 277-281. |
 2015, Vol. 46
2015, Vol. 46


