胡军华, 刘莉莉, 张艳军, 萧伟. HPLC法同时测定不同产地紫苏叶和荆芥中咖啡酸和迷迭香酸[J]. 中草药, 2015, 46(14): 2155-2159.

HU Jun-hua, LIU Li-li, ZHANG Yan-jun, XIAO Wei. Determination of cafferic acid and rosmarinic acid in
Perilla frutescens leaves and
Schizonepeta tenuifolia by HPLC[J]. Chinese Traditional and Herbal Drugs, 2015, 46(14): 2155-2159.

HPLC法同时测定不同产地紫苏叶和荆芥中咖啡酸和迷迭香酸
胡军华1,2
,
刘莉莉1,2,
张艳军1,2,
萧伟1,2

1. 江苏康缘药业股份有限公司, 江苏 连云港 222001;
2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
收稿日期: 2014-12-13;
基金项目: 国家科技部重大新药创制:现代中药创新集群与数字制药技术平台(2013ZX09402203)
作者简介:胡军华,本科,工程师,从事新药质量标准研究工作。Tel: 13655139779 E-mail: hujunhua2001@163.com
通讯作者:萧 伟,博士,研究员级高级工程师,从事中药新药的研究与开发工作。Tel: (0518)81152337 E-mail: kanionlunwen@163.com
摘要:目的 建立同时测定紫苏Perilla frutescens叶和荆芥Schizonepeta tenuifolia中咖啡酸、迷迭香酸的方法。方法 采用反相高效液相色谱法,Agilent C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液,梯度洗脱。检测波长327 nm,柱温30 ℃,体积流量1.0 mL/min。结果 咖啡酸、迷迭香酸2种成分达到了较好的基线分离,且峰形良好,分别在0.69~22.12、3.65~116.92 μg/mL内线性关系良好,r分别为0.999 5、1.000 0;平均加样回收率分别为紫苏叶102.9%(RSD 1.8%)、105.6%(RSD 1.9%),荆芥101.2%(RSD 2.4%)、101.0%(RSD 1.9%)。结论 本方法快速、灵敏、准确,所有待测组分峰分离度良好,可为紫苏叶、荆芥药材的质量评价提供依据。
关键词:
高效液相色谱法
紫苏叶
荆芥
咖啡酸
迷迭香酸
Determination of cafferic acid and rosmarinic acid in Perilla frutescens leaves and Schizonepeta tenuifolia by HPLC
HU Jun-hua1,2
,
LIU Li-li1,2,
ZHANG Yan-jun1,2,
XIAO Wei1,2

1. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China;
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
Abstract: Objective To establish an HPLC method for the simultaneous determination of cafferic acid and rosmarinic acid in Perilla frutescens leaves and Schizonepeta tenuifolia. Methods The anaiysis was carried out on an Agilent C18 column (250 mm × 4.6 mm, 5 μm), and the mobile phase was composed of actonitrile and 0.1% phosphoric acid aqueous with gradient elution. The detection wavelength was 327 nm. The flow rate 1.0 mL/min at column temperature of 30 ℃. Results Under the chromatographic condition, cafferic acid and rosmarinic acid were completely separated and other components had no effect on their determination. It showed a good linearity in the range of 0.69—22.12 and 3.65 —116.92 μg/mL. The average recoveries of P. frutescens leaves were 102.9% and 105.6%, and the RSD values were 1.8% and 1.9%. The average recoveries of S. tenuifolia were 101.2% and 101.0% and the RSD values were 2.4% and 1.9%. Conclusion The established method is rapid, sensitive, accurate, and the test component peak separation degree is good, and could be used for the simultaneous determination of cafferic acid and rosmarinic acid in P. frutescens leaves and S. tenuifolia, which provides a scientific basis for the quality evaluation of P. frutescens leaves and S. tenuifolia.
Key words:
HPLC
Perilla frutescens leaves
Schizonepeta tenuifolia Briq.
cafferic acid
rosmarinic acid
紫苏叶为唇形科植物紫苏Perilla frutescens (L.) Britt. 的干燥叶(或带嫩枝)[1, 2],在临床上应用较广泛,可用于治疗呼吸道疾病如变应性咽喉炎、鼻炎、呼吸道过敏病及空调病,其酚酸类成分主要有咖啡酸、迷迭香酸[3, 4, 5]。荆芥为唇形科植物荆芥Schizonepeta tenuifolia Briq. 的干燥地上部分[1, 6],荆芥为解表、散风主药,长于发汗、解热,能镇咳、祛风、凉血。从古至今,荆芥在流行性感冒,头疼寒热等疾病中广泛应用。荆芥中酚酸类成分亦含迷迭香酸、咖啡酸[7]。迷迭香酸具有抗过敏、抗氧化和免疫抑制等多种活性[5, 6]。
咖啡酸具有抗炎、抗菌、抗病毒、升高白细胞及血小板等多种药理作用[8]。紫苏叶及荆芥在临床上联合用药治疗过敏性疾病较为常见,了解2味药材中咖啡酸、迷迭香酸的量及批间差异情况具有重要的临床意义。本实验采用HPLC法,建立了同时测定紫苏叶、荆芥中咖啡酸、迷迭香酸量的方法,该方法灵敏、准确,有助于紫苏叶及荆芥药材的质量控制,从而为其各种制剂的生产提供良好的原药材,保证制剂质量。同时也对广西、江苏、安徽、广东等不同产地的紫苏叶及安徽、河北、江苏等不同产地荆芥进行了分析,以比较紫苏叶、荆芥药材质量的异同[10, 11]。
1 仪器与试药
Agilent 1260高效液相色谱仪,戴安U3000高效液相色谱,Waters2695-2487高效液相色谱仪;BSA224S-CW电子分析天平;乙腈为色谱纯;水为超纯水;其余试剂均为分析纯。迷迭香酸对照品(批号 111871-201102)、咖啡酸对照品(批号 110885-200102)购自中国食品药品检定研究院。紫苏Perilla frutescens (L.) Britt. 的干燥叶40批(批号140501~140540),荆芥Schizonepeta tenuifolia Briq. 的干燥地上部分24批(批号140501~140524)由江苏康缘药业股份有限公司质量部吴州研究员提供并鉴定。
2 方法与结果
2.1 色谱条件
色谱柱为Agilent C18柱(250 mm×4.6 mm,5 μm);以乙腈-0.1%磷酸水溶液为流动相,梯度洗脱,0~50 min,9%~66%乙腈;检测波长为327 nm,体积流量为1.0 mL/min,柱温为30 ℃。理论塔板数按迷迭香酸峰计算均应不低于5 000,色谱图见图 1。
2.2 供试品溶液的制备
取紫苏叶或荆芥地上部分约0.5 g,精密称定,精密加50%甲醇50 mL,回流提取1 h,放冷,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
2.3 标准曲线的制备
称取咖啡酸、迷迭香酸对照品适量,加甲醇溶解并定容,摇匀,得质量浓度分别为22.12、116.92 μg/mL的混合对照品储备液,分别精密吸取混合对照品储备液适量,以甲醇倍稀释,摇匀。分别进样10 μL,按“2.1”项色谱条件进行分析,以进样质量浓度的对数为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线。结果咖啡酸回归方程为Y=50.207 X+4.256 (r=0.999 5),线性范围0.69~22.12 μg/mL;迷迭香酸回归方程为Y=29.227 X+0.457 (r=1.000 0),线性范围3.66~116.92 μg/mL。
2.4 精密度试验
精密吸取对照品溶液(迷迭香酸质量浓度3.65、29.23、116.92 μg/mL,咖啡酸质量浓度0.69、5.53、22.12 μg/mL)10 μL,按“2.1”项色谱条件进行分析,重复进样6次,测得峰面积,计算其RSD为0.29%~2.14%。
2.5 稳定性试验
取混合对照品溶液(咖啡酸、迷迭香酸浓度分别为5.53、29.23 μg/mL),分别于0、3、5、9、17、26、28 h按“2.1”项色谱条件进行分析,测定峰面积,计算其RSD为0.77%、0.96%,表明咖啡酸、迷迭香酸对照品溶液在28 h内稳定。
取供试品(紫苏叶批号140505;荆芥批号140504)0.5 g,按“2.2.1”项下制备供试品溶液,精密吸取供试品溶液10 μL,分别于0、3、6、9、12、18、24 h按“2.1”项色谱条件进行分析,测定峰面积,计算咖啡酸、迷迭香酸RSD为紫苏叶0.81%、1.11%,荆芥0.76%、0.95%。表明紫苏叶、荆芥供试品溶液在24 h内稳定。
2.6 重复性试验
取供试品(紫苏叶批号140505;荆芥批号140504)0.5 g,按“2.2.1”项下供试品溶液制备方法制备,平行6份,按“2.1”项色谱条件进行分析,测定峰面积,计算咖啡酸、迷迭香酸质量分数RSD分别为紫苏叶1.86%、0.58%;荆芥1.93%、1.48%。
2.7 加样回收率试验
取已测定的紫苏叶样品6份(批号140505),荆芥样品6份(批号140504),分别精密加入一定量咖啡酸、迷迭香酸对照品,按“2.2.1”项下供试品溶液制备方法制备,按“2.1”项色谱条件进行分析,计算咖啡酸、迷迭香酸平均回收率分别为紫苏叶101.90%、105.60%,荆芥103.50%、101.02%;RSD分别为1.71%、1.92%、1.74%、1.90%。
2.8 样品测定
取紫苏叶40批,荆芥24批,按“2.2”项方法制备供试品溶液,按“2.1”色谱条件进行分析测定,计算,结果见表 1和2。由检测结果分析,紫苏叶中咖啡酸、迷迭香酸量存在较大差异,荆芥中咖啡酸、迷迭香酸量无明显差异。紫苏叶中咖啡酸以广西(野生)与广西(家种)的结果对比可见,野生量较家种量稍高;各产地比较可见广东产量较高,安徽产量较低;迷迭香酸以以广西(野生)与广西(家种)的结果对比可见,野生与家种无明显差异,各产地比较可见广东量最高,安徽产稍低;各成分同一产地之间亦存在一定差异。
表 1(Table 1)
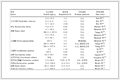
表 1 紫苏叶中2种成分的测定结果 (n = 3)
Table 1 Determination of two components in P. frutescens leaves (n = 3)
| 批号 | 产地 | 咖啡酸/% | 迷迭香酸/% | 批号 | 产地 | 咖啡酸/% | 迷迭香酸/% | | 140501 | 广东 | 0.054 | 1.596 | 140521 | 广西(家种) | 0.042 | 0.364 | | 140502 | 广东 | 0.046 | 1.002 | 140522 | 广西(家种) | 0.036 | 0.256 | | 140503 | 广东 | 0.044 | 0.763 | 140523 | 广西(家种) | 0.031 | 0.541 | | 140504 | 广东 | 0.043 | 0.462 | 140524 | 广西(家种) | 0.029 | 0.317 | | 140505 | 广东 | 0.048 | 0.563 | 140525 | 江苏 | 0.029 | 0.062 | | 140506 | 广东 | 0.046 | 0.862 | 140526 | 江苏 | 0.053 | 0.532 | | 140507 | 广东 | 0.051 | 1.163 | 140527 | 江苏 | 0.043 | 0.412 | | 140508 | 广东 | 0.043 | 0.662 | 140528 | 江苏 | 0.052 | 0.457 | | 140509 | 广西(野生) | 0.073 | 0.554 | 140529 | 江苏 | 0.038 | 0.369 | | 140510 | 广西(野生) | 0.057 | 0.497 | 140530 | 江苏 | 0.027 | 0.337 | | 140511 | 广西(野生) | 0.060 | 0.367 | 140531 | 江苏 | 0.041 | 0.518 | | 140512 | 广西(野生) | 0.055 | 0.455 | 140532 | 江苏 | 0.036 | 0.485 | | 140513 | 广西(野生) | 0.057 | 0.539 | 140533 | 安徽 | 0.029 | 0.194 | | 140514 | 广西(野生) | 0.061 | 0.418 | 140534 | 安徽 | 0.018 | 0.036 | | 140515 | 广西(野生) | 0.046 | 0.421 | 140535 | 安徽 | 0.033 | 0.299 | | 140516 | 广西(野生) | 0.031 | 0.067 | 140536 | 安徽 | 0.028 | 0.145 | | 140517 | 广西(家种) | 0.050 | 0.467 | 140537 | 安徽 | 0.031 | 0.237 | | 140518 | 广西(家种) | 0.036 | 0.543 | 140538 | 安徽 | 0.029 | 0.345 | | 140519 | 广西(家种) | 0.028 | 0.374 | 140539 | 安徽 | 0.025 | 0.198 | | 140520 | 广西(家种) | 0.041 | 0.219 | 140540 | 安徽 | 0.032 | 0.367 |
|
表 1 紫苏叶中2种成分的测定结果 (n = 3)
Table 1Determination of two components in P. frutescens leaves (n = 3) |
表 2(Table 2)

表 2 荆芥中2种成分的测定结果 (n = 3)
Table 2Determination of two components in S. tenuifolia (n = 3)
| 批号 | 产地 | 咖啡酸/% | 迷迭香酸/% | 批号 | 产地 | 咖啡酸/% | 迷迭香酸/% | | 140501 | 安徽 | 0.014 | 0.109 | 140513 | 江苏 | 0.017 | 0.135 | | 140502 | 安徽 | 0.018 | 0.068 | 140514 | 江苏 | 0.008 | 0.072 | | 140503 | 安徽 | 0.012 | 0.085 | 140515 | 江苏 | 0.014 | 0.073 | | 140504 | 安徽 | 0.009 | 0.076 | 140516 | 江苏 | 0.010 | 0.067 | | 140505 | 安徽 | 0.011 | 0.142 | 140517 | 河北 | 0.006 | 0.036 | | 140506 | 安徽 | 0.008 | 0.076 | 140518 | 河北 | 0.009 | 0.118 | | 140507 | 安徽 | 0.011 | 0.094 | 140519 | 河北 | 0.017 | 0.147 | | 140508 | 安徽 | 0.015 | 0.075 | 140520 | 河北 | 0.018 | 0.151 | | 140509 | 江苏 | 0.007 | 0.085 | 140521 | 河北 | 0.011 | 0.097 | | 140510 | 江苏 | 0.017 | 0.090 | 140522 | 河北 | 0.008 | 0.078 | | 140511 | 江苏 | 0.012 | 0.095 | 140523 | 河北 | 0.014 | 0.112 | | 140512 | 江苏 | 0.009 | 0.115 | 140524 | 河北 | 0.010 | 0.105 |
|
表 2 荆芥中2种成分的测定结果 (n = 3)
Table 2 Determination of two components in S. tenuifolia (n = 3) |
2.9 数据分析
将40批紫苏叶及24批荆芥检测所得数据使用SPSS软件以咖啡酸量、迷迭香酸量为变量,以产地为因子,进行方差分析,结果见表 3和4。由方差分析数据可见紫苏叶中咖啡酸的量在0.05水平下广东与安徽、广西(野生)与广西(家种)、广西(野生)与江苏、广西(野生)与安徽间存在显著性差异;迷迭香酸的量在0.05水平下广东与广西(野生)、广东与广西(家种)、广东与江苏、广东与安徽均存在显著差异。荆芥在0.05水平下咖啡酸、迷迭香酸量安徽、江苏、河北两两之间均无显著性差异。
表 3(Table 3)

表 3 不同产地紫苏叶咖啡酸和迷迭香酸量的方差分析结果
Table 3Variance analysis of cafferic acid and rosmarinic acid in P. frutescens leaves
| 因变量 | 产地(I) | 产地(J) | 均值差(I—J) | 标准误 | 显著性 | | 咖啡酸 | 广东 | 广西(野生) | -0.008 125 | 0.004 092 | 0.550 | | 广西(家种) | 0.010 250 | 0.171 | | 江苏 | 0.007 000 | 0.960 | | 安徽 | 0.018 750 | 0.001 | | 广西(野生) | 广西(家种) | 0.018 375 | 0.001 | | 江苏 | 0.015 125 | 0.007 | | 安徽 | 0.026 875 | 0.000 | | 广西(家种) | 江苏 | -0.003 250 | 1.000 | | 安徽 | 0.008 500 | 0.452 | | 江苏 | 安徽 | 0.011 750 | 0.069 | | 迷迭香酸 | 广东 | 广西(野生) | 0.419 375 | 0.090 999 | 0.001 | | 广西(家种) | 0.499 000 | 0.000 | | 江苏 | 0.450 125 | 0.000 | | 安徽 | 0.631 500 | 0.000 | | 广西(野生) | 广西(家种) | 0.079 625 | 1.000 | | 江苏 | 0.030 750 | 1.000 | | 安徽 | 0.212 125 | 0.256 | | 广西(家种) | 江苏 | -0.048 875 | 1.000 | | 安徽 | 0.132 500 | 1.000 | | 江苏 | 安徽 | 0.181 375 | 0.541 | *表示在0.05水平差异显著
* significant deference ai 0.05 statistical level |
|
表 3 不同产地紫苏叶咖啡酸和迷迭香酸量的方差分析结果
Table 3Variance analysis of cafferic acid and rosmarinic acid in P. frutescens leaves |
表 4(Table 4)

表 4 不同产地荆芥咖啡酸、迷迭香酸量的方差分析结果
Table 4Variance analysis of cafferic acid and rosmarinic acid in S. tenuifolia
| 因变量 | 产地(I) | 产地(J) | 均值差(I—J) | 标准误 | 显著性 | | 咖啡酸 | 安徽 | 江苏 | 0.000 500 | 0.001 930 | 1.000 | | 河北 | 0.000 625 | 1.000 | | 江苏 | 河北 | -0.000 500 | 1.000 | | 迷迭香酸 | 安徽 | 江苏 | -0.000 875 | 0.014 507 | 1.000 | | 河北 | -0.014 875 | 0.951 | | 江苏 | 河北 | 0.000 875 | 1.000 |
|
表 4 不同产地荆芥咖啡酸、迷迭香酸量的方差分析结果
Table 4Variance analysis of cafferic acid and rosmarinic acid in S. tenuifolia |
3 讨论
考察了超声、回流提取等提取方式,结果表明回流提取对咖啡酸和迷迭香酸的提取率较高,故选择回流提取。另对提取溶剂、提取溶剂浓度、提取溶剂体积、提取时间等因素进行了考察,最终确定条件为100倍50%甲醇提取60 min。另通过咖啡酸、迷迭香酸的全波长考察,确定检测波长为327 nm。
考察了乙腈-水、甲醇-水、乙腈-0.1%磷酸梯度洗脱,以乙腈-0.1%磷酸水溶液梯度洗脱时分离度及峰型最佳,故选择为流动相。另还分别优化了柱温(25、28、30、32、35、40 ℃)及体积流量(0.8、0.9、1.0、1.1、1.2 mL/min),结果以30~40 ℃,体积流量0.9~1.1 mL/min能够达到较好分离,故选择柱温30 ℃,体积流量1.0 mL/min。
在系统耐用性方面,进行了3个波长(325、327、329 nm),3个型号色谱柱(Phenomenex Luna C18、Phenomenex Gimini C18、Agilent C18),3台不同型号仪器(Agilent 1260、Waters 2695-2487、戴安U3000)的检测,考察其对检测结果的影响,结果RSD均小于5.0%,说明该方法耐用性良好。
从多批次的方差分析结果可以看出,紫苏叶中咖啡酸量广东产地与安徽产地差异显著,野生与家种差异显著;迷迭香酸量广东产地与广西、安徽、江苏无显著性差异,野生与家种无显著性差异,整体评价紫苏叶以广东产质量最好。安徽、江苏、河北产荆芥均无显著性差异。从多批的检验结果可以看出,紫苏叶、荆芥中迷迭香酸量均有较低的个案,故有必要对其进行质量控制。分析方法快速、灵敏、准确,所有待测组分峰分离度良好,可为紫苏叶、荆芥药材的质量评价提供依据。
参考文献
| [1] |
中国药典 [S]. 一部. 2010. |
| [2] |
杨 晴, 韩金玲, 刘艳芳, 等. 紫苏光合特性和生长发育动态研究 [J]. 中草药, 2014, 45(15): 2242-2247. |
| [3] |
夏 至, 李贺敏, 张红瑞, 等. 紫苏及其变种的分子鉴定和亲缘关系研究 [J]. 中草药, 2013, 44(8): 1027-1032. |
| [4] |
Gu L H , Wu T, Wang Z T. TLC bioautography-guided isolation of antioxidants from fruit of Porilla frutescens var. acuta [J]. LWT-Food Sci Technol, 2009, 42: 131-136. |
| [5] |
郭群群, 杜桂彩, 李荣贵, 等. 紫苏抗菌活性成分的研究 [J]. 高等学校化学学报, 2006, 27(7): 1292-1294. |
| [6] |
王永奇, 王 威, 梁文波, 等. 紫苏油抗过敏·炎症的研究 [J]. 中草药, 2001, 32(l): 83-85. |
| [7] |
林万里, 王振月, 张兰兰, 等. HPLC法同时测定土荆芥挥发油中驱蛔素、对伞花烃、α-萜品烯 [J]. 中草药, 2010, 41(12): 2085-2087. |
| [8] |
吴 婷, 丁安伟, 张 丽. 荆芥现代研究概况 [J]. 江苏中医药, 2004, 25(10): 64-67. |
| [9] |
李成文, 徐文瑞, 李学军, 等. 咖啡酸及其衍生物咖啡酸苯乙酯药理作用研究进展 [J]. 中国药学杂志, 2013, 48(8): 577-581. |
| [10] |
黄亮辉, 苏 琪, 张新新, 等. 不同采收期的紫苏叶和白苏叶中迷迭香酸的量测定 [J]. 药物分析杂志, 2012, 32(10): 1753-1755. |

 2015, Vol. 46
2015, Vol. 46


