2. 贵州昌昊中药发展有限公司, 贵州 凯里 556000
2. Guizhou Changhao Chinese Medicine Development Co., Ltd., Kaili 556000, China
何首乌为蓼科(Polygonaceae)植物何首乌Polygonum multiflorum Thunb. 的干燥块根。有生首乌和制首乌之分。生首乌苦泄性平兼发散,具有解毒消痈、润肠通便、截疟的功能。制首乌味甘厚性温,具有补肝肾,益精血、乌须发、强筋骨的作用[1]。现代研究表明,何首乌中主要含有二苯乙烯苷、蒽醌类及磷脂类等活性成分[2],其中二苯乙烯苷因具有抗衰老、降低胆固醇、提高免疫功能、防止动脉硬化、保护肝脏[3]等作用,故《中国药典》中将其作为何首乌定量的控制标准。何首乌主产于贵州、四川、云南、湖北、广东、广西、湖南、江苏、河南等地,规格等级复杂,加之采收时间、炮制加工、贮存等因素的制约,故在功效、作用上存在一定的差异,仅凭个别化学成分的量难以全面反映药材的质量,目前,有很多文献研究何首乌的指纹图谱,但是仍然存在共有峰数目较少、不能全面地评价何首乌的质量,缺乏对共有峰进行定性等问题。本实验以HPLC法建立何首乌的HPLC指纹图谱,并应用主成分分析对实验数据进行处理,同时采用HPLC/Q-TOF-MS和对照品对照对何首乌共有峰进行归属,用于全面评价何首乌的质量。
1 仪器与试药 1.1 仪器Agilent1290高效液相色谱仪,配1260 DAD检测器;Agilent1260高效液相色谱仪,配1260 DAD检测器;Waters2695高效液相色谱仪,配2998PDA检测器;Triple Q-TOF 5600质谱仪(AB公司),配备电喷雾离子源系统,岛津高效液相LC-20AD;电子天平AY220(0.1 mg,江苏省金坛市金城国胜实验仪器厂),DK-S22电热恒温水浴锅(上海精密实验设备有限公司)。
1.2 药材和试剂16批生何首乌药材Polygoni Multiflori Radix由贵州昌昊中药发展有限公司提供,产地见表 1。经南京中医药大学段金廒教授鉴定为蓼科植物何首乌Polygonum multiflorum Thunb. 的干燥块根。
| 表 1 样品来源 Table 1 Sources of samples |
二苯乙烯苷、大黄素甲醚、大黄素对照品购自中国食品药品检定研究院,批号分别为110844-201310、110758-201415、110756-200110;乙腈为色谱纯(美国Merck公司),甲醇为色谱纯(江苏汉邦公司),甲酸为色谱纯(美国ACS公司)。
2 方法与结果 2.1 色谱条件及质谱条件 2.1.1 色谱条件AgilentExtend C18(250 mm×4.6 mm,5 μm)色谱柱,检测波长280 nm;柱温30 ℃;体积流量1.0 mL/min;进样量10 μL,流动相为0.1%甲酸溶液(A)-乙腈(B);梯度洗脱条件为0~30 min,8%~30% A;30~55 min,30%~70% A;55~65 min,70%~80% A;65~70 min,80%~100% A;70~75 min,100% A;75~80 min,100%~8% A;80~85 min,8% A。
2.1.2 质谱条件采用TOF MS-IDA-MS/MS模式,ESI负离子模式,扫描范围m/z 100~1 200,喷雾电压4 500 eV,离子源温度500 ℃,气帘气(CUR N2)0.20 MPa,雾化器(GS1 N2)0.38 MPa,辅助气 0.38 MPa,去簇电压(DP)80 eV IDA条件下设置:碰撞电压(CE)35 eV,碰撞电压差(CES)15 eV,开启动态背景扣除。
2.2 对照品溶液的制备 2.2.1 二苯乙烯苷对照品溶液的制备精密称取二苯乙烯苷对照品11.85 mg,置50 mL量瓶中,加乙醇溶解并稀释至刻度,即得。
2.2.2 大黄素对照品溶液的制备精密称取大黄素对照品约8.25 mg,置100 mL量瓶中,加甲醇溶解并稀释至刻度,即得。
2.2.3 大黄素甲醚对照品溶液的制备精密称取大黄素甲醚对照品4.50 mg,置100 mL量瓶中,加甲醇溶解并稀释至刻度,即得。
2.3 供试品溶液的制备取本品粉末(过四号筛)约0.3 g,精密称定,置具塞锥形瓶中,精密加入75%甲醇30 mL,称定重量,加热回流45 min,放冷,再称定质量,用75%甲醇补足损失的质量,摇匀,静置,上清液滤过,取续滤液,即得。
2.4 方法学考察 2.4.1 稳定性试验取何首乌样品,按供试品溶液的制备方法制备,分别于0、2、4、8、12、16 h依法进行测定,考察色谱峰相似度的一致性,利用中药指纹图谱相似度评价系统研究版(2012)进行相似度评价。结果各共有峰相对保留时间及相对峰面积RSD均<3%,表明16 h内供试品溶液的成分是稳定的。
2.4.2 精密度试验取何首乌样品,按供试品溶液制备方法制备溶液,依法连续进样6次,利用中药指纹图谱相似度评价系统研究版(2012),进行相似度评价。结果各共有峰相对保留时间及相对峰面积RSD均<3%,表明仪器精密度良好。
2.4.3 重复性试验取何首乌样品,按供试品溶液制备方法平行制备供试品溶液6份,依法检测,利用中药指纹图谱相似度评价系统研究版(2012),进行相似度评价。结果各共有峰相对保留时间及相对峰面积RSD均<3%,表明重复性良好。
2.5 何首乌中二苯乙烯苷的测定取何首乌粉末0.2 g,按照《中国药典》2010年规定方法[1]测定16批何首乌中二苯乙烯苷量,其结果都达到了《中国药典》2010年版要求,结果见表 2。
| 表 2 16批何首乌中二苯乙烯苷量 Table 2 Content of 2,3,5,4’-tetrahydroxy stilbene-2-O-β-D-glucoside of 16 batches of samples |
取16批何首乌,按照“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件进行测定。
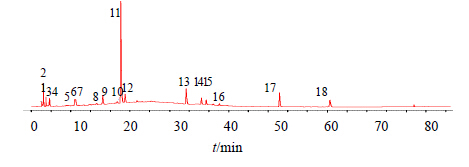
2.6.1 共有峰的确定根据16批何首乌药材高效液相分析,发现18个共有峰,构建了何首乌HPLC色谱图的特征指纹图谱,作为何首乌鉴别的依据,由于二苯乙烯苷在各批次何首乌中均有出现,分离度良好且峰面积较大,故选择二苯乙烯苷(11号峰)作为参照峰,共有峰相对保留时间、相对峰面积结果见表 3和4。
| 表 3 共有峰相对峰面积 Table 3 Relative peak areas of common peaks |
| 表 4 共有峰相对保留时间 Table 4 Relative peak areas of common peaks |
采用对照品对照和参考文献中的质谱一级、二级数据和色谱保留行为[4, 5, 6],共确定了11个共有峰代表的化学成分,其中11、17、18号峰采用对照品对照确定为二苯乙烯苷、大黄素、大黄素甲醚。4、6、9、12、13、14、15、16号峰通过质谱鉴定为没食子酸、儿茶素、2,3,5,4′-四羟基二苯乙烯-2,3-二-O-β-D-葡萄糖苷、polygonimitin B、大黄素-1-O-葡萄糖苷、大黄素-8-O-(6′-O-丙二酰)-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-(6′-O-丙二酰)-β-D-葡萄糖苷。结果见表 5。
| 表 5 共有峰的化学成分推测 Table 5 Speculation of chemical components of common peaks |
经实验得到16批何首乌指纹图谱,见图 1,将16批何首乌药材样品指纹图谱的AIA数据文件导入中药指纹图谱相似度评价系统研究版(2012),进行相似度计算,设置样品S7图谱为参照图谱,对照图谱生成方法采用中位数法,时间窗宽度为0.1,自动匹配,生成对照指纹图谱,见图 2,其相似度结果见表 6。
 | 图 1 16批何首乌指纹图谱Fig.1 HPLC-fingerprint of 16 batches of samples |
 |
11-二苯乙烯苷 17-大黄素 18-大黄素甲醚 11-2,3,5,4′-tetrahydroxy stilbene-2-O-β-D-glucoside 17-emodin 18-physcion 图 2 何首乌对照指纹图谱Fig.2 Reference-fingerprint for 16 batches of samples |
| 表 6 16批何首乌相似度计算结果 Table 6 Similarity of 16 batches of samples |
与16批何首乌生成的对照指纹图谱比较,各批的何首乌样品的相似度在0.936~0.998,表明各批何首乌样品的质量相对稳定,从图 1可以看出不同产地何首乌的化学成分基本一致,从共有峰面积RSD可以看出共有峰峰面积差异较大,表明各成分量有所差异。从表 6可以看出,样品S1、S4、S7、S8、S12相似度相对较低,其他样品相似度相对较高,其中样品S8相似度最低。
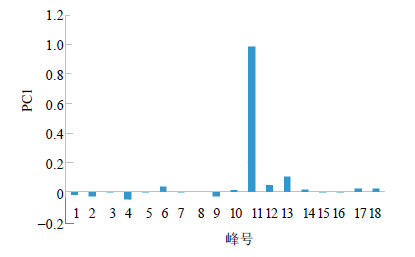
2.6.5 何首乌样品主成分分析为了更加合理地评价何首乌的品质,对何首乌共有峰峰面积主成分分析,将16批何首乌样品的共有峰面积导入MatlabR2014a中,运用zero-mean normalization处理方法进行数据前处理,然后进行主成分分析,分别对应于3个最大特征值的主成分PC1、PC2、PC3,从方差贡献率来看,PC1贡献率为70.3%,贡献率最大,包含的信息最多;PC2贡献率为15.7%,PC3贡献率为7.7%,前3个主成分的累计贡献率93.7%,所以对前3个主成分分析已经能反映何首乌的基本特征。分别以第1、第2、第3主成分建立坐标系,进行投影,得到16批样品的PCA得分图(图 3),同时对PC1进行载荷图分析(图 4)。用以反映不同样品间差异的主要元素。
 | 图 3 第1、2主成分投影图Fig.3 Projection drawing of PC1 and PC2 |
 | 图 4 第1主成分载荷图Fig.4 Loading diagram of PC1 |
根据图 4可知,对主成分PC1贡献最大的因素是11号峰。从第1、2主成分投影图可以看出除了样品S1、S7、S8、S12、S15、S16、S11、S14之外,其余样品聚集在一块,其中与其他药材的区别主要体现在第1主成分上,其中样品S1、S8、S12、S15、S16在第1主成分的得分上较低,样品S11、S14得分较高,得出结果与“2.5”项中得到的结果基本一致。
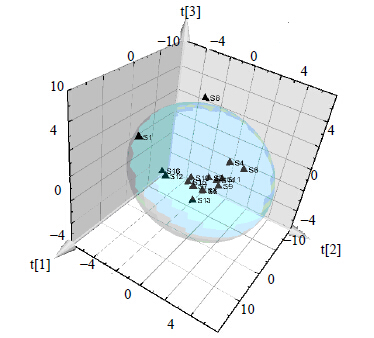
从三维得分图(图 5)可以看出样品S8为一类、S1、S7、S12为一类,其他为一类。分析结果和相似度分析结果一致。也进一步验证了所建指纹图谱的可靠性。
 | 图 5 何首乌第1、2、3主成分三维得分图Fig.5 3DDiagram of PC1,PC2,and PC3 scores of samples |
本实验对样品的提取溶剂、提取时间、提取方法进行了考察,最终确定了“2.3”项下供试品溶液的制备方法。同时对检测波长、色谱柱、流动相系统、梯度条件、柱温进行了优选,最终确定了最优的色谱条件[7, 8, 9, 10, 11]。同时本实验在指纹图谱的基础上创新性地采用了HPLC/Q-TOF/MS法对共有峰进行了归属,运用主成分分析、二苯乙烯苷测定对指纹图谱进行验证。
本实验确定了何首乌指纹图谱中的18个共有峰,并对部分共有峰进行定性分析,其中4、6、9、11、12、13、14、15、16、17、18号峰得出分别是没食子酸、儿茶素、2,3,5,4′-四羟基二苯乙烯-2,3-二-O-β-D-葡萄糖苷、二苯乙烯苷、polygonimitin B、大黄素-1-O-葡萄糖苷、大黄素-8-O-(6′-O-丙二酰)-β-D-葡萄糖苷、大黄素甲醚-8-O-β-D-葡萄糖苷、大黄素甲醚-8-O-(6′-O-丙二酰)-β-D-葡萄糖苷、大黄素、大黄素甲醚。
何首乌指纹图谱共有峰的保留时间差别较小,但峰面积有较大差异,说明不同批次的同一化学成分的量有所差别。不同批次的何首乌相似度0.936~0.998,表明不同产地的何首乌质量相对稳定,没有太大差异。本实验中峰面积RSD较大,但相似度较高,分析原因可能是二苯乙烯苷峰面积过大,从而导致相似度较高。
主成分分析结果可知,样品S1、S7、S12为一类,S8为一类,其他样品为一类,其分析结果与16批样品相似度结果基本一致,进一步验证了本实验的合理与准确性。对第1主成分进行载荷图分析,可以得出对此主成分贡献最大的峰为11号峰,即为二苯乙烯苷,样品S1、S8、S12、S15、S16在第一主成分的得分较低,样品S11、S14得分较高,与二苯乙烯苷的测定结果一致。同时二苯乙烯苷的量满足《中国药典》要求。
研究表明本实验建立的方法简便、可靠,可为综合评价何首乌质量提供指导和依据。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 朱铁英. 何首乌化学成分研究进展 [J]. 时珍国医国药, 2006, 17(2): 274-275. |
| [3] | 刘新桥, 高文远, 陈海霞. 何首乌中二苯乙烯苷提取物的制备工艺及量测定 [J]. 中国中药杂志, 2007, 32(14): 1474-1476. |
| [4] | Yi T, Leung K S, Lu G H. Identification and determination of the major constituents in traditional Chinese medicinal plant Polygonum multiflorum Thunb. by HPLC coupled with PAD and ESI/MS [J]. Phytochem Anal, 2007, 18(3): 181-187. |
| [5] | Zhao Y, Kao C P, Chang Y S. Quality assessment on Polygoni multiflori Caulis using HPLC/UV/MS combined with principle component analysis [J]. Chem Cent J, 2013, 7(1): 106-118. |
| [6] | Liu Z, Liu Y, Wang C. Comparative analyses of chromatographic fingerprints of the roots of Polygonum multiflorum Thunb. and their processed products using RRLC/DAD/ESI-MS(n) [J]. Planta Med, 2011, 77(16): 1855-1860. |
| [7] | 罗 文, 刘 斌, 王 伟, 等. 何首乌药材HPLC指纹图谱研究 [J]. 北京中医药大学学报, 2008, 31(8): 557-560. |
| [8] | 房志坚, 周洪波, 杨立伟, 等. 何首乌的HPLC指纹图谱 [J]. 华西药学杂志, 2008, 23(5): 513-515. |
| [9] | 梁永枢, 段 启, 方丽华, 等. 广东德庆何首乌药材HPLC指纹图谱方法学研究 [J]. 广东药学院学报, 2006, 22(3): 265-267. |
| [10] | 刘振丽, 李林福, 宋志前, 等. 何首乌炮制前后高效液相图谱的变化 [J]. 中草药, 2005, 36(11): 1644-1646. |
| [11] | 苏 建, 袁志芳, 吴一兵, 等. 何首乌和夜交藤药材指纹图谱研究与评价 [J]. 中草药, 2008, 39(5): 766-769. |
 2015, Vol. 46
2015, Vol. 46


