2. 山西大学化学化工学院, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China
黄芪是我国重要的大宗药材之一,使用历史已有2 000多年,始载于《神农本草经》,列为上品[1],可补益元气而脱毒,治一切气衰血虚之症[2]。《中国药典》2010年版规定的正品黄芪药材为豆科草本植物黄芪属蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪A. membranaceus (Fisch.) Bge. 的干燥根。
传统的野生黄芪主要是指生长年限在5年以上、自然繁殖或人工播种后自然生长的蒙古黄芪或膜荚黄芪。野生的蒙古黄芪主要分布在山西、内蒙古、甘肃、陕西等省,其中山西和内蒙古产的5~8年生的蒙古黄芪为道地药材,具有“主根粗长、少分支、绵性大、粉性强、甜味足、豆腥味浓”等特点[3]。野生膜荚黄芪主产区为黑龙江、吉林,生长年限在6年以上,商品量极小。速生黄芪主要是指生长年限在1~3年、人工栽培的蒙古黄芪或膜荚黄芪。生长2~3年的速生黄芪主要分布在甘肃、宁夏、内蒙古等省,以蒙古黄芪为主;河北、山东也有栽培1年即采收上市的膜荚黄芪。这种速生黄芪外观与野生黄芪有较大差别,呈现“主根短,分枝多,质坚硬,鸡爪形,微甜而淡”等特征[4, 5, 6]。
作为评价黄芪质量的标准,《中国药典》2010年版规定黄芪甲苷量不得小于0.04%[7]。姜勇等[8, 9, 10]通过对不同生长方式、不同年限、不同等级规格的黄芪样品进行测定发现:随着黄芪生长年限增加、等级增高,黄芪甲苷量呈下降趋势,且速生黄芪的量高于野生品和半野生品。这表明在目前的黄芪品质评价指标分析下,速生黄芪的品质不亚于野生传统黄芪。然而,国际市场并不接受速生黄芪,国内的一些老中医也仍然使用野生传统黄芪,这些矛盾说明目前的质量评价不能够全面准确地评价黄芪品质。因此建立更加合理的评价指标,对于保护和发展道地黄芪具有重要意义。
传统中医认为,黄芪是“补气”良药,用于一切气血不足之症[1, 2, 6]。临床研究表明,黄芪可以显著提高机体免疫力,具有消炎、抗癌、抗病毒等多种活性[11]。诸多研究证明,糖类成分是黄芪发挥免疫调节作用的主要物质基础,不同的糖类物质具有不同的免疫调节活性[12, 13]。因此,糖类成分应该作为黄芪质量控制与品质评价的标准。目前研究者多利用紫外分光光度法测定总多糖量作为药材品质评价的指标,然而该指标缺乏专属性特征,限制了《中国药典》对这一标准的收载。
利用不同专一性的多肽水解酶成功建立的肽指纹图谱技术,使大分子蛋白质结构解析产生了革命性的飞跃[14, 15]。与肽谱研究方法类似,糖指纹图谱技术是基于糖类化合物水解技术的发展而形成的分析方法,主要针对细胞质内的可溶性单糖、寡糖、多糖和糖缀合物(糖脂、糖蛋白等)进行考察[16, 17, 18, 19]。根据糖类化合物在不同溶剂中溶解性的差异,对可溶性糖类组分进行分级提取。对提取的糖类化合物进行酶水解或酸水解,获得糖指纹图谱后对不同药材的图谱进行比较,结合数据主成分分析等方法,即可反映药材的专属性特征。在该技术中,糖类化合物的水解技术是关键。酶水解方法专一性强,可同时鉴定被水解糖化合物中单糖的种类和连接位点[16, 17],然而由于糖结构的复杂性,该方法所用的水解酶多达10种以上,国外进口居多,价格昂贵,而且不同水解酶要求的水解条件不同,操作复杂。酸水解方法主要是基于三氟乙酸水解糖类化合物,利用GC-MS分析技术,形成不同的水解产物单糖谱图[18]。该方法不仅可以定量分析单糖的种类和量,而且操作简便,专属性强,实验成本低。Guan等[18]通过酸水解的糖指纹图谱技术发现了不同生长方式下(野生和栽培)冬虫夏草的差异,Wu等[19]通过酸水解糖指纹图谱技术区分了12种不同灵芝属药材。这些发现为以糖类化合物为主要活性物质的中药材质量评价标准的研究提供了思路和方法。
因此,本实验拟选用24批不同生长方式的黄芪药材为研究对象,分级提取黄芪内各种糖类组分,然后采用三氟乙酸水解,水解产物乙酰化,GC-MS分析乙酰化产物获得一系列糖指纹图谱。通过对黄芪糖指纹图谱的定量分析,找出野生黄芪、速生黄芪中糖类成分的差异,结合数据主成分分析(PCA)等方法,找出鉴别指标,为不同生长方式黄芪糖类质量控制指标的筛选,中药材种质资源的鉴别与评价提供参考。
1 材料与方法 1.1 材料本实验所需植物材料包括蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao和膜荚黄芪A. membranaceus (Fisch.) Bge. 2个种的野生黄芪和速生黄芪,药材均由山西大学秦雪梅教授鉴定,见表 1。
| 表 1 黄芪样本信息 Table 1 Information of Astragali Radix |
气相色谱-质谱联用仪(Thermo Finnigan离子阱GC/MS);(ZD-A1L)真空冷冻干燥仪;RE-52A真空旋转蒸发仪;TGL-16型高速冷冻离心机(宁波新芝科技有限公司);SHK-99-II型台式恒温摇床等,三氟乙酸(TFA)、二甲基亚砜(DMSO)、1-甲基咪唑、乙酸酐、二氯甲烷、硼氢化钠、均为分析纯。葡萄糖、半乳糖、甘露糖、果糖、木糖、阿拉伯糖、岩藻糖、鼠李糖、山梨醇、半乳糖醇、甘露醇、木糖醇、阿拉伯糖醇、岩藻糖醇、鼠李糖醇、肌醇、核糖醇标准品均购自Sigma公司。
1.3 GC-MS检测条件GC条件:DB-5毛细管柱(30 m×0.5 mm,0.25 μm);载气:高纯氦;体积流量1.0 mL/min;分流比10∶1;进样口温度220 ℃;程序升温:起始温度100 ℃,5 ℃/min升至180 ℃,保持1 min,1 ℃/min升至190 ℃,保持2 min,30 ℃/min升至220 ℃,保持2 min,1 ℃/min升至230 ℃,保持2 min,20 ℃/min升至280 ℃,保持10 min。
MS条件:Xcalibur 2.0.7工作站,电子轰击离子源,离子源温度220 ℃,传输线温度250 ℃,扫描模式Full Scan;质量扫描范围m/z 45~550。
1.4 黄芪中游离糖、多糖和糖缀合物的分级提取和TFA水解参考文献方法[18],黄芪粉碎后过100目筛,取黄芪细粉约50 mg,精密称定后置于5 mL玻璃离心管中,加70%的乙醇溶液(料液比1∶100),100 ℃震荡提取1 h,降至室温后离心,取上清液加入2 mol/L的TFA溶液1 mL,置于10 mL安瓿瓶中混合均匀;密封后于110 ℃水解1 h,冷却后浓缩至干。加2 mL甲醇复溶后用N2吹干,重复3次除去残余的TFA。最后将水解产物溶于1 mL的0.1 mg/mL的内标核糖醇溶液中,备用。
离心所得残渣再加水(料液比1∶80),100 ℃震荡提取3 h,离心取上清液,重复提取,合并2次上清液,相同方法处理得水解产物,溶于1 mL的0.1 mg/mL的核糖醇溶液中,备用。
1.5 单糖及糖醇标准品乙酰化产物的制备与检测参照文献衍生化方法[20],分别称取8种单糖及对应的糖醇标准品,溶于0.1 mg/mL的核糖醇-二甲基亚砜溶液中。以1-甲基咪唑为催化剂,乙酸酐为乙酰化试剂,衍生化反应10 min。取蒸馏水终止反应,二氯甲烷萃取2次,合并有机相,吹干后,复溶于二氯甲烷中,0.22 μm有机滤膜滤过,取1 μL滤液注入GC-MS,得到单糖及糖醇标准品的GC-MS色谱图。以核糖醇为内标(IS),分别进样0.01、0.1、0.5、1、5 μL,分别求算核糖醇的标准曲线(lgms=a lgAs+b)及各标准品与核糖醇的相对校正因子。
f=miAs/msAi
mi、ms分别表示待测糖和内标的质量,Ai、As分别表示待测糖和内标的峰面积,f表示待测糖和内标的相对校正因子 1.6 黄芪中游离糖、多糖和糖缀合物水解产物的乙酰化产物制备与检测分别移取“1.4”项中游离糖、多糖和糖缀合物的水解液,按“1.5”项方法进行衍生化后,复溶于二氯甲烷中,0.22 μm有机滤膜滤过,取1 μL滤液注入GC-MS。根据单糖及糖醇标准品的GC-MS色谱图进行指认,根据下列公式对样本中的糖类化合物进行定量分析。
mi=f(Ai×ms)/As
1.7 数据分析使用SIMCA-P 13.0软件对糖指纹图谱进行PCA分析;运用SPSS 16.0软件对游离糖、多糖和糖缀合物中单糖的种类及量进行聚类分析。
2 结果与分析 2.1 单糖及糖醇的GC-MS检测17种单糖及糖醇标准品乙酰化产物的总离子流色谱图如图 1所示,测定结果显示(表 2),核糖醇的标准方程为lgms=7×[lg(1.2 As)+lg2.4],线性良好(R2=0.992 1)。由表 2可知,17种糖类标准品乙酰化产物的空白回收率在91.11%~99.04%,RSD均小于5%。
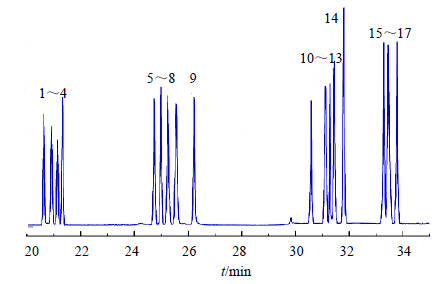 | 1~17-表 1中的成分 1—17-same as Table 1 图 1 单糖标准品的总离子流色谱图Fig.1 Total iorn currentchromatograms of mixed monosaccharide standards |
| 表 2 单糖及糖醇标准品的测定 Table 2 Determination of standard monosaccharides and alditols |
黄芪中的可溶性糖包括单糖、糖醇、双糖、寡糖、多糖和糖缀合物等,由于单糖、糖醇、双糖、寡糖等游离糖在70%乙醇溶液可较好溶解,因此先用70%乙醇溶液中提取游离糖(包括黄酮苷类和皂苷类成分)进行TFA水解,将水解产物乙酰化处理后注入GC-MS检测,得到游离糖的单糖指纹图谱(图 2-A),结果见表 3。黄芪中游离糖的单糖组成主要包括5种,分别为葡萄糖、果糖、肌醇、山梨醇和半乳糖醇。其中葡萄糖和果糖的量明显高于另外3种糖成分。此外,野生黄芪中游离糖的总量及各单糖的量均明显高于速生黄芪的量。
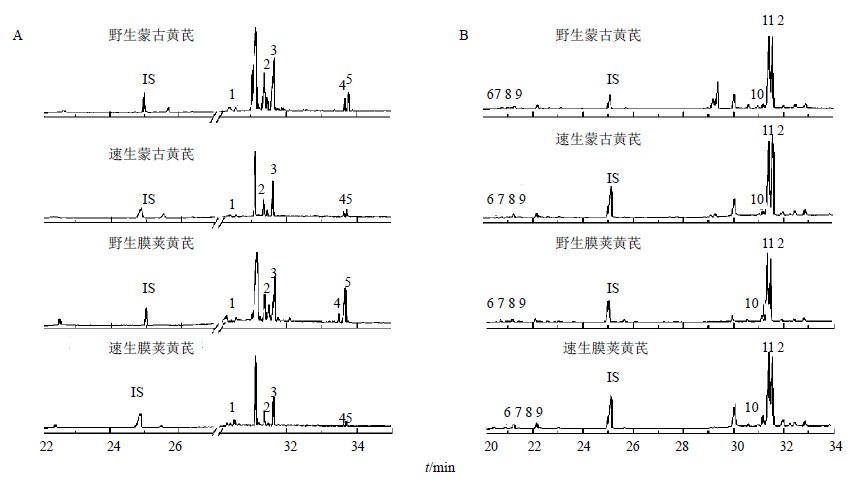 | 1~11分别代表果糖、葡萄糖、肌醇、山梨醇、半乳糖醇、木糖、岩藻糖、鼠李糖、阿拉伯糖、半乳糖和甘露糖 1—11-fructose, glucose, inositol, sorbitol, galactitol, xylose, fucose, rhamnose, arabinose, galactose, mannose 图 2黄芪样本中游离糖 (A) 和糖缀合物 (B) 的指纹图谱Fig.2 Monosaccharides fingerprint of free (A) and conjugate (B) carbohydrates in Astragali Radix samples |
| 表 3 黄芪中游离糖、多糖和糖缀合物的测定 Table 3 Determination of free,polysaccharides,and conjugate carbohydrates from Astragali Radix |
多糖和糖缀合物在70%乙醇溶液中易形成沉淀,但易溶于水,因此将提取游离糖之后的残渣用水提取,可以得到多糖和糖缀合物[18]。将糖和糖缀合物水解、乙酰化处理后注入GC-MS检测,得到多糖和糖缀合物的单糖指纹图谱(图 2-B),计算结果见表 3。黄芪中多糖和糖缀合物主要含7种单糖成分:木糖、岩藻糖、鼠李糖、阿拉伯糖、半乳糖、甘露糖和葡萄糖。已有报道黄芪多糖主要由甘露糖、半乳糖、阿拉伯糖和葡萄糖构成,此外还含有鼠李糖、岩藻糖、木糖,且可检测到少量的核糖,检测结果与报道基本一致[21]。此外野生黄芪中多糖和糖缀合物的糖类组分的量普遍高于速生黄芪,但样本之间,不同单糖的量差异较大。
2.4 黄芪可溶性单糖指纹图谱的PCAPCA的得分散点图能直观地显示不同样品之间的整体差异,反映数据的原始状态,观察到试验样品的自然分布和组别关系,但不能忽略组内误差,消除与研究目的无关的随机误差[22]。为了保留数据的整体特征与变化规律,确定不同栽培方式黄芪之间的化学差异成分,可以采用有监督的PLS-DA分析对数据进行进一步分析[23]。
将黄芪中游离糖、多糖和糖缀合物的单糖指纹图谱结果相结合进行主成分分析,结果如图 3所示。由PCA(图 3-A)可知,速生黄芪与野生黄芪可以得到较好的分离,蒙古黄芪与膜荚黄芪的分离现象不明显,进行有监督的PLS-DA分析(图 3-B)发现,4组黄芪均能得到较好地分离结果,模型参数为R2=71%,Q2=78.6%。用外部模型验证方法排列实验来证明模型的有效性(图 3-C),蓝色的回归线纵轴相交并处于零点以下,左端任何一次随机排列产生的R2、Q2均小于右端,且2条回归线斜率较大,最右端的2个值差距较小。图 3-C说明原始模型的预测能力大于任何一次随机排列y变量的预测能力,证明上述模型有效,可以继续后面差异成分的寻找。分别分析2种不同分组方法得到的黄芪代谢差异物,由VIP值(图 3-D)可知,使野生黄芪与速生黄芪分开的主要成分为阿拉伯糖、葡萄糖、木糖和甘露糖等,使蒙古黄芪与膜荚黄芪分开的主要成分为阿拉伯糖、葡萄糖、甘露糖和木糖等。
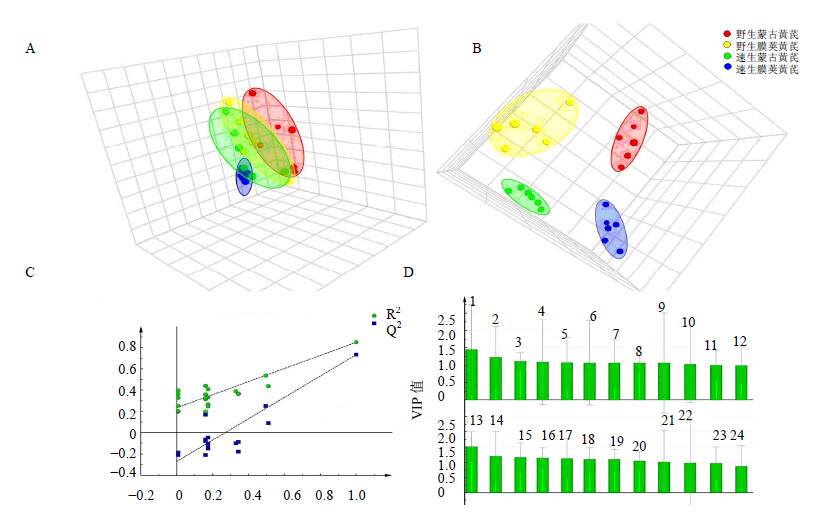 | 1、13-阿拉伯糖 2、6、14、20-葡萄糖 3、16-木糖 4、15-甘露糖 5、21-鼠李糖 7、19-果糖 8、24-山梨醇 9、22-半乳糖 10、23-肌醇 11、18-半乳糖醇 12、17-岩藻糖 1,13- arabinose 2,6,14,20-glucose 3,16-xylose 4,15-mannose 5,21-rhamnose 7,19-fructose 8,24-sorbitol 9,22-galactose 10,23-inositol 11,18-galactitol 12,17-fucose 图 3 黄芪样本单糖指纹图谱的PCA (A)、PLS-DA (B)、排列 (C) 和VIP值 (D)Fig.3 PCA (A) and PLS-DA (B) scores plots,permutations (C) and VIP-plots (D) of Astragali Radix samples |
以阿拉伯糖的物质的量为1,求葡萄糖、甘露糖和木糖的物质的量比,结果如表 4所示。木糖与拉伯糖的物质的量比值较小;甘露糖和葡萄糖的物质的量之比是阿拉伯糖的0.8~10.1倍,且速生黄芪中甘露糖:阿拉伯糖的比值>3.5∶1,葡萄糖-阿拉伯糖的比值>4∶1,野生黄芪中甘露糖-阿拉伯糖的比值<3.5∶1,葡萄糖-阿拉伯糖的比值<4∶1,但蒙古黄芪和膜荚黄芪未得到规律性分析结果。由此推测,测定黄芪中可溶性的甘露糖、葡萄糖和阿拉伯糖,求算其摩尔比值,可用于判断黄芪的栽培方式。
| 表 4 野生黄芪和速生黄芪中差异性糖类组分的物质的量比 Table 4 Molar ratio of compositional sugar of different metabolites in natural and cultured Astragali Radix |
将黄芪中游离糖与糖缀合物的单糖指纹图谱结果相结合,数据标准化后导入SPSS 16.0进行聚类分析,结果如图 4所示。由图可知,根据黄芪的可溶性单糖指纹图谱可以很好地区分野生黄芪与速生黄芪,与PCA结果一致。
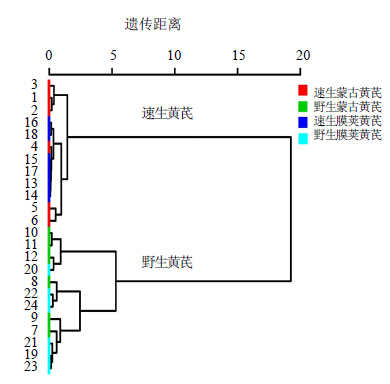 | 图 4 不同栽培方式、不同种属黄芪样本单糖指纹图谱的聚类分析Fig.4 Hierarchical cluster analysis on carbohydrates in Astragali Radix samples from different cultivations and species based on monosaccharides fingerprint |
在本研究中,野生黄芪选自道地产区山西浑源等地,这些地方多是土质疏松的半坡环境,夏季日照充足,干旱少雨,昼夜温差大,冬季寒冷,野生黄芪在此环境中生长多达5年以上。速生黄芪则是农户选择肥沃土地,经移栽施肥生长2年后采收。相比之下,野生黄芪受到了更多干旱、低温、营养缺乏等环境胁迫,而速生黄芪较少受到逆境的影响。大量研究表明,植物通常以细胞和整个生物有机体抵抗胁迫。逆境下,植物会在形态结构、生理生化、渗透调节、植物激素水平、膜保护物质及活性氧平衡、逆境蛋白等诸多环节发生变化,涉及到植物水分、光合、呼吸、物质代谢等多项生理过程[24, 25, 26, 27, 28]。已有研究报道,细胞质中游离糖及糖醇成分是植物受到生长胁迫而诱导产生的小分子物质,这些物质在细胞中大量积累,调节细胞渗透压,有利于植物保持水分,抵抗盐碱、低温等多种逆境,对维持植物的正常生理功能具有重要作用[24]。因此,在环境影响下,野生黄芪比速生黄芪经受更多的胁迫因素,野生黄芪中的游离糖量远远高于速生黄芪。
此外,由于速生黄芪生长环境较好、营养充足、光合作用形成的糖类物质优先用于植株生长,如细胞骨架的构建,特别是细胞壁中纤维素、半纤维素和果胶等物质的合成;而野生黄芪生长环境恶劣、生长周期长,吸收的能源物质则更多的用于贮存能量,抵抗不良环境,如淀粉、防御类次级代谢产物的合成。这就解释了为什么野生黄芪具有“绵性大、粉性强、甜味足、豆腥味浓”,而速生黄芪具有“质坚硬,微甜而淡”的特点。
3.2 多糖和糖缀合物的量对黄芪生理状态的影响植物胞质中的多糖和糖缀合物种类繁多,包括糖蛋白、肽聚糖、蛋白聚糖、糖酯等多种大分子物质。除作为植物细胞内贮能物质外,这些糖类化合物在植物种子萌发、幼苗生长、生殖和逆境应激等生命过程中均起重要的作用[27, 28, 29, 30]。比如富含羟脯氨酸糖蛋白与植物诱抗有关,富含阿拉伯半乳糖蛋白在被子植物受精过程中起重要作用。此外,糖蛋白可以作为植物逆境时的信号传导物质,当植物受到外界生物或非生物胁迫时,在病原菌与植物的互作过程中,一系列的糖基水解酶活力被激活,植物细胞壁上的蛋白聚糖被降解为小分子的糖蛋白,而极微量的糖蛋白就可以激发植物产生强烈的抗病反应。在本研究中,野生黄芪中含有的多糖和糖缀合物量同样比速生黄芪量高,推测依然可能是由于野生黄芪面临较复杂的生存环境所致。
4 结论本实验通过测定24批不同生长方式黄芪样品中游离糖、多糖和糖缀合物中的单糖组成,发现这些化合物中糖类成分主要由葡萄糖、果糖、肌醇、山梨醇、半乳糖醇、木糖、岩藻糖、鼠李糖、阿拉伯糖、半乳糖和甘露糖构成。统计结果显示:野生黄芪中糖量普遍高于速生黄芪。推测造成该现象的原因,可能是由于野生黄芪受到更多的环境胁迫,运用自身防御机制诱导产生细胞及分子水平的不同层次反应,形成不同结构的糖类化合物用于信号传导、渗透调节等生理活动以降低逆境胁迫对机体的损害。
对黄芪的单糖指纹谱图进行PCA发现,野生黄芪与速生黄芪有很好的分离结果,寻找其差异成分主要为阿拉伯糖、葡萄糖、甘露糖和木糖。以阿拉伯糖的物质的量为1,求葡萄糖、甘露糖和木糖的物质的量比,发现速生黄芪中甘露糖-阿拉伯糖的比值>3.5∶1,葡萄糖-阿拉伯糖的比值>4∶1,野生黄芪中甘露糖:阿拉伯糖的比值<3.5∶1,葡萄糖-阿拉伯糖的比值<4∶1。因此测定黄芪中可溶性的甘露糖、葡萄糖和阿拉伯糖,求算其物质的量比值,即可判断黄芪的栽培方式。上述结果经过聚类分析验证。
本实验利用单糖指纹图谱技术,找出了野生黄芪与速生黄芪胞质中糖类化合物单糖组成与量上的差异,并发现了导致野生黄芪与速生黄芪差异的单糖比例,这为不同生长方式黄芪的鉴别提供了依据,同时也为以糖类化合物为主要活性物质的中药材品质评价提供了思路和方法。
| [1] | Chu C, Qi L W, Liu E H, et al. Radix Astragali (Astragalus): latest advancements and trends in chemistry, analysis, pharmacology and pharmacokinetics [J]. Cur Org Chem, 2010, 14: 1792-1807. |
| [2] | Sinclair S N D L. Ac. Chinese herbs: a clinical review of Astragalus, Ligusticum, and Schizandrae [J]. Altern Med Rev, 1998(3): 338-344. |
| [3] | 胡明勋, 陈安家, 郭宝林, 等. 影响山西恒山野生蒙古黄芪质量的环境因素研究 [J]. 中草药, 2012, 43(5): 984-989. |
| [4] | 杨庆珍, 刘德旺, 王冬梅, 等. 黄芪生态型与品质的相关性研究 [J]. 中草药, 2014, 45(16): 2395-2399. |
| [5] | 赵一之. 黄芪植物来源及其产地分布研究 [J]. 中草药, 2004, 35(10): 1189-1190. |
| [6] | 陈有根, 辛敏通, 杨 滨. 野生与栽培黄芪中毛蕊异黄酮苷的测定 [J]. 中草药, 2009, 40(9): 1484-1485. |
| [7] | 中国药典 [S]. 一部. 2010. |
| [8] | 姜 勇, 金 芳, 鲍 忠, 等. 不同来源黄芪药材中黄芪甲苷的定量分析 [J]. 中国中药杂志, 2006, 31(11): 930-933. |
| [9] | 石子仪, 鲍 忠, 姜 勇, 等. 不同来源黄芪药材中毛蕊异黄酮葡萄糖苷和芒柄花素的定量分析 [J]. 中国中药杂志, 2007, 32(9): 779-783. |
| [10] | 胡海云, 王伟华, 段 启, 等. HPLC-ELSD法测定不同产地黄芪中黄芪甲苷 [J]. 中草药, 2006, 37(12): 1886-1888. |
| [11] | He X J, Niu X Y, Li J, et al. Immunomodulatory activities of five clinically used Chinese herbal polysaccharides [J]. J Exp Integr Med, 2012, 2(1): 15-27. |
| [12] | Zhao L H, Ma Z X, Zhu J, et al. Characterization of polysaccharide from Astragalus radix as the macrophage stimulator [J]. Cell Immunol, 2011, 271: 329-334. |
| [13] | Lu C, He X J, Xiao C, et al. Astragalus polysaccharides induced gene expression profiling of intraepithelial lymphocytes in immune-suppressed mice [J]. J Med Plants Res, 2012, 6(11): 2230-2239. |
| [14] | Chong H, Lee H, Park Z Y. Detection of multiphosphorylated peptides in LC-MS/MS analysis under low pH conditions [J]. Anal Chem, 2008, 80: 3007-3015. |
| [15] | Bondarenko P V, Chelius D, Shaler T A. Identification and relative quantitation of protein mixtures by enzymatic digestion followed by capillary reversed-phase liquid chromatography-tandem mass spectrometry [J]. Anal Chem, 2002, 74: 4741-4749. |
| [16] | Guan J, Li S P. Discrimination of polysaccharides from traditional Chinese medicines using saccharide mapping-enzymatic digestion followed by chromato-graphic analysis [J]. J Pharm Biom Anal, 2010, 51: 590-598. |
| [17] | Guan J, Zhao J, Feng K, et al. Comparison and characterization of polysaccharides from natural and cultured Cordyceps using saccharide mapping [J]. Anal Bioanal Chem, 2011, 399: 3465-3474. |
| [18] | Guan J, Yang F Q, Li S P. Evaluation of Carbohydrates in natural and cultured Cordyceps by pressurized liquid extraction and gas chromatography coupled with mass spectrometry [J]. Molecules, 2010, 15(6): 4227-4241. |
| [19] | Wu D T, Cheong K L, Wang L Y, et al. Characterization and discrimination of polysaccharides from different species of Cordyceps using saccharide mapping based on PACE and HPTLC [J]. Carbohydr Polym, 2014, 103: 100-109. |
| [20] | Li K, Liu S, Tan Y, et al. An optimized GC-MS method to simultaneously quantify acetylated aldose, ketose and alditol for plant tissues based on derivatization in methyl sulfoxide/1 methylimidazole system [J]. J Agric Food Chem, 2013, 61: 4011-4018. |
| [21] | 陈艳蕊, 毛欣月, 金文闻, 等. 黄芪多糖结构及其单糖组成的气相色谱-质谱研究 [J]. 现代生物医学进展, 2011, 23(11): 4632-4635. |
| [22] | 阿基业. 代谢组学数据处理方法-主成分分析 [J]. 中国临床药理学与治疗学, 2010, 15(5): 481-489. |
| [23] | 田 栋, 李震宇, 范圣此. 基于NMR代谢组学技术的不同产地黄芪水溶性浸出物化学组成分析 [J]. 药学学报, 2014, 49(1): 89-94. |
| [24] | 蔡孟深, 李中军. 糖化学 [M]. 北京: 化学工业出版社, 2006. |
| [25] | Morcuende R, Krappe A, Hhrry V, et al. Sucrose feeding leads to increased rates of nitrate assimilation, increased rates of α-oxoglutarate synthesis, and increased synthesis of a wide spectrum of amino acids in tobacco leaves [J]. Plants, 1998, 206: 394-409. |
| [26] | Koch K E, Ying Z, Wu Y, et al. Multiple paths of sugar-sensing and a sugar/oxygen overlap for genes of sucrose and ethanol metabolism [J]. J Exp Bot, 2000, 51: 417-427. |
| [27] | 布坎南, 格鲁依森姆, 琼斯. 植物生物化学与分子生物学 [M]. 北京: 科学出版社, 2004. |
| [28] | 苏文华, 张光飞, 李秀华, 等. 植物药材次生代谢产物的积累与环境的关系 [J]. 中草药, 2005, 36(9): 1415-1418. |
| [29] | 吴 梅, 谭 睿. 黄芪多糖研究进展 [J]. 川北医学院学报, 2013, 28(1): 17-22. |
| [30] | 王克夷. 糖类的生物学意义 [J]. 生命的化学, 2009, 29(2): 162-168. |
 2015, Vol. 46
2015, Vol. 46


