2. 江苏康缘药业股份有限公司, 江苏 连云港 222001;
3. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. Jiangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China;
3. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
中药生产是个十分复杂的动态过程,存在大量高度相关的过程变量,如温度、压力、流量、液位等,对这些过程变量进行及时监测和预报十分重要,因为它们一旦失控,将直接影响产品质量的均一和稳定[1]。传统质量控制方法直接对成品进行检测,一旦不合格,直接舍弃,这样易造成资源的浪费,极大地增加了生产成本[2]。因此,亟需一种有效的监测手段,对产品中间体进行过程分析,设定批放行标准,达到标准,实行产品放行,达不到标准,迅速查找故障原因,尽早采取相应措施,减少不合格产品的产生。
近红外光谱(near-infrared spectroscopy,NIRS)凭借其绿色、快速、无损、多组分同时测定的优势,已成为制药、农业、食品等工业过程在线监测分析的有力工具[3, 4, 5, 6, 7, 8]。多元统计过程控制(multivariate statistical process control,MSPC)利用正常生产状态下的过程变量信息建立多元控制模型,将高维过程变量映射到由少量隐变量定义的低维空间中去,计算各时间点的统计量,建立控制图,监控生产过程相对于模型的偏离程度,从而实现对生产过程进行评价和分析[9]。当过程出现异常波动和故障,在多元统计控制图上表现为超出控制限的异常点[10]。将NIRS分析技术与多元统计过程控制相结合,不仅可以实时获取分析对象的整体信息,而且可以对其内在质量变化进行评估,判断生产过程的变动情况[11, 12]。
本实验以热毒宁注射液栀子中间体纯化工艺为载体,分别建立关键质控指标成分山栀苷(SZS)、京尼平苷酸(GA)、去乙酰车叶草酸甲酯(DAAME)、京尼平龙胆双糖苷(GG)、栀子苷(GS)、绿原酸(CA)和总酸(TA)的定量放行标准和基于NIRS信息的定性放行标准。然后用Box-Behnken实验制备不同工艺条件下的栀子中间体纯化溶液进行放行标准验证,以判断建立的定量和定性放行标准的可行性。
1 仪器与材料Agilent 1290超高效液相色谱仪,美国安捷伦科技有限公司;Luminar 5030型AOTF近红外光谱分析仪,美国Brimrose公司;H1650-W台式高速离心机,湖南湘仪实验室仪器开发有限公司;D2015W电动搅拌器,上海梅颖浦仪器仪表制造有限公司;HWS26型电热恒温水浴锅,上海一恒科技有限公司;实验室pH计,梅特勒-托利多仪器有限公司;Milli-Q Academic纯水机,美国Millipore公司。
对照品DAAME(批号111786-200801,质量分数>98%)和GS(批号110749-201115,质量分数>98%)均购自中国食品药品检定研究院;对照品SZS(批号BBP01688,质量分数>98%)购自云南西力生物技术有限公司;对照品CA(批号MUST- 13031401,质量分数>98%)和GA(批号MUST- 13121502,质量分数>98%),均购自成都曼思特生物科技有限公司;对照品GG(批号131120,质量分数>98%),购自成都普菲德生物技术有限公司。乙腈,色谱纯,Tedia公司;水为超纯水;48批栀子中间体纯化溶液(批号分别为Z140301~Z140316、Z140401~Z140416、Z140501~Z140516)和栀子浓缩液(批号为Z140601)均来自江苏康缘药业股份有限公司生产车间。
2 方法与结果 2.1 样品制备取栀子浓缩液于洁净烧杯中,90 ℃水浴加热,用盐酸调节药液pH值,以一定转速搅拌1 h,取出,冷却至室温,冷藏,取上清液,即得栀子中间体纯化液。用Design expert 7.0软件设计3因素3水平的Box-Behnken实验制备17批栀子中间体纯化溶液作为验证集。因素水平及实验安排见表 1。其中,第1、5、9、16、17批按照热毒宁注射液生产过程中栀子中间体纯化工艺条件(pH值为3.0,搅拌转速150 r/min,冷藏时间30 h)制备,记为正常操作工艺(normal operating conditions,NOC)批次样本。Box-Behnken实验显示影响因素pH值对CA、SZS、GA、DAAME、GG、GS和TA量的P值均小于0.05,而搅拌转速和冷藏时间对上述各成分量的P值均大于0.05,说明pH值对各成分量的影响较为显著,而搅拌转速和冷藏时间对各成分量的影响不显著。
| 表 1 实验设计 Table 1Experimental design |
在室温条件下,用Luminar 5030型近红外光谱分析仪采集样品的NIRS。光谱扫描范围在1 100~2 300 nm,波长增量2 nm,扫描次数300次,分辨率1 nm。每个溶液采集3张光谱,取平均光谱进行分析。训练集和验证集样本近红外原始光谱见图 1,图 1-a中光谱重叠性较好,图 1-b中光谱在1 100~1 400、1 550~1 850、2 000~2 300 nm吸收峰波动明显,说明验证集样本光谱在上述波段间存在差异。
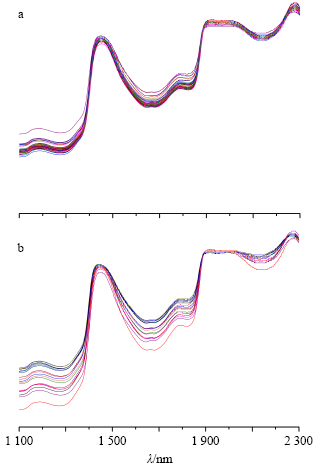 | 图 1 训练集 (a) 和验证集样本 (b) NIRS原始光谱图Fig.1 RawNIRS of calibration (a) and validation samples (b) |
色谱柱Agilent Zorbax SB-C18(100 mm×3.0 mm,1.8 μm);预柱Agilent UPLC Guard Zorbax SB-C18(5.0 mm×3.0 mm,1.8 μm);流动相乙腈-0.1%磷酸水溶液;体积流量0.4 mL/min;梯度洗脱:0~10 min,5%~10%乙腈;10~15 min,10%~20%乙腈;15~30 min,20%~30%乙腈[13];进样量2 μL;柱温30 ℃;检测波长238 nm和324 nm,其中238 nm测定SZS、GA、DAAME、GG和GS,324 nm测定CA。
2.3.2 对照品储备液的制备分别精密称取SZS、GA、DAAME、GG、GS、CA对照品适量,加50%甲醇制成质量浓度分别为28.08、15.14、61.54、113.68、770.20、36.40 mg/L的混合对照品储备液。
2.3.3 供试品溶液的制备精密称定50 mL量瓶的质量,加入1 mL样品溶液,精密称定质量,加入50%甲醇稀释至刻度,摇匀,离心,精密吸取1 mL上清液,置10 mL量瓶中,用50%甲醇稀释至刻度,摇匀,离心,上清液过0.22 μm微孔滤膜,即得。
2.3.4 UPLC色谱图根据上述色谱条件和供试品的制备方法,检测样品溶液中SZS、GA、DAAME、GG、GS和CA的量。混合对照品溶液和样品溶液的UPLC色谱图见图 2。
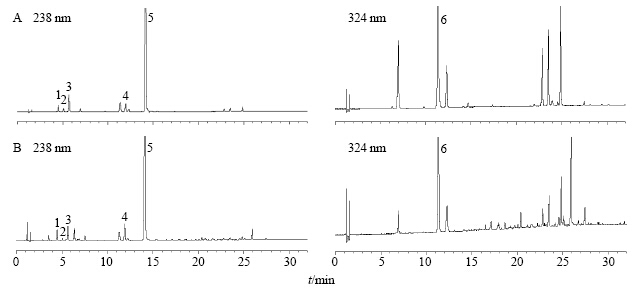 | 图 2 混合对照品溶液 (A) 和样品溶液 (B) 的UPLC图原始光谱图Fig.2 UPLC of mixed reference substances (A) and sample solution (B) |
分别精密量取不同体积的混合对照品储备液,将其配成不同质量浓度的对照品溶液,按上述色谱条件进样分析,以峰面积积分值(Y)对质量浓度(X)进行回归分析,得到各对照品的回归方程和线性范围,结果分别为SZS:Y=5.512 X-1.07,R2=0.999 7,线性范围4.21~42.12μg/mL;GA:Y=6.144 X-0.90,R2=0.999 7,线性范围2.27~22.71 μg/mL;DAAME:Y=6.738 X-2.03,R2=0.999 9,线性范围9.23~92.31 μg/mL;GG:Y=3.631 X-0.73,R2=0.999 9,线性范围17.05~170.52 μg/mL;GS:Y=6.833 X-6.05,R2=0.999 9,线性范围115.53~1155.30 μg/mL;CA:Y=13.736 X-6.95,R2=0.999 8,线性范围5.46~54.60 μg/mL。
2.3.6 精密度考察按“2.3.3”项下方法制备供试品溶液,连续进样6次,按“2.3.1”项下色谱条件测定,记录峰面积,结果SZS、GA、DAAME、GG、GS和CA峰面积的RSD分别为0.37%、1.09%、0.32%、0.55%、0.18%、0.27%,说明仪器的精密度良好。
2.3.7 重复性考察按“2.3.3”项下方法重复制备6份供试品溶液,按“2.3.1”项下色谱条件进样测定,结果SZS、GA、DAAME、GG、GS和CA平均质量分数分别为9.92、3.75、15.88、31.53、169.91、6.12 mg/g,RSD分别为1.17%、1.36%、0.63%、1.08%、0.72%、0.92%,说明该方法的重复性良好。
2.3.8 稳定性考察按“2.3.3”项下方法制备供试品溶液,室温放置,分别在0、2、4、8、16、24 h进样,按“2.3.1”项下色谱条件测定,记录峰面积,结果SZS、GA、DAAME、GG、GS和CA峰面积积分值的RSD分别为1.08%、1.27%、0.68%、0.79%、0.42%、0.70%,说明样品溶液中各成分在室温下24 h内稳定。
2.3.9 加样回收率考察精密称定50 mL量瓶的质量,加入0.5 mL样品溶液,精密称定质量,分别精密加入适量SZS、GA、DAAME、GG、GS、CA对照品,加入50%甲醇溶解并稀释至刻度,摇匀,离心,精密吸取1 mL上清液,置10 mL量瓶中,用50%甲醇稀释至刻度,摇匀,离心,上清液过0.22 μm微孔滤膜。同法制备6份,按“2.3.1”项下色谱条件进样测定,计算加样回收率及其RSD,结果SZS、GA、DAAME、GG、GS、CA的平均加样回收率分别为100.32%、102.86%、98.76%、100.92%、100.72%、99.04%,RSD分别为1.31%、1.87%、1.66%、1.51%、1.12%、1.01%。
2.4 TA定量测定 2.4.1 供试品溶液的制备精密吸取“2.3.3”项下制备的上清液2 mL置10 mL量瓶中,用50%甲醇稀释至刻度,摇匀,离心,即得。
2.4.2 标准曲线的绘制精密称取CA对照品5.030 mg置50 mL量瓶中,加50%甲醇定容至刻度,摇匀,得到含CA 100.6 mg/L的对照品储备液。精密吸取储备液各1、2、3、4、5 mL,分别置于20 mL量瓶中,加50%甲醇稀释至刻度,摇匀,以50%甲醇为空白,在324 nm波长处测定吸光度为A1,在400 nm波长下测定吸光度为A2,以ΔA(A1-A2)为纵坐标(Y),以质量浓度为横坐标(X)绘制标准曲线,进行线性回归,得回归方程为Y=51.250 58 X-0.000 12,r=0.999 9。
2.5 定量测定结果训练集和验证集样本CA、SZS、GA、DAAME、GG、GS和TA的质量分数,分别见表 2和表 3。
| 表 2 训练集样本质控指标的质量分数 Table 2Content of quality control indicators of calibration samples |
| 表 3 验证集样本质控指标的质量分数 Table 3Content of quality control indicators of validation samples |
单变量统计过程控制(univariate statistical process control,USPC)是对生产过程中重要质控指标单独进行过程控制[14, 15]。本实验采用USPC方法分别确定栀子中间体纯化溶液中CA、SZS、GA、DAAME、GG、GS和TA量的放行控制限,按下列公式进行计算。
$\begin{array}{*{20}{l}} {UCL=\mu+3\sigma }\\ {LCL=\mu+3\sigma } \end{array}$
UCL为放行上限,LCL为放行下限,μ为均值,σ为标准差
建立的各成分单变量定量放行限分别为CA 5.753~6.713 mg/g、SZS 9.456~10.723 mg/g、GA 3.313~4.401 mg/g、DAAME 15.260~16.419 mg/g、GG 30.529~33.473 mg/g、GS 165.17~175.16 mg/g和TA 45.028~53.118 mg/g。判断验证集样本各成分的量是否处于受控状态。从图 3中可以看出,样本1、5、7、9、10、14、15、16、17的7种成分的量均在放行限范围内,其中1、5、9、16和17为NOC批次样本,7、10、14和15为pH值为3.0时不同搅拌转速和冷藏时间条件下样本。可能由于搅拌转速和冷藏时间对各成分的量影响较小,所以样本7、10、14和15中各成分的量也在确定的放行限范围内。
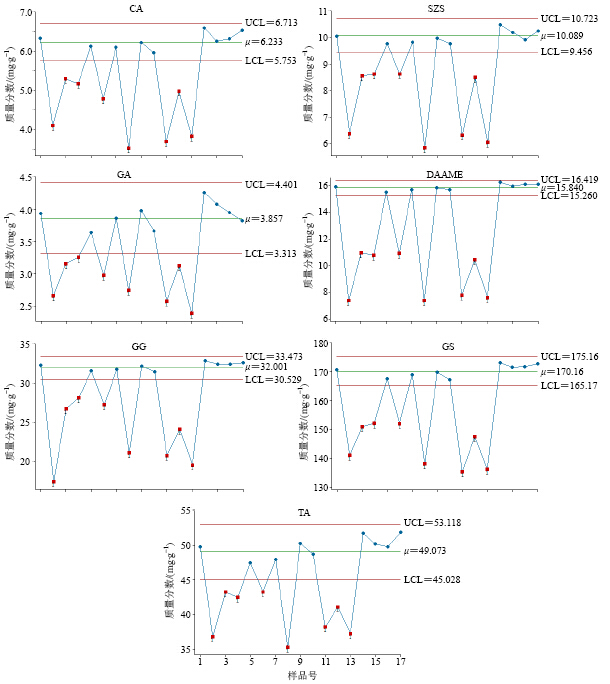 | 图 3 验证样本各成分量单值控制图Fig.3 Individual control charts of each component of validation samples |
单变量统计过程控制只是对单个质量指标进行检测,如果监控的指标较多,需要多张单变量控制图,不利于实际操作,因此考虑用多变量统计过程方法对光谱信息进行分析,建立定性放行标准。Hotelling T2和DModX(distance to the model)是较为常用的2个多变量统计量。Hotelling T2统计量主要依据主成分得分来反映主成分模型内部变量的波动是否异常,而DModX统计量主要依据主成分模型外部残差值来反映变量波动是否异常。取α=0.95为控制限置信水平,计算Hotelling T2和DModX的控制限,作为定性放行标准。数据分析采用SIMCA-P+12.0(Umetrics AB,瑞士)软件。
2.7.1 主成分分析(PCA)采用主成分贡献率累积和百分比(CPV)的方法,计算各主成分贡献率,选择累积和百分比>85%的主成分个数[16]。对训练集样本光谱矩阵(48行601列的二维数据矩阵)进行PCA,当提取3个主成分时,累积贡献率为96.1%,因此选择3个主成分建立MSPC监控模型。
2.7.2 HotellingT2分析 Hotelling T2主要通过主成分模型内部的主元向量波动来反映过程变化的情况。Hotelling T2统计量的控制限可以利用F分布按下列公式进行计算[17]。
${T_i}^2=\sum\limits_{{\rm{a}} - 1}^A {} \left( {{t_{ia}}^2/{S_{ta}}^2} \right)$
tia表示第i个观测值在第a个主成分上的得分值,S2ta是训练集tia的方差估计值
计算得到训练集样本Hotelling T2的放行控制限为4.067 8,对验证集样本进行分析,结果见图 4,样本1、4、5、7、9、10、14、15、16、17均在控制限范围内。
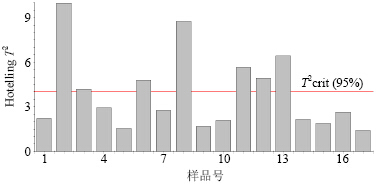 | 图 4 验证集样本Hotelling T2控制图Fig.4 Hotelling T2 control charts of validation samples |
DModX表示在变量空间内点到模型的距离,主要通过主成分模型外部数据残差来反映过程变化的情况,按下列公式进行计算[18]。
${s_i}={[\sum {e_{ik}}^2/(KA)]^{1/2}} \times \nu $
eik表示第i个观测值和第k个变量的原始值与投影值的偏差,K是变量数,A是模型维数,ν是校正因子
计算得到训练集样本DModX的放行控制限为1.218 8,对验证集样本进行分析,结果见图 5,样本1、5、7、9、10、14、15、16、17均在控制限范围内。
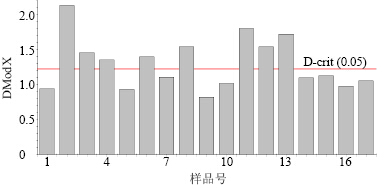 | 图 5 验证集样本DModX控制图Fig.5 DModX control charts of validation samples |
考虑到Hotelling T2和DModX这2个统计量具有互补性,可同时用于中间体质量监控,当任意1个统计量超出放行控制限时,表明中间体质量达不到放行标准。由图 4和5可以得出样本1、5、7、9、10、14、15、16、17的Hotelling T2和DModX值均在放行控制限范围内,这也与定量放行分析的结果一致。
3 讨论本实验应用统计过程控制方法建立栀子中间体纯化工艺关键质控指标的定量放行标准和基于样本NIRS信息的定性放行标准。将Hotelling T2监控图和DModX监控图相结合,同时将定量与定性标准相结合可以更好地理解和监控栀子中间体纯化工艺过程,及时地判断过程异常情况,最终提高中间体以及成品不同批次质量的一致性和稳定性。
由于中药制剂生产过程中不确定性因素众多,变量关系极为复杂,往往出现线性和非线性特征合并的复杂动态过程[19]。如何根据不同剂型的特色,将统计过程控制技术、过程分析技术与中药生产过程的自动化、智能化控制系统相集成,实现近红外在线检测、实时放行分析、异常原因诊断和反馈调控连续控制,保证中药生产系统更加稳健,保证产品批次间质量的均一性和稳定性,具有重要的应用价值。
| [1] | 王智民, 张启伟. 美国FDA产业指南: 创新的药物开发、生产和质量保证框架体系-PAT [J]. 中国中药杂志, 2009, 34(24): 3304-3309. |
| [2] | 冯雄峰, 阳宪惠, 徐用懋. 多元统计过程控制方法的平方预测误差分析 [J]. 清华大学学报, 1999, 39(7): 41-45. |
| [3] | 栾郭宏, 贺凯讯, 程 辉, 等. 基于神经网络的近红外光谱辛烷值模型的研究及应用 [J]. 计算机与应用化学, 2014, 31(1): 63-69. |
| [4] | 周海燕, 徐 冰, 史新元, 等. 清开灵注射液中金银花液生产工艺多元统计过程监控研究 [J]. 世界科学技术—中医药现代化, 2012, 14(4): 1877-1883. |
| [5] | 杨哲萱, 周立红, 章顺楠, 等. NIRS技术在中药生产中的应用及其验证方法探讨 [J]. 中草药, 2013, 44(10): 1342-1348. |
| [6] | 王多加, 周向阳, 金同铭, 等. 近红外光谱检测技术在农业和食品分析上的应用 [J]. 光谱学与光谱分析, 2004, 24(4): 447-450. |
| [7] | 杜文俊, 刘雪松, 陶玲艳, 等. 热毒宁注射液金银花和青蒿 (金青) 醇沉过程中多指标的近红外快速检测 [J]. 中草药, 2015, 46(1): 61-66. |
| [8] | 曲 佳, 王秋珍, 王 杰. 近红外光谱法快速鉴别不同厂家的天王补心丸 (小蜜丸) [J]. 药物评价研究, 2014, 37(4): 346-348. |
| [9] | Lieftucht D, Kruger U, Irwin G W. Improved reliability in diagnosing faults using multivariate statistics [J]. Comput Chem Eng, 2006, 30(5): 901-912. |
| [10] | 孙文爽, 陈兰祥. 多元统计分析 [M]. 北京: 高等教育出版社, 1994. |
| [11] | 陈亚华, 王树青. 用数据驱动实现的抗生素发酵过程监控软件 [J]. 计算机工程与应用, 2004, 40(29): 223-225. |
| [12] | 王家俊, 袁洪福, 陈剑明. 多变量分析方法结合近红外光谱表征卷烟配方的过程质量 [J]. 烟草科技, 2006(10): 5-9. |
| [13] | 吴 莎, 刘启安, 李 云, 等. 最小二乘支持向量机和偏最小二乘法在栀子中间体纯化工艺近红外定量分析中的应用 [J]. 中草药, 2015, 46(7): 990-997. |
| [14] | 王 毅, 马 翔, 温亚东, 等. 近红外光谱与多元统计方法用于生产过程实时分析 [J]. 光谱学与光谱分析, 2013, 33(5): 1226-1229. |
| [15] | EI-Midany T T, EI-Baz M A, Abd-Elwahed M S. A proposed framework for control chart pattern recognition in multivariate process using artificial neural networks [J]. Expert Syst Appl, 2010, 37(2): 1035-1042. |
| [16] | 周海燕, 徐 冰, 史新元, 等. 统计过程控制在栀子前处理生产工艺中的应用 [J]. 中国实验方剂学杂志, 2012, 18(11): 16-20. |
| [17] | Jiang M M, Wang Y F, Xu L, et al. Quantitative profiling of polar metabllites in herbal medicine injections for multivariate statistical evaluation based on independence pricipal component analysis [J]. PLoS One, 2014, 9(8): 1-8. |
| [18] | Treasurea R J, Krugerb U, Coopera J E, et al. Dynamic multivariate statistical process control using subspace identification [J]. J Process Control, 2004, 14(3): 279-292. |
| [19] | 徐 冰, 罗 赣, 林兆洲, 等. 基于过程分析技术和设计空间的金银花醇沉加醇过程终点检测 [J]. 高等学校化学学报, 2013, 34(10): 2284-2289. |
 2015, Vol. 46
2015, Vol. 46


