2. 河北医科大学药学院 天然药物化学教研室, 河北 石家庄 050017
2. College of Pharmaceutical Sciences, Hebei Medical University, Shijiazhuang 050017, China
天然产物指自然界的生物在历经千百万年的进化过程中逐渐合成的次生代谢产物,在没有特别说明条件的情况下是指天然有机化合物。天然产物分子具有超乎人们想象力的新颖化学结构,令科学家叹为观止。天然产物无处不在,人类生活更是离不开天然产物,几千年来用来防病治病的中草药也是因为其中的各种化学成分起作用,天然产物已成为发现治疗重大疾病的药物或重要先导化合物的主要源泉。在研究天然产物过程中,无论发现新天然产物并将其作为药物应用,还是因此产生的各种理论、各门学科等都为人类的科学进步做出了极其重要的贡献。本文通过对科学家们在天然产物研究方面取得的成就进行简要介绍和回顾,展现天然产物及其研究的魅力,期待为年轻专业工作者增加兴趣,开阔眼界。
1 天然产物研究的历史简介有机化学的起源来自对生物体中化学物质即天然产物的研究,或者说对天然产物的研究促成了有机化学学科的正式建立,有机化学学科的建立和发展是天然产物研究发展的一个必然结果。目前化学界一致认为,有机化学学科的诞生标志是1828年德国化学家Friedrich Wǒhler(1800—1882)成功人工合成尿素(urea)。其实,对天然产物的研究远比大多数化学家认为的有机化学学科建立时间还要早得多,人类研究以及利用天然产物已有几千年的历史,特别是将天然产物作为药物应用,如我国明代李梴的《医学入门》(1575年)记载了用发酵法从五倍子中得到没食子酸的过程,这是世界上最早从天然产物中得到的有机酸;李时珍在《本草纲目》(1596年)中详细记载了用升华法制备、纯化樟脑的过程;1806年,23岁的德国药剂师Sertürner从罂粟中首次分离出单体化合物吗啡,开创了从天然产物中寻找活性成分的先河,这一伟大功绩不仅是人类开始将纯单体天然化合物用作药物的一个标志,也意味着现代意义上的天然产物化学初级阶段开始形成;随后奎宁(quinine)、青蒿素(artemisinin)、紫杉醇(taxol)等大量具有新颖结构、生物活性强大的天然产物被分离并得到应用。从1806年成功分离出吗啡(morphine)单体算起,天然产物化学研究历史也要比有机化学学科建立的时间约早20多年[1]。
2 奇妙的天然产物分子结构生存环境的巨大差异意味着生物种类的多样性,生物种类的多样性意味着其二次代谢产物结构的多样性。大自然天斧神工造就的化合物具有独特而新颖的结构,远远超出了科学家的想象力,无论是神奇的简单小分子阿司匹林(aspirin,acetylsalicylic acid),还是结构奇妙复杂的海洋天然产物分子刺尾鱼毒素(maitotoxin,MTX),都吸引了无数科学家惊叹的目光。以下列举几例代表性化合物。
第1个获得的单体天然产物是吗啡(图 1),其结构研究跌宕起伏,历时150年,前后发表研究论文近50篇,研究过程复杂而跌宕起伏。最终英国化学家Robinson在1925年用化学降解的手段完成了结构研究。从化学结构分类看,吗啡既属于苄基异喹啉(benzyl-isoquinoline)衍生物又可认为是菲(phenanthrene)部分结构被饱和的衍生物。著名毒品海洛因(heroin)就是吗啡用乙酸酐处理后生成的二乙酸吗啡酯。在吗啡被分离纯化前,药物治疗都是应用混合物,吗啡单体的成功分离开创了应用纯单体化合物治疗疾病的开端,使得治疗用药更精确,同时也为研究药物的作用机制奠定了基础。众所周知,人工合成的神奇小分子药物阿司匹林最初就是来自于天然产物水杨苷(salicin,图 2)的启发。尽管阿司匹林结构简单,但是从1899年这个神奇的小分子被人工合成并作为药物上市以来,给人类带来了巨大的惊喜,应用范围在不断加大。
 | 图 1 吗啡的化学结构Fig.1 Structure of morphine |
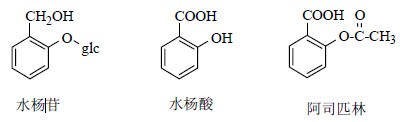 | 图 2 水杨苷、水杨酸和阿司匹林的化学结构Fig.2 Structures of salicin,salicylic acid,and aspirin |
奎宁(图 3)俗称金鸡纳碱,最早是从茜草科植物金鸡纳树Cinchona ledgeriana Moens及其同属植物的树皮中提取得到的。奎宁分子中含有20个碳原子、2个氮原子、2个氧原子和24个氢原子,母核结构中含有1个喹啉(quinoline)单元,1个氮原子在桥头的氮杂双环[2, 2, 2],还有4个手性中心[2]。奎宁曾作为抗疟疾特效药物挽救了无数人的生命。喹啉类生物碱也是数量最多、结构最为复杂的一类生物碱,如同样存在于金鸡纳属等植物中的金鸡宁(cnichonine)、金鸡宁丁(cnichondine)、奎尼丁(quinidine)等。此类生物碱的分子组成、立体化学结构、立体合成、生物活性研究等极大地吸引着众多的有机化学家和药物研究工作者。特别值得一提的是著名的天然抗癌药物喜树碱(camptothecin)也属于喹啉类生物碱。青蒿素(图 4)是我国科学家发现并确定结构的一个伟大的天然药物。青蒿素是1个含有过氧桥(peroxide bridge)结构的倍半萜内酯类化合物。青蒿素的发现,改变了以前认定抗疟药物必须含氯原子的认识,开创了含过氧桥作为活性基团设计抗虐药物的历史。
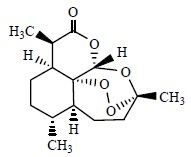
青霉素(penicillin,图 5)也属于小分子天然产物[3],这个神奇的化合物曾经为人类对抗疾病带来了无可比拟的贡献,至今仍然在为人类的健康服务。青霉素分子中含有1个四氢噻唑(thiazolidine)环与1个四元β-内酰胺(β-lactams)环的骈联结构。β-内酰胺环后来成为很多药物设计必含的活性官能团之一。马钱子碱(士的宁,strychnine,图 6)是结构最为复杂的小分子天然产物之一,其正确结构是英国著名有机化学家Robinson在1946年确定的[4]。马钱子碱分子结构中除含有1个苯环外还含有6个环,其中5个环以彼此“骈联”的方式环绕在1个环己烷环周围,仅仅有24个原子(21个碳、2个氮、1个氧)参与分子中环骨架的构成,再加上环彼此之间的顺反异构,还有6个不对称中心。正是由于马钱子碱复杂的立体化学结构,几十年来一直吸引着大批优秀合成化学家去挑战这个美丽的小分子的全合成,1954年美国有机合成大师Woodward首先报道完成了马钱子碱的全合成,据查阅文献,截止目前有18条全合成路线报道[5, 6]。番木鳖碱(brucine,图 6)与马钱子碱母体结构相同,只不过在番木鳖碱结构中苯环上有2个相邻的甲氧基。
 | 图 3 奎宁的化学结构Fig.3 Structure of quinine |
 | 图 4 青蒿素的化学结构Fig.4 Structure of artemisinin |
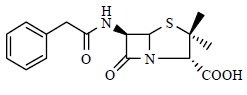 | 图 5 青霉素的化学结构Fig.5 Structure of penicillin |
甾体类化合物(steroids)也是一类结构非常复杂、特殊的天然产物,其分子母体结构中均含有甾核(steroid nucleus),即环戊烷骈多氢菲(cyclopentano- perhydrophenanthrene)骨架。汉字“甾”字也形象地体现了这类化合物的结构特征:4个环上连有3个“小辫子”,即4个骈合的碳骨架环(A、B、C、D环)上连接有3个侧链(图 7)。甾核中骨架中含有的4个环中,A、B、C为六元碳环,D为五元碳环。在天然甾体化合物结构中,A/B环有顺式(cis)或反式(trans)2种骈连构型,而B/C环均为反式骈连构型,C/D环有顺式或反式2种骈连构型,如胆酸(cholic acid,图 8)[7]。甾体分子因其立体结构的特殊性也在有机化学发展史特别是有机化学理论上占有极其重要的地位。甾体化合物是天然产物中最广泛出现的成分之一,几乎所有生物体都能自身合成甾体化合物。甾体母核上不同位置连有不同取代基团,构成了具有性质差异非常大的各种类型的甾体类物质。动物体内和植物体内都含有甾体类物质,它们的母核结构都具有相同的基本骨架,说明动物与植物具有共同的生物起源,奠定了从植物体内寻找药物的基础和可能性。
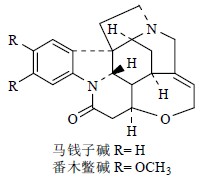 | 图 6 马钱子碱和番木鳖碱的化学结构Fig.6 Structures of strychnine and brucine |
 | 图 7 甾核的骨架结构Fig.7 Carbon skeleton of steroid nucleus |
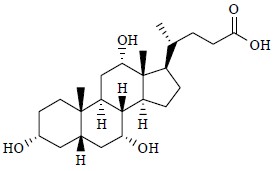 | 图 8 胆酸的化学结构Fig.8 Structure of cholic acid |
紫杉醇(图 9)是目前已发现的最优秀的天然抗癌药物,它的发现激发了人们对天然药物研究的信心。1971年美国科学家Wall博士、Wani博士以及McPhail博士利用核磁共振技术和单晶X衍射确定了紫杉醇的化学结构,发现其结构骨架含有6/8/6-taxane环状体系,即2个六元碳环中间夹着1个八元碳环并连在一起构成了核心骨架,此外骨架上还连有1个四元含氧环以及1个带有酰胺等基团的苯丙酸酯侧链构成“尾巴”侧链;分子中还有11个立体中心、多个官能团[8, 9]。银杏内酯(ginkgolides,图 10)是从银杏叶提取物中发现的具有特殊结构的二萜内酯类(diterpene lactones)化合物,此类成分的化学结构非常奇特,分子骨架小、结构非常紧密,分子中碳骨架高度官能团化,整个分子呈扭曲的笼形结构,6个五元环互相缠绕在一起,包含1个螺[4, 4]壬烷碳骨架、3个γ-内酯环、1个四氢呋喃环、1个叔丁基侧链和十几个手性中心,如银杏内酯B(ginkgolide B)含有11个立体中心[10]。
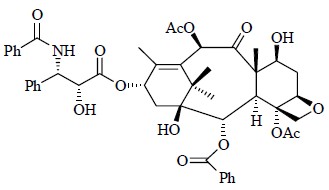 | 图 9 紫杉醇的化学结构Fig.9 Structure of taxol |
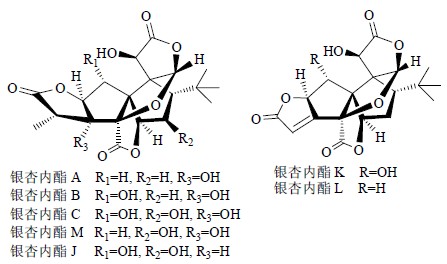 | 图 10 银杏内酯的化学结构Fig.10 Structures of ginkgolides |
极富特点的海洋环境造就海洋生物与陆生生物的显著不同,比如高盐、高压、缺氧、有限的光照、寡营养、低温但相对恒温、局部可能高温或超低温等,海洋天然产物所具有的复杂多样、新颖奇特的结构更是远远超出科学家们的想象[11, 12]。河豚毒素(tetrodotoxin,TTX,图 11)是一个结构很复杂的笼形原酸酯类(orthoester)生物碱,分子中几乎所有的碳原子均有不对称取代,在游离状态下以3种形态相互平衡的混合物存在,其结构确定和全合成让化学家付出了巨大努力[13]。
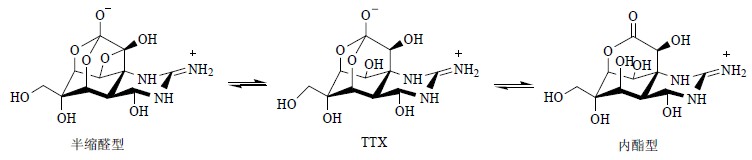 | 图 11 河豚毒素的化学结构Fig.11 Sructure of TTX |
岩沙海葵毒素(palytoxin,PTX,图 12)的分子式为C129H221O54N3,相对分子质量高达2 677,是一个复杂的超级长链聚醚类(polyethers)化合物[14]。聚醚类化合物是海洋生物二次代谢物中最重要的化合物之一,此类化合物具有结构新颖、特殊、相对分子质量大甚至超大、生物活性超强且剧毒、作用机制独特等特点。除PTX外,此类化合物还有著名的刺尾鱼毒素(maitotoxin,MTX)、西加毒素(ciguatoxin)、大田软海绵酸(okadaic acid)以及短裸甲藻毒素(brevetoxin)等。1992年,代表着现代鉴定技术在天然产物化学结构研究中最高应用水平的MTX(图 13)的结构鉴定圆满完成,MTX的分子式为C164H256O68S2Na2,相对分子质量高达3 422,是目前发现的最复杂的天然化合物[15]。
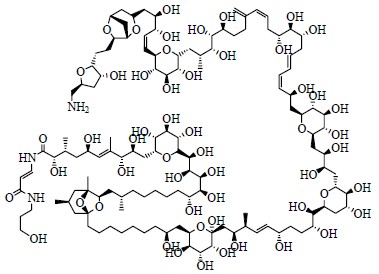 | 图 12 岩沙海葵毒素的化学结构Fig.12 Structure of PTX |
 | 图 13 刺尾鱼毒素的化学结构Fig.13 Structure of MTX |
与合成化合物相比,天然产物的化学结构体现了更为复杂和丰富的多样性。大自然用最简单的原料和最温和的条件合成了千奇百怪的天然产物,这些天然产物结构的复杂多样性远远超乎科学家的想象。图 14中列举了具有代表性天然产物分子的立体结构图。
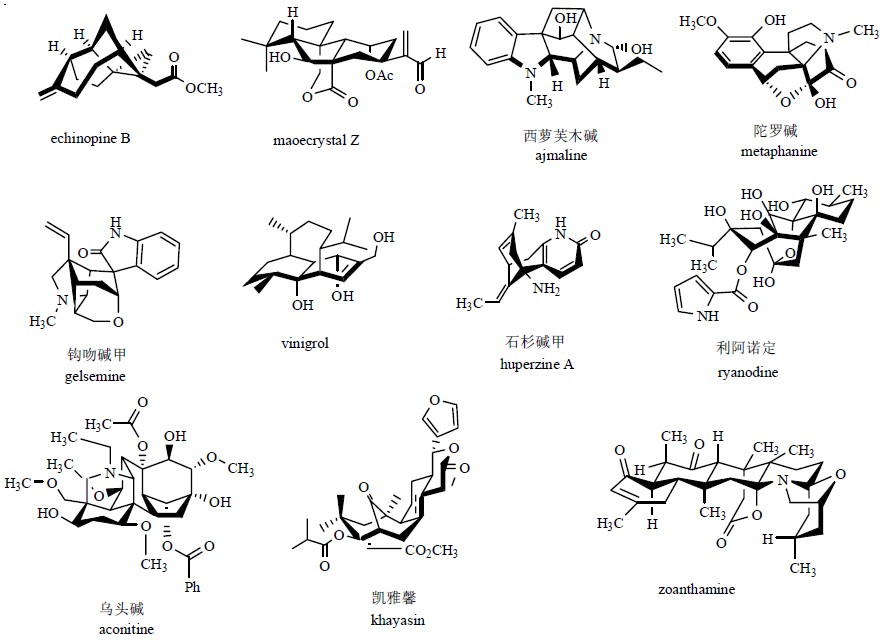 | 图 14 一些代表性天然产物的立体结构Fig.14 Stereochemical structures of some important natural products |
发散性合成源于自然。大自然合成了成千上万的结构复杂的天然化合物,在起始于同一中间体的错综复杂的生物合成途径中,通过氧化态升降、骨架重排、阳离子环化、缩合反应以及周环反应等不同过程,可以产生具有高度结构多样性的天然产物,特别是具有高度的立体选择性。尽管很多天然产物具有很好的生物活性和成药性,但这些化合物在自然界的量很低,远远不能满足人们研究的需要,因此需要化学家们用化学的手段进行合成,即所谓的天然产物全合成。天然产物的全合成应该可以从尿素的全合成开始。1828年尿素全合成的成功具有划时代的意义,不但打破了无机物与有机物无关的界限,也打破了以往人们认为有机物不能人工合成的观点,从此科学家开始人工合成大量的有机化合物[16]。
1944年,美国化学家Woodward和Doering宣布完成了奎宁的全合成[17]。此研究成果公开报道后,得到了化学界的高度赞誉,被认为是有机合成史上的里程碑式成果,并一致认为Woodward和Doering首次提出立体选择性反应(stereoselective reaction)的定义并在合成中应用,开创和引导了有机合成化学理论和实际应用的里程碑式的飞跃发展,推进了有机化学合成学科的发展。不对称合成(asymmetric synthesis)在天然产物全合成的应用也是近年的伟大突破,例如,在2003年终于完成了河豚毒素的不对称全合成。因为紫杉醇对乳腺癌和卵巢癌等具有神奇的疗效,其独特的抗癌机制、新颖的结构以及有限的自然资源引起了全世界研究者的强烈关注,许多有机合成化学家对紫杉醇复杂而新颖的结构非常感兴趣,将完成紫杉醇的全合成看作是极富刺激的挑战,而且出于商业利益的考虑,全世界范围内曾有40多个第一流的研究团队从事紫杉醇的全合成研究工作,在有机化学合成史上实属罕见。目前,已有美国和日本等国家的7个研究团队公开报道完成了具有各自特点的紫杉醇全合成工作[18]。在研究紫杉醇全合成过程中发现了许多新的、独特的反应,如大量过渡金属有机催化剂的应用、有机硅试剂的应用、反应过程中基团的保护、立体构型的建立转化以及独到的战略思路与反应创新等,是有机合成化学以及有机反应理论重要的发展和补充。
天然产物全合成中最负盛名的就是PTX的全合成[14, 15]。PTX的结构中含有64个手性碳和7个双键,理论上应该至少有271个立体异构体,其全合成难度可想而知。哈佛大学岸义人教授领导的团队历经14年的努力,终于在1994年完成了PTX的全合成,该化合物是目前完成全合成中相对分子质量最大、手性碳最多的天然产物[19],不论从反应路线设计还是反应难度上,其全合成过程堪称攀登有机化学界的珠穆朗玛峰,同时被美国化学会载入75年来最伟大的成就之一。在PTX的全合成过程中使用和发现了不少新的试剂、化学反应及机制,不仅对有机合成而且对有机化学理论的发展都起到了非常大的推动作用,至今仍让科学家们津津乐道、赞叹不已。其实,很多天然产物的全合成研究都历时数年甚至十几年,如B型肉毒毒素(BTX-B)、A型肉毒毒素(BTX-A)、紫杉醇、印楝素(azadirachtin)、喜树碱等。
复杂天然产物的全合成始终是有机合成化学家们要征服的最高目标之一,也成就了一大批天然产物合成大师,其中不少科学家因此荣获诺贝尔化学奖。从百年诺贝尔化学奖获奖者看,因为在天然产物全合成方面的突出成就而获奖者人数众多,代表人物如1902年获奖者Fischer(合成了糖类以及嘌呤衍生物)、1905年Von Baeyer(合成靛蓝,对有机染料和芳香族化合物的研究做出重要贡献)、1930年Fischer(合成血红素)、1947年Robinson(从事生物碱研究)、1950年Diels和Alder(发现了双烯合成反应,即Diels-Alder反应)、1965年Woodward(合成了胆甾醇、皮质酮、马钱子碱等多种复杂有机化合物)、1990年Corey(合成了银杏内酯、前列腺素、Et743等众多复杂的天然有机化合物,创建了一种独特的有机合成理论,即逆合成分析)等。具有奇特优美化学结构的天然产物吸引了大批化学家用人工全合成来完成对自然的挑战。
复杂天然产物的化学全合成已经成为有机化学领域中最为活跃的一个分支,不断发现的具有超出科学家想象的、具有新颖复杂结构的天然产物分子不断为有机合成化学家提供新的挑战,也为有机化学学科的发展提供了最直接的推动力,同时体现着一个国家科技发展的水平和实力,更是成为诺贝尔化学奖提名的热门专业。据报道近年已有4人因在天然产物全合成方面的成就获得了诺贝尔化学奖提名,他们是美国哈佛大学的岸义人教授,体表性全合成天然产物有PTX、TTX、蛤蚌毒素(saxitoxin,STX)、软海绵素B(halichondrin B)[20]等;美国加利福尼亚大学圣地亚哥分校Scripps研究所的Nicolaou教授研究团队已经完成了包括紫杉醇、短裸甲藻毒素A和B(brevetoxin A、B)、卡开素(calicheamicin)、万古霉素(vancomycin)、CP 263114 molecule和埃博霉素A和B(epothilone A、B)等120多个复杂天然产物的全合成[21, 22],目前正在致力于最复杂的海洋天然产物MTX的全合成,目前已接近完成;英国剑桥大学的Ley教授领导的研究团队已经完成了约140个复杂天然产物的全合成,包括spongistatin 1、雷帕霉素(rapamycin)、毒胡萝卜素(thapsigargin和印楝素等[23];美国哥伦比亚大学的Danishefsky教授领导的团队也独立完成了包括紫杉醇、埃博霉素、卡开素以及UCS1025A[24]等复杂天然产物的全合成。以上这些完成全合成的天然产物的化学结构见图 15。这些结构新颖特异的天然产物分子在生物体内最主要是作为化学防御和信息交流分子,它们大多都具有特殊和多种多样的生物活性,已经成为发现治疗重大疾病药物或重要先导物的主要源泉以及研究生命科学的分子探针,但是这些分子的量往往很低,要想进一步开发利用,几乎全部需要全合成或通过半合成或通过制备衍生物来获得,这对于天然资源的可持续利用以及环境、生态保护,尤其是对珍稀特种生物资源的保护,都具有长远的战略意义。科学家们在完成复杂天然产物全合成过程中,发现和采用了很多新的反应试剂、反应方法甚至总结出新的有机化学理论等,为有机化学的发展乃至科学的进步做出了不可磨灭的贡献。
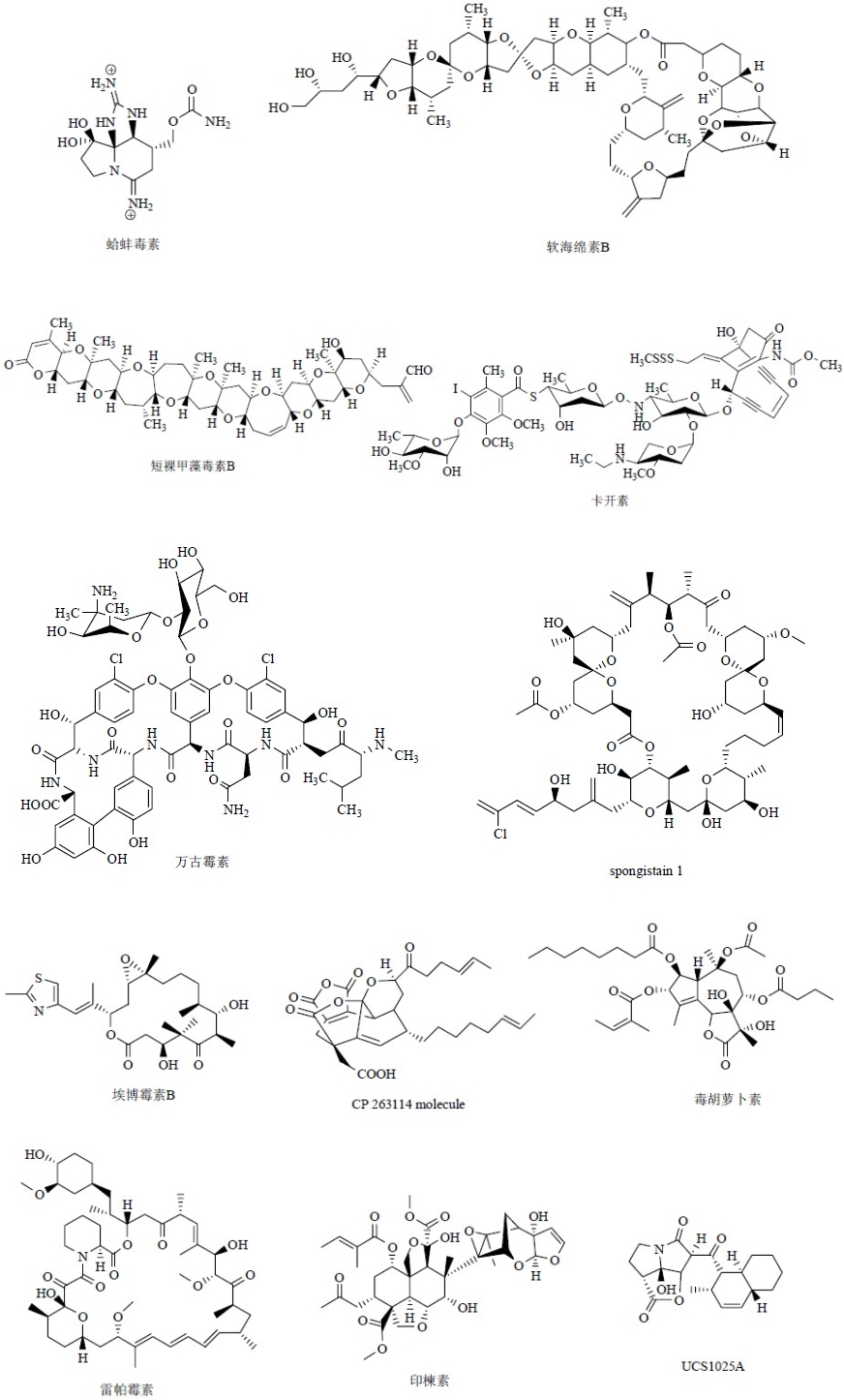 | 图 15 一些完成全合成的重要天然产物的化学结构Fig.15 Structures of some important natural products that have been completed by total synthesis |
对天然产物的研究不但促成了有机化学学科的建立,而且促进了有机化学理论及应用的发展,同时,有机化学理论的应用与发展也进一步加速了对天然产物的研究。1887年德国化学家Wallach首先提出了异戊二烯规则(isoprene rule)[25]:“萜类化合物都是异戊二烯的聚合体”,或者说“自然界存在的萜类化合物都是由异戊二烯头尾相连聚合并衍变的。”这就是所谓的一般异戊二烯规则(general isoprene rule)或经验的异戊二烯规则(empirical isoprene rule),也称为化学的异戊二烯规则(chemical isoprene rule),并以此判断天然产物是否是萜类物质的一个重要原则。当然,随着对有机化学的逐渐深入研究,将萜类化合物碳骨架划分为若干个异戊二烯结构的方法,只能作为对萜类的结构和化学分类的一种认识方法,并不能代表萜类的生源途径。
英国化学家Barton 和挪威化学家Hassel通过对天然甾体等化合物立体构型的研究,发展了立体化学(stereochemistry)的理论[26, 27],从而荣获1969年的诺贝尔化学奖。1973年,美国化学家Woodward宣布历经11年,超过100步反应,完成了维生素B12(coenzyme vitamin B12,cyanocobalamin,VB12)的全合成[28]。除了成功完成VB12全合成的伟大成就外,在全合成VB12过程中,Woodward偶然发现在 [4+2] 环合反应中光或热条件下可以引发不同的立体化学反应,得到不同的立体构型产物,Woodward与Hofmann还通过对这些反应规律的更深入研究和总结最终诞生了有机化学理论中非常著名、重要的“轨道对称守恒定律(The conservation of orbital symmetry)”,又称Woodward-Hoffmann规则(Woodward-Hoffmann rules)[29, 30]。轨道对称守恒原理是建立在日本化学家福井谦一创立的“前线轨道理论(frontier molecular orbital theory)”基础之上并发展开创的新的量子化学理论。轨道对称守恒原理以及前线轨道理论是对量子化学重要的发展促进,堪称自20世纪60年代以来最重要的化学理论。
美国化学家Corey发展了有机合成理论和方法学,创造性地提出“逆合成分析法(retrosynthetic analysis)”[31]。正是对天然产物生物合成途径的深入研究以及影响,促成了有机合成化学的分支仿生合成(biomimetic synthesis)学科的诞生。仿生合成是英国科学家Robinson首先提出的,他通过对生物碱的结构推断和生物合成途径的深入的研究,于1917年首次仿生合成了托品酮(tropinone),开创了仿生合成的先河(图 16)[32]。后来又有人利用仿生合成的方法合成了黄体酮(progesterone,图 17)、虎皮楠生物碱前体(proto-daphniphylline,图 18)等天然产物[33, 34, 35]。实践创造理论,理论指导实践,在不断的探索研究中,促进科学进步,更好地为人类服务。
 | 图 16 托品酮的仿生合成Fig.16 Biomimetic synthesis of tropinone |
 | 图 17 黄体酮的仿生合成Fig.17 Biomimetic synthesis of progesterone |
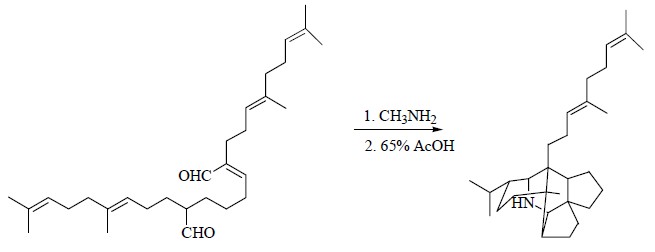 | 图 18 虎皮楠生物碱前体化合物proto-daphniphylline的仿生合成Fig.18 Biomimetic synthesis of proto-daphniphylline |
天然产物对人类最大的贡献就是作为药物为人类所应用,自从有人类历史以来,天然产物一直是人类防病治病的主要来源。天然产物作为化学和生物学之间一个天然的通道,是大自然经过漫长的筛选和进化选择出来的,天然产物的结构与功能研究将对新药发现、生命科学的认识、探索药物作用机制具有重要科学意义。尽管人工合成药物在药物研发中占有相当大的比例,但是临床上应用的很多药物都直接或间接来源于天然产物,如吗啡、奎宁、青霉素、青蒿素、紫杉醇、加兰他敏(galanthamine)、石杉碱甲(huperzine A)、地高辛(digoxin)、雷帕霉素等都是直接来自天然产物的药物,这些天然药物的发现为人类的健康繁衍做出了不可磨灭的贡献,甚至被科学家们认为改变了人类的历史发展进程。天然产物依然是发现治疗重大疾病的药物或重要先导化合物的主要源泉之一,特别是甾体避孕药物的发现,堪称推进人类发展进程的一次伟大革命[36, 37, 38]。
所有生物有共同的起源,从自然界发现对人体有生理活性的天然产物不足为奇。但是,生物体内的化学成分本质上是为了自身防御的需要而不是为了用于人类防病治病,所以进行天然产物的结构改造增加其活性、降低毒副作用也就自然而然成为科学家们的工作。1971年,日本科学家远藤章从真菌桔青霉Penicillium citrinum培养基中分离到一种命名为美伐他汀(mevastatin)的化学物质或称为compactin,可阻断羟甲基戊二酰辅酶A(HMG-CoA),可阻断体内胆固醇的产生。研究结果显示,美伐他汀可显著降低狗和猴子体内血胆固醇水平且无明显毒性作用。随后又从红曲霉菌和土曲霉菌中分离得到结构类似的洛伐他汀(lovastatin),它的作用是美伐他汀的2倍。通过结构修饰得到了一系列的他汀类药物,此类药物能显著降低低密度脂蛋白胆固醇,为预防和治疗冠心病提供了更好的选择[39]。
天然产物可作为药物半合成的前体、药物化学合成的模板以及为药物设计提供了新的思路,科学家们为了提高天然产物的生物活性和降低其毒性,需要在结构上对天然产物进行改造和修饰,近年成功的例子如通过对海洋天然产物软海绵素B进行结构改造得到的抗癌药物甲磺酸艾日布林(halven,图 19),它是一种非紫衫烷类微血管抑制剂,2010年美国食品和药物管理局(FDA)批准其上市[40]。
 | 图 19 甲磺酸艾日布林的化学结构Fig.19 Structure of halven |
近年来对海洋天然产物的研究越来越受到科学家的重视。极富特点的环境造就海洋生物与陆生生物的显著不同,从最初的单细胞生物到地球上现存的最长的植物海藻、最重的动物蓝鲸,海洋在几十亿年的演化过程中孕育了丰富多彩的生物世界,成为资源最丰富、保存最完整、最具有新药开发潜力的领域,与陆生天然产物相比,海洋天然产物所具有的复杂多样、新颖奇特的结构以及多元化的生物活性和作用机制远远超出科学家们的想象。科学家们认为在浩瀚的海洋中存在着大量未被发现的海洋生物以及众多令人激动的结构新颖、活性独特的海洋次生代谢产物。这些丰富多彩的海洋次生代谢产物不仅成为研制开发新药的基础,同时也极大地促进了有机合成化学和生命科学的发展。海洋天然产物已成为发现重要药物先导物和具有新生物作用机制药物的主要源泉[11]。2001年,Luesch教授等[41]从海洋蓝藻细菌的代谢产物中分离出一种结构新颖的环酯肽类化合物apratoxin A(图 20),次年Luesch教授等[41, 42]又从Lyngbya majuscula的二级代谢产物中分离得到3个apratoxin A的类似物,它们具有显著的细胞毒性。2003年,Feling等[43]从热带、亚热带海洋沉积物的放线菌Salinispora tropica中分离得到了salinosporamide A(图 21),研究发现它对20S蛋白酶体有很强的抑制作用,是人类发现的首个20S蛋白酶体不可逆抑制剂;此外salinosporamide A还对多种肿瘤细胞有很强的体外细胞毒性[44],它作为多种疾病的候选药物已进入I期临床试验,如固体瘤、难治性淋巴瘤、多发性骨髓瘤、非小细胞肺癌等[45]。1996年,Swerdlow等[46]从加利福尼亚和墨西哥的太平洋海岸的螺类软体动物的血淋巴中分离得到了钥孔戚血蓝蛋白(keyhole limpet hemocyanin,KLH),研究发现它是具有高度免疫原性的蛋白大分子,作为载体蛋白用于免疫原的制备,交联于半抗原和其他抗原,增强它们的免疫原性。后来人们认识到它还具有抗肿瘤活性,用于治疗膀胱癌的复发有明显疗效[47]。1997年,以KLH为主要药效成分的药物Immucothel被批准在荷兰销售,用于治疗非浸润性膀胱癌。
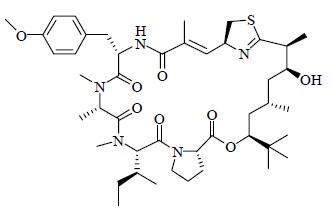 | 图 20 Apratoxin A的化学结构Fig.20 Structure of apratoxin A |
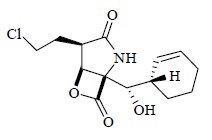 | 图 21 Salinosporamide A的化学结构Fig.21 Structure of salinosporamide A |
提取分离是天然产物化学的重要基础工作,然而天然产物具有化学成分复杂、量低等特点,传统的提取分离技术已经越来越不适应科技的发展,所以各种新的提取分离技术如雨后春笋出现[1],如高效逆流色谱(high-speed counter current chromatography,HSCCC)、制备薄层色谱(preparative thin-layer chromatography,PTLC)、高效薄层色谱(high performance thin-layer chromatography,HPTLC)、高效液相色谱(high performance liquid chromato- graph,HPLC)、闪柱色谱(flash chromatography)、毛细管电泳(capillary electrophoresis,CE)、真空液相色谱(Vacuum liquid chromatography,VLC)、超声提取(ultrasonic extraction)、微波萃取(microwave extraction)、仿生和半仿生提取(bionic & semi-bionic extraction)、膜分离技术(membrane separation)、分子蒸馏技术(molecular distillation)及分子印迹技术(molecular imprinting)等。
6.2 极大推进结构鉴定技术的发展天然产物数量巨大、结构类型繁多,其中立体异构体的测定最为困难。早期的研究中,天然产物的结构确定主要是通过各种化学反应如制备衍生物、化学降解甚至全合成等手段来完成,一个复杂化合物的结构鉴定往往花费几十年的努力,例如小分子天然药物吗啡从1806年发现、1925年提出正确结构到1952年完成全合成,历经150年的时间。从20世纪60年代开始,随着各种分离技术和波谱学技术的飞速发展以及广泛应用,对天然产物的研究取得了显著进展。如结构更为复杂的天然药物利血平(reserpine)从发现、确定结构到人工全合成,仅用了短短4年(1952—1956)的时间。近30年来,现代谱学解析方法(NMR、MS、IR、UV、ORD、CD、X-ray),尤其是二维核磁共振技术的应用,如1H-1H化学位移相关谱(1H-1H COSY)、HMQC谱(heteronuclear multiple quantum coherence)、HMBC谱(heteronuclear multiple bond correlation)、NOESY谱(nuclear overhauser effect spectroscopy)等,都促使天然产物化学的研究速度大大加快。
6.3 没有天然产物就没有生物学的飞跃天然产物是大自然经过漫长的筛选和进化选择出来的。生命科学的发展急需应用新的小分子作为分子探针来帮助发现尚未被阐明的生物作用机制,验证全新的生物药物靶点和解决重大的医学难题。天然产物作为化学小分子探针如TTX等做出了其他生物技术方法无法企及的特殊贡献,并因此催生了一门新的学科“天然产物化学生物学(chemical biology)”[48, 49, 50, 51]。
雷帕霉素是第1个发现的哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂,通过抑制mTOR信号通路、促进G1期细胞周期阻滞和逆转淋巴肿瘤细胞(NPM-ALK)诱导的糖皮质激素抵抗[48]。目前,第一代mTOR抑制剂雷帕霉素衍生物替西罗莫司、依维莫司已由FDA批准作为抗肿瘤药物应用于临床,雷帕霉素及其另一衍生物ridaforolimus也正在进行抗肿瘤的临床试验。基于mTOR信号通路在肿瘤发生发展中的重要作用,mTOR抑制剂已成为抗肿瘤药物研发的前沿热点。还有,布雷菲德菌素A(brefeldin A,图 22)是一种天然抗生素,最早于1958年被发现,从青霉属的斜卧青霉Penicillium decumbens中分离得到[52],现在发现许多种微生物中都能产生该化合物。布雷菲德菌素A能诱导高尔基体的分解,反竞争性抑制蛋白质从内质网中转运至高尔基体,作为一种重要的分子工具被广泛应用于哺乳动物信号传导途径的研究。
 | 图 22 布雷菲德菌素A的化学结构Fig.22 Structure of brefeldin A |
对天然产物化学的研究还揭开了食用海洋产品中毒的面纱,如几乎每年都造成约5万人中毒的西加毒素(ciguatoxin)、河豚毒素等。天然产物还可以作为绿色环保农药或植物激素,如苦参碱、印楝素、尼古丁(nicotine)、除虫菊内酯(chrysanthin)、茉莉酸(jasmonic acid)、脱落酸(abscisic acid)、油菜素甾醇(brassinosteroid)、赤霉素(gibberellin)等。很多天然产物具有抗氧化能力,近年来天然产物在保健美容领域的应用越来越受到好评,如天然虾青素(astaxanthin,图 23)抗氧化活性超过现有的抗氧化剂,虾青素清除自由基的能力是维生素C(vitamin C)的6 000倍、辅酶Q10(coenzyme Q10)的800倍、花青素(anthocyanins)的700倍、β-胡萝卜素的100倍,研究表明只有藻类、酵母菌和细菌等可以产生虾青素,更高等的动物体内不能转化出这种化学成分,虾青素还是唯一能通过血脑屏障的一种类胡萝卜素物质(carotenoid),有研究者称虾青素等天然类胡萝卜素成分极具成为新型抗氧化、消炎制剂的潜力,并且有望在他汀类(statins)和抗血小板药(antiplatelet drugs)之后掀起第3次预防性药物的浪潮。近年来还发现新的甾体类植物激素芸苔素内酯(brassinolide,图 24),已广泛推广使用。
 | 图 23 虾青素的化学结构Fig.23 Structure of astaxanthin |
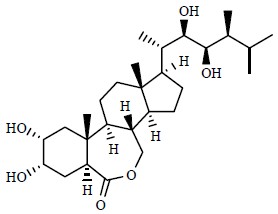 | 图 24 芸苔素内酯的化学结构Fig.24 Structure of brassinolide |
印楝Azadirachta indica A. Juss广泛分布于热带、亚热带地区,是世界上最优秀的高效无毒、无公害杀虫植物,被美国农业部誉为“可解决全球问题之树”。1968年,Butterworth和Morgan从印楝种子中分离出印楝素,在剂量低至0.1 μg/mL时,能够完全抑制沙漠蝗虫Schistocerca gregaria的取食。对防治半翅目、鳞翅目、鞘翅目等害虫有特效,而对人畜和周围环境无污染。2008年,英国剑桥大学化学系Ley教授带领46位科学家历经22年共同完成了印楝素的全合成工作,开创了天然产物化学、有机合成化学和植物源农药的一个新里程碑[53]。假蕨素A(pseudopterosin A,图 25)是一种从软珊瑚虫Pseudopterogorgiaelisabethae体内分离出来的抗炎成分,是著名化妆品雅诗兰黛Resilience®的抗炎成分[54]。
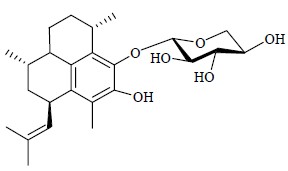 | 图 25 假蕨素A的化学结构Fig.25 Structure of pseudopterosin A |
天然产物化学的迅猛发展,还极大促进了相关学科相互融汇,多学科之间的交叉关联也越来越密切[1],如生物学(biology)、生药学(pharmacognosy)、药用植物学(medicobotany)、生态学(ecology)、中医中药学(Chinese traditional medicine)、生物合成和生源学(biosynthesis and biogenesis)、植物化学分类学(plant chemotaxonomy)、生态生物化学(ecological biochemistry)、药剂学(pharmacy)、药理学(pharmacology)、食品化学(food chemistry)、农药化学(pesticide chemistry)、科技文献信息学(informatics of scientific and technical literature)等。
7 天然产物化学研究的未来生存环境的巨大差异意味着生物种类的多样性,生物种类的多样性意味着其二次代谢产物结构的多样性,二次代谢产物结构的多样性意味着其各种活性以及作用机制的多样性,而这些多样性可以为人类带来无法想象的巨大收益。在现代药物研究中,每一次具有轰动效应的药物出现,一般都伴随着一种新类型天然产物的发现,同时也推动了有机化学和生命科学的发展。例如在新药开发方面,由于天然产物产生于自然界,它们的化学结构和功能在长期的进化过程中得以选择和优化,所具有的独特化学结构赋予了许多天然产物与特定靶点专一性结合的能力和良好的生物活性,化学结构、生物活性及作用机制的多样性不仅可以直接提供新药或药物先导化合物,更可以为化学合成和结构修饰提供灵感。目前,天然产物化学研究的对象和内容也日益扩大,研究的对象已从传统的陆生动植物、陆地土壤微生物逐渐向海洋动植物、无脊椎动物,特别是极端环境下生存的海洋微生物、植物内生微生物。例如,美国科学家在缅因州的土壤内发现了一种名为teixobactin(图 26)的抗生素,这是近30年来发现的第一种新型抗生素,它可以杀死耐甲氧西林金黄色葡萄球菌(MRSA)等多种致命病原体。与其他主要攻击细菌蛋白质的多数抗生素不同,它主要通过破坏细菌的细胞壁来杀灭细菌,病原体很难对其产生抗药性。Teixobactin的出现有望成为人类打败细菌抗药性的“超级武器”[55]。最近还有科学家从海洋微生物中发现了一种新的化合物anthracimycin(图 27),该化合物期待能为治疗炭疽和其他如耐甲氧西林金黄色葡萄球菌(MRSA)等所引起的感染提供新的舞台,可能成为杀灭炭疽菌的新型药物[56]。
 | 图 26 Teixobactin的化学结构Fig.26 Structure of teixobactin |
 | 图 27 Anthracimycin的化学结构Fig.27 Structure of anthracimycin |
埃博拉病毒(Ebola virus)能引起人体致命出血热的零星爆发,但是目前还没有特别有效的治疗方法。埃博拉病毒感染宿主细胞受双孔通道的控制。近日,Davey小组[57]研究发现粉防己的根茎提取物粉防己碱(tetrandrine,图 28)能够阻断该通道。小鼠在感染埃博拉病毒后用粉防己碱治疗,小鼠的存活率显著提高,且不会对小鼠产生明显的副作用。所以粉防己碱成为治疗埃博拉病毒的一个很有前景的药物。南京大学最新研究发现,金银花中富含一种植物微小核糖核酸MIR2911,它直接靶向甲型流感病毒(IAV),包括H1N1、H5N1和H7N9。生物信息学预测和体外实验表明,MIR2911可以作用各种流感病毒包括H1N1、H5N1和H7N9。给小鼠饮用金银花汤剂,可预防其感染IAV,并降低H5N1导致的小鼠死亡率[58]。最近加利福尼亚大学的研究人员从人体阴道微生物中发现新奇的抗生素lactocillin(图 29),预示着人体本身就可能是一个未被利用的天然小分子加工厂,人类机体的微生物群或许也是一个原始的天然的“药物加工厂”。为利用动物体内微生物发现新的天然产物以及研发新药物开辟了新方向[59, 60],大自然就像一个取之不竭用之不尽的超级化学工厂。
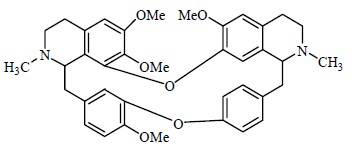 | 图 28 粉防己碱的化学结构Fig.28 Structure of tetrandrine |
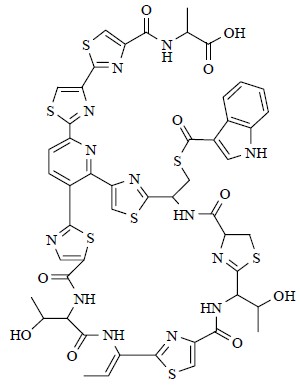 | 图 29 Lactocillin的化学结构Fig.29 Structure of lactocillin |
经过几百万年的进化和自然选择,大自然已经进化的非常完善,人类是大自然的一部分,人类的每一种疾病在大自然都会找到其克服的办法,这就是天人合一的一种体现,应该努力去寻找、去研究。目前高新技术大量开发并得到应用以及多学科交叉互助研究也已经成为必然[61],相信天然产物化学研究正在吸引越来越多研究者的兴趣,同时也必将为人类做出更大的贡献[1, 35, 62]。
| [1] | 史清文, 李力更, 霍长虹, 等. 天然药物化学学科的发展以及与相关学科的关系 [J]. 中草药, 2011, 42(8): 1457-1463. |
| [2] | 郭瑞霞, 李力更, 付 炎, 等. 天然药物化学史话: 奎宁的发现、化学结构以及全合成 [J]. 中草药, 2014, 45(19): 2737-2741. |
| [3] | Piqueras V M. Molecular structure of penicillin [J]. Farmacia Nueva, 1946, 11: 183-187. |
| [4] | Woodward R B. Biogenesis of the strychnos alkaloids [J]. Nature, 1948, 162(4108): 155-156. |
| [5] | Cannon J S, Overman L E. Is there no end to the total syntheses of strychnine ? Lessons learned in strategy and tactics in total synthesis [J]. Angew Chem Int Ed, 2012, 51(18): 4288-4311. |
| [6] | Babu S M, Ranganathan S. The total synthesis of strychnine [J]. Resonance, 2014, 19(7): 641-644. |
| [7] | Wieland H. The chemistry of bile acids [J]. Angewandte Chemie, 1929, 42(17): 421-424. |
| [8] | Nicolaou K C, Yang Z, Liu J J, et al. Total synthesis of taxol [J]. Nature, 1994, 367(6464): 630-634. |
| [9] | 史清文. 天然药物化学史话: 紫杉醇 [J]. 中草药, 2011, 42(10): 1878-1884. |
| [10] | 郭瑞霞, 李 骘, 李力更, 等. 天然药物化学史话: 银杏内酯 [J]. 中草药, 2013, 44(6): 641-645. |
| [11] | 史清文, 李力更, 霍长虹, 等. 海洋天然产物化学研究概述 [J]. 中草药, 2010, 41(7): 1031-1047. |
| [12] | 史清文, 李力更, 王于方, 等. 海洋天然产物化学研究新进展 [J]. 药学学报, 2010, 45(10): 1212-1223. |
| [13] | 郭瑞霞, 李力更, 王 磊, 等. 天然药物化学史话: 河豚毒素 [J]. 中草药, 2014, 45(9): 1330-1335. |
| [14] | 李 骘, 刘 诣, 李力更, 等. 天然药物化学史话: 岩沙海葵毒素的全合成 [J]. 中草药, 2013, 44(18): 2630-2633. |
| [15] | Nicolaou K C, Frederick M O. On the structure of maitotoxin [J]. Angew Chem Int Ed, 2007, 46(28): 5278-5282. |
| [16] | Nicolaou K C, Vourloumis D, Winssinger N, et al. The art and science of total synthesis at the dawn of the twenty-first century [J]. Angew Chem Int Ed Engl, 2000, 39(1): 44-122. |
| [17] | Woodward R B, Doering W E. The total synthesis of quinine [J]. J Am Chem Soc, 1944, 66(5): 849. |
| [18] | 李力更, 吴 明, 史清文. 天然抗癌药物紫杉醇的全合成 [J]. 天然产物研究与开发, 2008, 20(6): 1104-1107. |
| [19] | Suh E M, Kishi Y. Synthesis of palytoxin from palytoxin carboxylic acid [J]. J Am Chem Soc, 1994, 116(24): 11205-11206. |
| [20] | Aicher T D, Buszek K R, Fang F G, et al. Total synthesis of halichondrin B and norhalichondrin B [J]. J Am Chem Soc, 1992, 114(8): 3162-3164. |
| [21] | Nicolaou K C. The battle of calicheamicin gamma1 [J]. Angew Chem Int Ed Engl, 1993, 32(10): 1377-1500. |
| [22] | Nicolaou K C. The total synthesis of brevetaxin B: A twelve-year odyssey in organic synthesis [J]. Angew Chem Int Ed Engl, 1996, 35(6): 589-607. |
| [23] | Ley S V. The changing face of organic synthesis [J]. Tetrahedron, 2010, 66(33): 6270-6292. |
| [24] | Lambert T H, Danishefsky S J. Total synthesis of UCS1025A [J]. J Am Chem Soc, 2006, 128(2): 426-427. |
| [25] | Wallach O. Terpenes and ethereal oils [J]. J Chem Soc Abstr, 1887, 52: 595-596. |
| [26] | Barton D H R. Stereochemical aspects of mono-and sesquiterpenoids [J]. Perfumery Essential Oil Record, 1950, 41: 81-85. |
| [27] | Hassel O. Structural aspects of interatomic charge- transfer bonding [J]. Science, 1970, 170(3957): 497-502. |
| [28] | Woodward R B. The total synthesis of vitamin B12 [J]. Pure Appl Chem, 1973, 33(1): 145-177. |
| [29] | Woodward R B, Hoffmann R. Stereochemistry of electrocyclic reactions [J]. J Am Chem Soc, 1965, 87(2): 395-397. |
| [30] | Woodward R B, Hoffmann R. Conservation of orbital symmetry [J]. Acc Chem Res, 1968, 1(1): 17-22. |
| [31] | Corey E J, Johnson A, Peter L, et al. Computer-assisted synthetic analysis. Techniques for efficient long-range retrosynthetic searches applied to the Robinson annulation process [J]. J Org Chem, 1980, 45(11): 2051-2057. |
| [32] | Robinson R. Synthesis of tropinone [J]. J Chem Soc Trans, 1917, 111: 762-768. |
| [33] | Beyler R E. Some recent advances in the field of steroids [J]. J Chem Educ, 1960, 37(9): 491-494. |
| [34] | Piettre S, Heathcock C H. Biomimetic total synthesis of proto-daphniphylline [J]. Science, 1990, 248(4962): 1532-1534. |
| [35] | Mohr J T, Krout M R, Stoltz B M. Natural products as inspiration for the development of asymmetric catalysis [J]. Nature, 2008, 445(9): 323-332. |
| [36] | 史清文, 李力更, 霍长虹, 等. 天然药物化学研究与新药开发 [J]. 中草药, 2010, 41(10): 1583-1589. |
| [37] | Brusotti G, Cesari I, Dentamaro A, et al. Isolation and characterization of bioactive compounds from plant resources: The role of analysis in the ethnopharmacological approach [J]. J Pharm Biomed Ana, 2014, 87: 218-228. |
| [38] | Wender P A, Miller B L. Synthesis at the molecular frontier [J]. Nature, 2009, 460(7252): 197-201. |
| [39] | Lyons K S, Harbinson M. Statins: in the beginning [J]. J R Coll Physic Edinb, 2009, 39(4): 362-364. |
| [40] | Donoghue M, Lemery S J, Yuan W, et al. Eribulin mesylate for the treatment of patients with refractory metastatic breast cancer: use of a “physician's choice” control arm in a randomized approval trial [J]. Clin Cancer Res, 2012, 18(6): 1496-1505. |
| [41] | Luesch H, Yoshida W Y, Moore R E, et al. Total structure determination of apratoxin A, a potent novel cytotoxin from the marine cyanobacterium Lyngbya majuscule [J]. J Am Chem Soc, 2001, 123(23): 5418-5423. |
| [42] | Luesch H, Yoshida W Y, Moore R E, et al. New apratoxins of marine cyanobacterial origin from Guam and Palau [J]. Bioorg Med Chem, 2002, 10(6): 1973-1978. |
| [43] | Feling R H, Buchanan G O, Mincer T J, et al. Salinosporamide A: a highly cytotoxic proteasome inhibitor from a novel microbial source, a marine bacterium of the new genus salinospora [J]. Angew Chem Int Ed Engl, 2003, 42(3): 355-357. |
| [44] | Williams P G, Buchanan G O, Feling R H, et al. New cytotoxic salinosporamides from the marine Actinomycete Salinispora tropica [J]. J Org Chem, 2005, 70(16): 6196-6203. |
| [45] | 白迎军. Salinosporamide A的仿生不对称全合成 [D]. 天津: 南开大学, 2010. |
| [46] | Swerdlow R D, Ebert R F, Lee P, et al. Keyhole limpet hemocyanin: structural and functional characterization of two different subunits and multimers [J]. Comp Biochem Physiol B: Biochem Mole Biol, 1996, 113B(3): 537-548. |
| [47] | Olsson C A, Chute R, Rao C N. Immunologic reduction of bladder cancer recurrence rate [J]. J Urol, 1974, 111(2): 173-176. |
| [48] | Carlson E E. Natural products as chemical probes [J]. ACS Chem Biol, 2010, 5(7): 639-653. |
| [49] | Pucheault M. Natural products: chemical instruments to apprehend biological symphony [J]. Org Biomol Chem, 2008, 6(3): 424-432. |
| [50] | Strausberg R L, Schreiber S L. From knowing to controlling: a path from genomics to drugs using small molecule probe [J]. Science, 2003, 300(5617): 294-295. |
| [51] | Vintonyak V V, Waldmann H, Rauh D. Using small molecules to target protein phosphatases [J]. Bioorga Med Chem, 2011, 19(7): 2145-2155. |
| [52] | Singleton V L, Bohonos N, Ullstrup A J. Decumbin, a new compound from a species of Penicillium [J]. Nature, 1958, 181(4615): 1072-1073. |
| [53] | 樊会丹, 张从海, 严胜骄. 印楝素的合成、结构修饰及生物活性研究进展 [J]. 有机化学, 2009, 29(1): 20-33. |
| [54] | Look S A, Fenical W, Jacobs R S, et al. The pseudopterosins: anti-inflammatory and analgesic natural products from the sea whip Pseudopterogorgia elisabethae [J]. Proc Nat Acad Sci USA, 1986, 83(17): 6238-6240. |
| [55] | Ling L L, Schneider T, Peoples A J, et al. A new antibiotic kills pathogens without detectable resistance [J]. Nature, 2015, 517(7535): 455-459. |
| [56] | Jang, K H, Nam S, Locke J B, et al. Anthracimycin, a potent anthrax antibiotic from a marine-derived actinomycete [J]. Angewandte Chem Int Ed, 2013, 52(30): 7822-7824. |
| [57] | Sakurai Y, Davey R A, Kolokoltsov A A, et al. Ebola virus. Two-pore channels control Ebola virus host cell entry and are drug targets for disease treatment [J]. Science, 2015, 347(6225): 995-998. |
| [58] | Zhou Z, Li X, Liu J, et al. Honeysuckle-encoded atypical microRNA2911 directly targets influenza A viruses [J]. Cell Res, 2015, 25(1): 39-49. |
| [59] | Donia M S, Cimermancic P, Schulze C J, et al. A systematic analysis of biosynthetic gene clusters in the human microbiome reveals a common family of antibiotics [J]. Cell, 2014, 158(6): 1402-1414. |
| [60] | Stierle A, Strobel G, Stierle D. Taxol and taxane production by taxomyces andreanae, an endophytic fungus of Pacific yew [J]. Science, 1993, 260(5105): 214-216. |
| [61] | Gross L, Mohn F, Moll N, et al. Organic structure determination using atomic-resolution scanning probe microscopy [J]. Nat Chem, 2010, 2(10): 821-825. |
| [62] | Clardy J, Walsh C. Lessons from natural molecules [J]. Nature, 2004, 432(16): 829-837. |
 2015, Vol. 46
2015, Vol. 46


