2. 天士力集团研究院, 天津 300402;
3. 天津大学药学院, 天津 300072
2. Tianjin Tasly Institute, Tianjin 300402, China;
3. School of Pharmacy, Tianjin University, Tianjin 300072, China
2014年1月28日,欧洲药品监督管理局(European Medicines Agency,EMA)发布了最新的欧盟银杏叶专论的草案(Community herbal monograph on Ginkgo biloba L.,folium)[1],这份专论从2012年5月开始由草药专论和名录工作小组开始发起讨论,历时近2年,终于在2014年1月由欧盟草药药品委员会(Committee on Herbal Medicinal Products,HMPC)采纳发布并征集意见,征集意见截止日期为2014年6月15日,之后草药专论和名录工作小组将对该银杏叶专论进行重新审议,预计该专论将于2015年上半年最后定稿。
HMPC是根据理事会(EC)726/2004号条例[2]和2004/24/EC法规[3]而设立的,成立于2004年9月,它的职责之一是针对某一种特定草药物质或制剂建立关于其安全性和有效性的论述。该委员会在欧盟范围内引入了一种传统植物药简化注册的模式,一旦某种传统植物药产品的专论建立起来,成员国在药品注册的审批时将考虑作为申请的依据。截至2014年7月,HMPC已经建立起了139种草药的专论,25种处于公示期,4种即将定稿,28种
1 欧盟银杏叶专论基本内容根据欧盟草药药品管理法规2004/24/EC指令第16条,起草并建立欧盟草药专论是HMPC的重要职责和任务之一。草药专论与产品特性摘要(summary of product characteristics,SPC)类似,它包含了HMPC对草药所有资料和数据的科学评价观点,是反映草药及其制品安全性和有效性的官方文件。此次HMPC发布的银杏叶专论包括以下7个方面的信息:药品名称、定性和定量的成分(草药拉丁学名、药用部位、提取物形式等)、剂型、临床特点(适应症、剂量和使用方法、禁忌症、特别警告和使用注意、药物相互作用、生育、怀孕和哺乳、对驾驶和操作机器的影响、不良反应、超剂量使用)、药理学特点(药效学、药动学、临床前安全性数据)、药学特点、专论撰写时间。该专论可作为银杏叶在欧盟进行传统草药简化注册及完整注册申请的重要参考资料,是欧盟成员国进行传统药注册审评时的重要依据。
2 欧盟传统植物药注册的不同途径传统植物药的注册在欧盟可以有2种不同的途径,即良好应用申请和简化申请。
2.1 良好应用(well-established use,WEU)申请据欧盟2001/83/EC号法令规定:WEU申请是指在药品申请注册时必须提供全面、完整的申报材料的一种申请形式。该法令对该申请形式所需提交的研究内容做了具体的要求,包括药理学和毒理学实验、理化性质研究实验和临床研究等内容。结合药品的具体情况,申请者可以用已经公开发表的文献资料替代部分药学研究内容。欧盟法律规定,药品进行完整申请的上市许可申报资料称为通用技术文件(common technical document,CTD),包含5个模块(图 1),模块1包括地区行政管理资料,这个模块的信息一般因药品注册的地区不同而不同,并不归入正式的CTD文件里;模块2包括药品研究工作的概要及综述;模块3为质量研究报告;模块4为非临床研究资料;模块5为临床研究报告。进行WEU申请时必须提供上述5部分的资料,不能有任何内容的减免,否则不予注册。
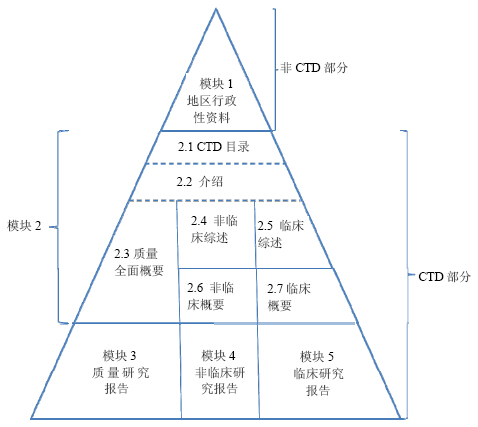 | 图 1 CTD结构图Fig.1 Chart of CTD |
2004年3月31日欧盟专门为植物药出台了2004/24/EC指令[3],即“欧盟传统植物药(草药)注册程序指令”,在该指令中提出了TUR的申请程序,该申请程序是成员国申请,且可以采用互认可程序,并规定传统简化注册程序的范围只适用于传统草药药品(traditional herbal medicinal products,THMPs)。适合欧盟TUR的THMPS需符合以下条件:(1)申请注册的产品必须是草药药品,其活性成分只能是草药物质、草药制剂或者其组合,某些维生素和矿物质可以作为辅助治疗的成分加入。(2)应具有独特的适应症,这些传统草药药品在组成和用途方面,被设计为不需医师指导,根据适应症即可应用于自我诊断、处方和治疗。(3)必须有特定的服用方法、剂量和规格,而且必须是口服、外用或吸入制剂。(4)应当有文献或者专家证据证明具有30年以上的使用历史,包括在欧盟范围内具有15年的使用历史。(5)有充分的药品传统应用数据,特别是基于长期使用和经验已证明该产品在特定的条件下使用是无害的,其药理作用或药效是合理的。
按照欧盟2003/63/EC指令和2004/24/EC指令规定,对于符合条件的传统草药药品,申请者仍然需要按照CTD要求递交产品注册申请文件和资料。具体要求提交文件包括:模块1“地区行政性资料”,其中的“产品特性概要”中不必提交产品药动学的相关资料;模块2中的2.1~2.3,不必提交模块2.5~2.6的内容;模块3“质量研究”文件,总共3个模块的文件。模块4“非临床研究报告”和模块5“临床研究报告”这2部分均可以进行简化。
3 详细解读银杏叶专论从整体上看,这次出台的银杏叶专论从WEU和TUR这2种途径,对银杏叶产品在所含物质、剂型、剂量、临床适应症等方面作了不同的要求。
3.1 定性和定量的成分方面(qualitative and quantitative composition)根据欧盟药品法规2001/83/EC的不同条款,通过WEU途径注册的产品是含有银杏叶提取物的产品,即提取比例为35~67∶1,提取溶剂为60%丙酮;通过TUR途径的产品是银杏叶的干燥粉末制成的制剂。
3.2 剂型方面(pharmaceutical form)WEU途径注册的银杏叶产品可以是固体或液体制剂,TUR途径注册的银杏叶产品只能是固体制剂。
3.3 临床适应症方面(therapeutic indications)WEU途径注册的银杏叶产品的适应症可以是“改善老年性的认知损伤,提高轻度痴呆者的生活质量”;而TUR途径注册产品的适应症只能是“在医生排除了严重症状之后,用于缓解轻度的循环障碍引起的腿部沉重感以及手脚冰凉”。
3.4 剂量方面(posology)WEU途径注册的银杏叶产品剂量是单次剂量120~240 mg,日剂量240 mg;TUR途径注册的产品剂量为单次剂量250~360 mg,日剂量750 mg。2种不同注册途径的银杏叶产品服用剂量差别较大,皆因两者所含物质不同,WEU途径注册的产品含有平均浓缩比例是50∶1的银杏叶提取物,而TUR途径注册的产品由银杏叶的干燥粉末制成,没有经过浓缩过程。
3.5 疗程方面(duration of use)银杏叶专论对WEU途径注册的产品定义为治疗时间不能短于8周。如果3个月后还没有症状上的改善,或者如果病症反而加剧,医生应该检查继续治疗的合理性;对TUR途径注册的产品定义为如果症状持续2周以上,应咨询医生或有医师资格的从业者。
在银杏叶专论中,对银杏叶产品在与其他药的相互作用,生育、怀孕和哺乳,不良反应及临床前安全性数据方面,2种注册途径的产品的信息是一致的,仅在TUR途径注册产品的相关信息前注明:“对于银杏叶提取物,以下信息已经在银杏叶制剂的科学报告中证实,不能排除这些也与银杏叶提取物粉末相关”。此外,在药理作用方面,对WEU途径产品列出了药效学(pharmacodynamic properties)和药动学(pharmacokinetic properties)的详细数据,而对于TUR途径产品,根据欧盟2001/83/EC法令中第16C条(1)(a)的规定,不要求提供。
4 银杏叶专论对银杏叶产品在欧盟注册的影响分析银杏叶专论的出台,显然对银杏叶产品在欧盟的上市是有利的,它明确设定了银杏叶产品在欧盟注册的途径、适应症、剂量等一系列内容的建议,为准备在欧盟注册银杏叶产品的厂家提供了极大的便利与重要参考。但是也应该看到,银杏叶在欧洲已经有非常长的应用历史,在欧盟的注册应该符合2004/24/EC指令中传统草药药品TUR的条件,但是在这份专论中,把含有标准银杏叶提取物(EGb761)的产品归到了WEU的途径里,只有含非浓缩的银杏叶干燥粉末的产品才可以通过TUR进行申请注册,这点特别值得厂家注意。
另一方面,虽然HMPC所出台的专论在欧盟有非常高的认可度,但是欧盟一共有27个成员国,各国的国情不同,对银杏叶制剂的注册要求也会各异,专论内容是否在该国适用,需要在药品注册前与该国的药政部门进行有效沟通。
5 银杏叶产业前景展望银杏是世界最古老的树种之一,资源在中国分布最为广泛,银杏叶入药在中国也已经有几千年的历史。但是对银杏叶有效成分的现代研究始于20世纪的德国,从20世纪50年代起,德国Schwabe家族积极投身于银杏叶的研究工作,他们从西方传统的分析思维出发,希望找到银杏叶中起关键作用的有效成分。经过十几年的艰苦努力,终于开发出了标准化的银杏叶提取物——EGb761,它的27道提取工序在欧洲获得了永久性专利,保证了EGB761的高度安全性。在如此多道工序的提取过程中,包含了几个不同的纯化阶段,像黄酮苷、银杏内酯等活性成分被浓缩了平均50倍,同时剔除银杏叶酸这样的毒性成分。以EGb761为基础研发的产品也在全球范围内取得了巨大的商业利益回报[5]。
虽然银杏资源在中国非常的丰富,但还应该看到的是,由于质量规范与法规的相对滞后,国内银杏叶提取物企业多沦为初级的原料供应商,处在银杏叶提取物产业链的底层,国际市场上议价能力低下。为了改变这一现实,建议加快提高生产和质量研究规范,通过展开创新性研究提高产品的附加值,以EGB761为产品研究与开发的样板,在工艺和质量标准提升上多下功夫,申请美国与欧盟的DMF和CEP证书,提高国内银杏叶产业的整体水平。
| [1] | Committee on Herbal Medicinal Products (HMPC). Community Herbal Monograph on Ginkgo biloba L., Folium. EMA/HMPC 321097/2012 [S]. 2014. |
| [2] | Regulation (EC) No 726/2004 of the European Parliament and of the Council of Laying down Community Procedures for the Authorisation and Supervision of Medicinal Products for Human and Veterinary Use and Establishing a European Medicines Agency [S]. 2004. |
| [3] | The European Parliament and the Council of the European Union. Directive 2004/24/EC of the European Parliament and the Council of 31 March 2004 amending, as regards traditional herbal medicinal products, Directive 2001/83/EC on the Community code relating to medicinal products for human use [J]. Official J Eur Union, 2004, 47(L-136): 85. |
| [4] | Committee on Herbal Medicinal Products (HMPC). Overview of Assessment Work-Priority List. EMA/HMPC/278067/2006 [S]. 2014. |
| [5] | 徐艳芬, 张丽娟, 宋新波. 银杏叶提取物的研究进展 [J]. 药物评价研究, 2010, 33(6): 452-456. |
 2015, Vol. 46
2015, Vol. 46

