昆明山海棠Tripterygium hypoglaucum (Lévl.) Hutch又名火把花、断肠草、紫金皮等,为卫矛科雷公藤属植物,在我国主要分布在云南、贵州、四川、浙江等地。火把花一名始载于《本草纲目》[1]:“生滇南者花红,呼为火把花”。昆明山海棠具有祛风除湿、活血舒筋的功效,主治风湿痹痛、半身不遂、疝气痛、痛经、出血不止、急性传染性肝炎、慢性肾炎、红斑狼疮、癌肿等。另外《云南抗癌中草药》中记载昆明山海棠可治疗白血病、骨肉瘤、淋巴肉瘤、甲状腺癌、肺癌、类风湿、骨髓炎[2]。研究表明[3, 4],昆明山海棠中含有生物碱、萜类及其糖苷类化合物等,具有抗炎、免疫抑制、抗生育、抗肿瘤以及抗HIV等药理作用[5, 6],临床主要用于治疗类风湿关节炎、红斑狼疮、慢性肾炎及银屑病等自身免疫性疾病[7]。本文对其化学成分和药理作用以及临床应用研究进展进行综述。
1 化学成分雷公藤属有昆明山海棠、雷公藤T. wilfordii Hook. f.、东北雷公藤T. regelii Sprague et Takeda 3种植物,化学成分主要为生物碱、倍半萜、二萜以及三萜类化合物等,其中雷公藤甲素、雷酚内酯、雷公藤内酯三醇、雷藤三萜醌A等二萜类成分[8]和雷公藤红素、雷公藤内酯甲等三萜类成分[9, 10]被认为是特征性活性成分。比较现有的从3种植物中分离得到的化学成分,昆明山海棠素(如昆明山海棠素A、D、K等)是昆明山海棠中的特有化学成分。黄耀锋等[11]通过薄层色谱对昆明山海棠、雷公藤中的主要化学成分进行比较,结果表明昆明山海棠和雷公藤中的化学成分相似度非常高,进一步证明了它们临床疗效的相似性。此外,黄文华等[12, 13]采用HPLC法对雷公藤属3种植物不同群体和个体中的雷公藤甲素和总生物碱的量进行测定,结果表明雷公藤和昆明山海棠中雷公藤甲素和总生物碱的量相差较小,东北雷公藤中的量均低于同属的另外2种植物。对已有文献报道进行总结归类,昆明山海棠主要化学成分为倍半萜类2个,二萜类23个,三萜类38个,倍半萜类生物碱37个,黄酮类4个,甾体类化合物4个,鞣质3个,其他9个。昆明山海棠化学成分名称及结构式见表 1和图 1。
| 表 1 昆明山海棠中的化学成分 Table 1Chemical constituents in T. hypoglaucum |
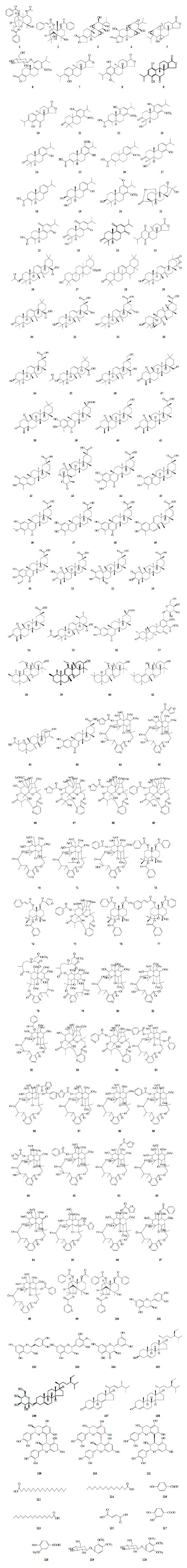 | 图 1 昆明山海棠中化学成分的结构式Fig.1 Structures of chemical constituents in T. hypoglaucum |
昆明山海棠中的主要活性成分为二萜和三萜,其中最具代表性和研究较为深入的成分分别为雷公藤甲素和雷公藤红素。雷公藤甲素具有抗炎、抑制免疫、抗生育、抗肿瘤(尤其是具有显著的抗白血病活性)等药理作用,雷公藤甲素还对耐药性肿瘤细胞A549/DDP、K562/02具有较好的逆转作用[37]。三萜类成分雷公藤红素除了具有抗炎、抗肿瘤作用外,还具有治疗神经退行性疾病、抗HIV和抗高血压等活性[38]。
2.1 抗炎作用胶原诱导性关节炎(CIA)和佐剂性关节炎(AA)是应用比较成熟的2种类风湿关节炎动物模型。昆明山海棠对CIA和AA大鼠模型都具有积极的治疗效果,可能是通过抑制外周血、滑膜组织中的缺氧诱导因子-1α(HIF-1)表达或降低血清中白细胞介素-6(IL-6)、IL-17、γ干扰素(IFN-γ)、IL-1β、肿瘤坏死因子-α(TNF-α)等细胞因子水平来抑制滑膜细胞和炎症细胞生长,从而产生抗炎作用[39, 40, 41, 42]。
刘彤云等[43]通过体外细胞培养和免疫组化技术研究复方昆明山海棠对人血管内皮细胞细胞间黏附分子-1(ICAM-1)表达的影响,结果表明复方昆明山海棠可能是通过抑制ICAM-1的表达来减少白细胞和血管内皮的黏附,从而发挥其抗炎作用。复方昆明山海棠也可显著抑制花生四烯酸诱导的局部炎症反应[44]。
2.2 免疫抑制作用雷晴等[45]用2,4-二硝基氟苯诱导小鼠形成迟发型超敏反应动物模型,并用不同剂量的昆明山海棠提取液对其进行治疗,结果表明中、高剂量的昆明山海棠具有较好的免疫抑制作用,并表现出一定的量效关系。昆明山海棠提取物可以缓解异基因骨髓移植小鼠移植物抗宿主病(GVHD),发挥免疫抑制作用的机制可能与升高CD+4 CD+25 T细胞水平和增加Foxp3 mRNA的表达有关,并且昆明山海棠与环孢素A(CsA)联合用药对于免疫抑制具有协同作用[46]。
2.3 抗生育作用和生殖毒性研究表明,昆明山海棠会对大鼠睾丸的生精细胞产生损伤,损伤程度与昆明山海棠存在一定的量效关系和时效关系,其作用机制可能与睾丸功能相关酶的异常表达有关[47, 48]。Wang等[49]用昆明山海棠醇提物(ETHR),雄性蒙古沙鼠按160 mg/kg剂量给药30 d后,测定沙鼠的精子密度和活力等指标,结果表明ETHR可以降低精子密度、活力和增加精子的致畸率。
2.4 抗肿瘤作用昆明山海棠总生物碱(THHta)具有很好的抗肿瘤作用,已有文献报道,THHta可以抑制肺癌细胞A549[50]、4种白血病细胞[51]以及结肠癌细胞HCT116[52]增殖,并诱导其凋亡。Jiang等[53]同时对THHta进行体内和体外抗肿瘤活性研究,结果表明THHta通过诱导肿瘤细胞凋亡来抑制体内外肿瘤细胞的生长,可能是通过激活caspase-3、聚ADP核糖多聚酶(PARP)和抑制Bcl-2、Bcl-xl、X连锁凋亡抑制蛋白(XIAP)表达等机制来诱导细胞凋亡。
2.5 改善肾脏功能伍小波等[54]对昆明山海棠治疗大鼠慢性肾炎的作用机制进行探讨,结果发现昆明山海棠可以调节大鼠血清和肾组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、NO合酶(NOS)、NO等的活性,从而改善自由基对机体产生的损伤。昆明山海棠可以显著降低肾炎大鼠血清中的IL-1、IL-6、TNF-α这3种细胞因子的量,同时使大鼠尿蛋白、血肌酐和血尿素氮量降低。昆明山海棠可能通过TGF-β1/Smads通路对系膜增生性肾炎产生治疗作用,并且和泼尼松联合用药可以提高治疗效果,降低肝肾毒性[55]。
2.6 其他作用 2.6.1 抗病毒作用昆明山海棠中的倍半萜类生物碱具有良好的抗HIV活性,其中雷公藤素B的抗HIV活性很高,EC50小于0.1 μg/mL,体外治疗指数(TI)大于1 000[32]。Ren等[56]采用细胞病变效应分析(CPE)、空斑减少实验和RT-PCR分析昆明山海棠THHta的体外抗单纯疱疹病毒1型(HSV-1)活性,结果表明THHta的细胞毒性小(CC50为46.6 μg/mL),其半数抑制浓度为6.5 μg/mL,并具有很强的细胞病变抑制活性;THHta可以抑制早滞期基因UL30、UL39和晚期基因US6的转录。
2.6.2 镇痛作用卢珑等[57]采用小鼠醋酸扭体法、小鼠热板法和大鼠热辐射法比较紫荆皮、紫金皮、昆明山海棠的镇痛效果,3种药材都具有很好的镇痛效果,其中昆明山海棠镇痛效果最佳。
2.6.3 杀虫作用昆明山海棠对6种鳞翅目昆虫均具有一定杀灭作用,其中主要的杀虫活性成分为雷公藤春碱、雷公藤吉碱、雷公藤定碱和雷公藤榕碱等生物碱成分[58]。
2.6.4 预防急性肺损伤(ALI)ALI是急性呼吸窘迫综合征(ARDS)的早期阶段,具有很高的致命性,目前临床上采用的机械通气和药物干预炎症因子等方法的治疗效果不是很理想。马希刚等[59]连续给小鼠ig火把花根片10 d,剂量为600 mg/kg,然后用油酸造小鼠ALI模型,4 h后采集肺组织检测,结果发现火把花根片组相比于模型组,可以显著减轻ALI。
2.7 基因毒性昆明山海棠提取物可作为非整倍体诱导剂诱导小鼠骨髓细胞和精细胞中的8号染色体非整倍体化,并且在骨髓细胞中产生非整倍体的频率高于精细胞。昆明山海棠在临床使用中可能会对患者产生一定的基因毒性[60, 61]。
3 临床应用 3.1 类风湿关节炎张忠祥等[62]用火把花根片对12例类风湿关节炎(RA)患者进行治疗,平均治疗82.7 d后综合评定,显效4例,好转7例,无效1例,总有效率91.7%。老年类风湿关节炎(EORA),起病急、致残率和致死率明显高于轻中年起病的RA,范仰钢等[63]用昆明山海棠联合小剂量甲氨蝶呤(MTX)治疗EORA,治疗组40例患者,24周后疗效达到82.5%,日常生活能力、关节肿胀指数等指标方面都优于对照组。
3.2 银屑病银屑病是一种慢性炎症性皮肤病,较难治愈。昆明山海棠治疗123例寻常型银屑病患者,有效率为90.2%,显效率为57.7%,显效多在治疗后2~4周。徐艳等[64]用复方昆明山海棠联合复方甘草酸苷治疗86例寻常性银屑病,两药合用的效果比单一用药好。而且昆明山海棠对关节型和脓疱型银屑病均具有较好的治疗效果。
3.3 慢性荨麻疹荨麻疹是由于自身免疫引起的过敏性皮肤病,其中慢性荨麻疹是最顽固、最难根治的一种。临床上用昆明山海棠联合咪唑斯汀治疗慢性荨麻疹,均取得较好的疗效,联合治疗效果优于单用咪唑斯汀等化学药,虽然治疗过程中具有一定的副作用,但停药后均能恢复正常[65]。Zhong等[66]用昆明山海棠和盐酸西替利嗪片联合用药治疗69例慢性荨麻疹4周后,治疗组总有效率为67%,高于昆明山海棠组的63%和西替利嗪片组的24%。上述的临床效果说明昆阳山海棠在慢性荨麻疹的治疗上均有较好的发展前景,尤其联合用药。
3.4 肾炎蛋白尿火把花根片治疗糖尿病肾病大量蛋白尿患者取得较好的疗效,不但可以降低蛋白尿,还可以改善血脂代谢[67]。
3.5 甲状腺功能亢进薛洪霞[68]对30例甲状腺功能亢进患者进行治疗观察,发现昆明山海棠片治疗甲状腺功能亢进的疗效与临床常用药物甲基硫氧嘧啶相近,相对而言中药制剂毒副作用更小。
4 结语昆明山海棠始载于《本草纲目》,作为一种民间药物,主治跌打损伤、癌肿等疾病。本文对昆明山海棠的化学成分进行了系统的总结和归类,此外昆明山海棠也具有较好的药理活性和较广泛的临床应用。有关昆明山海棠的药理研究大部分局限于昆明山海棠粗提物或是中药制剂,有关其单一化学成分的研究较少,作用机制也不明确。因此,昆明山海棠的活性成分以及药理作用机制有待更加深入的研究,为今后临床的推广使用提供有力的科学依据。但是,昆明山海棠是雷公藤属植物,其化学成分与雷公藤非常相近,其活性成分(如二萜和生物碱)既是其有效成分,也是其毒性成分,在注重其药理作用研究的同时,也应该系统研究其毒理作用及机制。
| [1] | 李时珍. 本草纲目 [M]. 北京: 人民卫生出版社, 1977. |
| [2] | 南京中医药大学. 中药大辞典 [M]. 上海: 上海科学技术出版社, 2006. |
| [3] | 杨小红, 张伟程, 陈香. 火把花根的研究概况 [J]. 中医药临床杂志, 2007, 19(3): 315-317. |
| [4] | 王钺, 隆长锋. 中药昆明山海棠的研究进展 [J]. 医学综述, 2006, 12(11): 691-692. |
| [5] | 韩进庭. 昆明山海棠药理作用及临床应用研究进展 [J]. 现代医药卫生, 2009, 25(16): 2459-2460. |
| [6] | 孙辉, 蒋舜媛, 邓文龙, 等. 药用植物昆明山海棠研究进展及其资源可持续利用 [J]. 世界科技研究与发展, 2008, 30(1): 69-72. |
| [7] | 李顺英, 张超, 何黎, 等. 昆明山海棠的临床应用 [J]. 中国民族民间医药杂志, 2006(6): 325-330. |
| [8] | Shao H M, Ma J H, Guo T H, et al. Triptolide induces apoptosis of breast cancer cells via a mechanism associated with the Wnt/beta-catenin signaling pathway [J]. Exp Therap Med, 2014, 8(2): 505-508. |
| [9] | Wang C Y, Shi C F, Yang X P, et al. Celastrol suppresses obesity process via increasing antioxidant capacity and improving lipid metabolism [J]. Eur J Pharmacol, 2014 (744): 52-58. |
| [10] | Mi C L, Shi H, Ma J, et al. Celastrol induces the apoptosis of breast cancer cells and inhibits their invasion via downregulation of MMP-9 [J]. Oncol Rep, 2014, 32(6): 2527-2532. |
| [11] | 黄耀峰, 龚受基, 黄林, 等. 雷公藤和昆明山海棠植物根中化学成分的薄层色谱对比研究 [J]. 时珍国医国药, 2010, 21(8): 1973-1974. |
| [12] | 黄文华, 郭宝林, 斯金平, 等. 雷公藤属3种植物不同群体和个体中雷公藤甲素的研究 [J]. 中草药, 2005, 36(7): 110-113. |
| [13] | 黄文华, 张蕊, 郭宝林, 等. 雷公藤药材总生物碱含量及影响因素的研究 [J]. 中国中药杂志, 2008, 33(1): 15-18. |
| [14] | Liu Z Z, Zhao R H, Liu Y T, et al. A new dihydroagarofuranoid sesquiterpene from the roots of Tripterygium hypoglaucum [J]. J Asian Nat Prod Res, 2014, 16(3): 327-331. |
| [15] | Fujita R, Duan H Q. Takaishi Y. Terpenoids from Tripterigyum hypoglaucum [J]. Phytochemistry, 2000, 53(6): 715-722. |
| [16] | 易进海, 杨红, 张全. 昆明山海棠化学成分的研究 [J]. 中国中药杂志, 1994, 19(8): 489-490. |
| [17] | 吴大刚, 孙西昌, 李锋. 雷公藤属植物的新二萜内酯——山海棠素和雷藤素丙 [J]. 云南植物研究, 1979, 1(2): 29-36. |
| [18] | Duan H G, Kawazoe K, Bando M, et al. Di- and triterpenoids from Tripterygium hypoglaucum [J]. Phytochemistry, 1997, 46(3): 535-543. |
| [19] | Li C J, Xie F G, Yang J Z, et al. Two sesquiterpene pyridine alkaloids and a triterpenoid saponin from the root barks of Tripterygium hypoglaucum [J]. J Asian Nat Prod Res, 2012, 14(10): 973-980. |
| [20] | 刘珍珍, 赵荣华, 邹忠梅. 昆明山海棠根皮化学成分的研究 [J]. 中国中药杂志, 2011, 36(18): 2503-2506. |
| [21] | 王芳, 张瑜, 赵余庆. 昆明山海棠化学成分的研究 [J]. 中草药, 2011, 42(01): 46-49. |
| [22] | Zhao P, Wang H, Jin D Q, et al. Terpenoids from Tripterygium hypoglaucum and their inhibition of LPS-induced NO production [J]. Biosci Biotechnol Biochem, 2014, 78(3): 370-373. |
| [23] | 张彦文, 范云双, 王晓东, 等. 昆明山海棠中具有免疫抑制活性的二萜化合物 [J]. 中草药, 2007, 38(4): 493-496. |
| [24] | 丁黎, 张正行. 昆明山海棠茎化学成分的研究I [J]. 中国药科大学学报, 1991, 22(1): 25-26. |
| [25] | 张亮, 张正行, 盛龙生, 等. 昆明山海棠化学成分研究 [J]. 药学学报, 1993, 28(1): 32-34. |
| [26] | 丁黎, 张正行, 安登魁. 昆明山海棠茎化学成分的研究II [J]. 中国药科大学学报, 1991, 22(3): 175-176. |
| [27] | 张亮, 张正行, 安登魁. 昆明山海棠醚溶性化学成分研究 [J]. 中草药, 1998, 29(7): 441-442. |
| [28] | 黄晓春. 昆明山海棠总生物碱抗肿瘤活性及其主要成分分离分析的初步研究 [D]. 重庆: 第三军医大学, 2009. |
| [29] | 谢富贵, 李创军, 杨敬芝, 等. 昆明山海棠根皮化学成分研究 [J]. 中药材, 2012, 35(7): 1083-1087. |
| [30] | Li W W, Li B G, Chen Y Z. Sesquiterpene alkaloids from Tripterygium hypoglaucum [J]. Phytochemistry, 1999, 50(6): 1091-1093. |
| [31] | Duan H Q, Takaishi Y. Structures of sesquiterpene polyol alkaloids from Tripterygium hypoglaucum [J]. Phytochemistry, 1998, 49(7): 2185-2189. |
| [32] | Duan H, Takaishi Y, Imakura Y, et al. Sesquiterpene alkaloids from Tripterygium hypoglaucum and Tripterygium wilfordii: a new class of potent anti-HIV agents [J]. J Nat Prod, 2000, 63(3): 357-361. |
| [33] | Duan H Q, Takaishi Y, Bando M, et al. Novel sesquiterpene esters with alkaloid and monoterpene and related compounds from Tripterygium hypoglaucum: A new class of potent anti-HIV agents [J]. Tetrahedron Lett, 1999, 40(15): 2969-2972. |
| [34] | Duan H Q, Takaishi Y. Sesquiterpene evoninate alkaloids from Tripterygium hypoglaucum [J]. Phytochemistry, 1999, 52(8): 1735-1738. |
| [35] | Duan H Q, Kawazoe K, Takaishi Y. Sesquiterpene alkaloids from Tripterygium hypoglaucum [J]. Phytochemistry, 1997, 45(3): 617-621. |
| [36] | 张亮. 昆明山海棠单宁化学成分研究 [J]. 中国中药杂志, 1998, 23(9): 549-550. |
| [37] | 张迪, 凌雪, 濮社班, 等. 雷公藤甲素研究进展 [J]. 中国野生植物资源, 2014, 33(3): 27-31. |
| [38] | 任献青, 鲁静, 孟祥乐, 等. 雷公藤红素药理作用最新研究进展 [J]. 中华中医药杂志, 2013, 28(9): 2679-2682. |
| [39] | 张帆, 邹惠美, 崔道林, 等. THH对胶原诱导性关节炎大鼠模型病理评分的影响 [J]. 中国医学创新, 2014, 11(8): 13-14. |
| [40] | 骆耐香, 陈森洲, 李莎莎, 等. 昆明山海棠对胶原诱导型关节炎大鼠的作用及可能机制 [J]. 现代免疫学, 2012, 32(4): 287-292. |
| [41] | 白玲, 陈森洲, 梁爽, 等. 昆明山海棠对CIA大鼠模型中HIF-1α表达的影响 [J]. 细胞与分子免疫学杂志, 2011, 27(10): 1061-1064. |
| [42] | 张帆, 邹惠美, 崔道林, 等. 昆明山海棠对CIA大鼠IL-6、IL-17及IFN-γ含量的影响 [J]. 中外医学研究, 2014, 12(13): 138-139. |
| [43] | 刘彤云, 钱丽芬, 万屏, 等. 复方昆明山海棠对TNF-α诱导的人血管内皮细胞ICAM-1表达影响的试验研究 [J]. 皮肤病与性病, 2012, 34(2): 63-65. |
| [44] | 马珊珊, 何黎, 赵远, 等. 复方昆明山海棠颗粒对花生四烯酸致大鼠炎症模型的初步研究 [J]. 云南中医中药杂志, 2012, 33(2): 57-58. |
| [45] | 雷晴, 万屏. 昆明山海棠对小鼠迟发型超敏反应的免疫抑制作用 [J]. 山东医药, 2012, 52(47): 26-28. |
| [46] | 李晟, 徐开林, 李振宇, 等. 昆明山海棠提取物对异基因骨髓移植小鼠调节性T细胞的影响 [J]. 中国中西医结合杂志, 2009, 29(10): 910-914. |
| [47] | 黄思行, 刘剑毅, 黄文涛, 等. 昆明山海棠片所致大鼠睾丸损伤的病理学研究 [J]. 生殖与避孕, 2011, 31(8): 514-519. |
| [48] | 刘剑毅, 罗先钦, 黄思行, 等. 昆明山海棠对大鼠睾丸功能相关酶活性的影响 [J]. 毒理学杂志, 2011, 25(4): 290-292. |
| [49] | Wang D, Guo Y W, Shi D Z. Antifertility effects of crude ethanol extracts of Tripterygium hypoglaucum (Lévl.) Hutch in male Mongolian gerbils (Meriones unguiculatus) [J]. J Appl Anim Res, 2011, 39(3): 279-283. |
| [50] | 刘乐斌, 刘胜学, 胡孝贞, 等. 昆明山海棠总生物碱诱导肺腺癌A549细胞凋亡与细胞周期改变 [J]. 第三军医大学学报, 2007, 29(1): 18-20. |
| [51] | 黄晓春, 敖琳, 杨录军, 等. 昆明山海棠总生物碱诱导白血病细胞凋亡及其体外抗白血病活性 [A] // 第五届中国肿瘤学术大会论文集 [C]. 石家庄: 河北医科大学, 2008 |
| [52] | 黄晓春, 刘晋祎, 周燕虹, 等. 昆明山海棠总生物碱对人结肠癌HCT116细胞增殖和凋亡的影响 [J]. 第三军医大学学报, 2009, 31(22): 2246-2248. |
| [53] | Jiang X, Huang X C, Ao L, et al. Total alkaloids of Tripterygium hypoglaucum (Lévl.) Hutch inhibits tumor growth both in vitro and in vivo [J]. J Ethnopharmacol, 2014, 151(1): 292-298. |
| [54] | 伍小波, 徐嘉红, 罗先钦. 昆明山海棠对慢性肾炎大鼠血清与肾组织自由基及其调节酶的影响 [J]. 中药药理与临床, 2006, 22(4): 105-106. |
| [55] | 曾红兵, 常伟, 邵菊芳, 等. 昆明山海棠对实验性肾炎的干预作用及机制 [J]. 中国现代医学杂志, 2008, 18(8): 1036-1039. |
| [56] | Ren Z, Zhang C H, Wang L J, et al. In vitro anti-viral activity of the total alkaloids from Tripterygium hypoglaucum against herpes simplex virus type 1 [J]. Virol Sin, 2010, 25(2): 107-114. |
| [57] | 卢珑, 沈丽, 王雪妮, 等. 紫荆皮、紫金皮、昆明山海棠镇痛作用比较研究 [J]. 天津中医药大学学报, 2012, 31(3): 163-165. |
| [58] | 师宝君, 姬志勤, 张继文, 等. 昆明山海棠的杀虫活性及有效成分 [J]. 昆虫学报, 2007, 50(8): 795-800. |
| [59] | 马希刚, 金坤, 邵萍, 等. 火把花根预处理对油酸致大鼠急性肺损伤的作用研究 [J]. 宁夏医科大学学报, 2014, 36(3): 248-251. |
| [60] | Xu W, Ziqing L, Yinrun D, et al. Tripterygium hypoglaucum (Level) Hutch induces aneuploidy of chromosome 8 in mouse bone marrow cells and sperm [J]. Mutagenesis, 2004, 19(5): 379-382. |
| [61] | Wang X, Zhuo R, He Z. Aneuploidy induction by water extract from Tripterygium hypoglaucum (Lével) Hutch in mouse bone marrow cells [J]. Mutagenesis, 1993, 8(5): 395-398. |
| [62] | 张忠祥, 马朝俊. 火把花根片治疗类风湿性关节炎12例疗效观察 [J]. 中药药理与临床, 1990(5): 44. |
| [63] | 范仰钢, 李国华. 昆明山海棠联合甲氨蝶呤治疗老年起病类风湿关节炎 [J]. 现代医药卫生, 2006, 22(4): 478-480. |
| [64] | 徐艳, 万屏, 何黎. 复方昆明山海棠联合复方甘草酸苷治疗寻常性银屑病疗效观察 [J]. 临床皮肤科杂志, 2008, 37(5): 330. |
| [65] | 周君武. 昆明山海棠联合咪唑斯汀治疗慢性荨麻疹的疗效观察及安全性分析 [J]. 北方药学, 2012, 9(4): 10-11. |
| [66] | Zhong J, Xian D, Xu Y, et al. Efficacy of Tripterygium hypoglaucum Hutch in adults with chronic urticaria [J]. J Altern Complement Med, 2011, 17(5): 459-464. |
| [67] | 李旻瑶. 火把花根片治疗糖尿病肾病大量蛋白尿70例临床疗效观察 [J]. 中国医院药学杂志, 2014, 34(20): 1762-1764. |
| [68] | 薛洪霞. 昆明山海棠片治疗甲状腺功能亢进症30例疗效观察 [J]. 河北中医, 2012, 34(7): 1051-1052. |
 2015, Vol. 46
2015, Vol. 46


