植物在生长过程中总是受到不良环境因子的影响,包括非生物胁迫和生物胁迫[1]。为了适应各种胁迫植物自身逐步形成了一系列特有的形态结构特征和生理生化机制。在逆境胁迫下,植物体内的基因表达会发生变化,产生渗透调节物质,并且合成一系列的胁迫诱导蛋白,其中包括晚期胚胎富集(late embryogenesis abundant,LEA)蛋白。1981年,Dure等[2]首次在棉花种子胚胎发育后期发现了LEA蛋白。LEA蛋白广泛存在于高等植物中,是胚胎发育后期种子中高水平积累的一系列蛋白质。LEA基因受到干旱、脱水、盐渍、低温等胁迫因子和脱落酸(ABA)的诱导而大量表达[3]。
LEA蛋白是一个庞大的家族,Wise等[4]分析了拟南芥基因组中51种LEA蛋白,将其分为9个组,有研究证实其可能与植物的各种胁迫相关[5],并且不同的家族成员具有不同的序列特异性和空间结构特征,因而可通过不同的作用机制发挥作用。LEA蛋白有分子伴侣的作用,它可以和异常或变性的蛋白质结合防止细胞内蛋白质变性沉淀,保护敏感性的酶。另外大多数LEA蛋白具高度的亲水性,能将水分捕获到细胞内,保护细胞免受水分胁迫的伤害[6, 7]。利用转基因技术过表达LEA蛋白得到了一些抗旱、耐盐植株[8, 9, 10],为植物育种提供了新方法。目前LEA蛋白的研究已经成为一个热点,对该蛋白基因的深入研究可为揭示该家族蛋白基因的功能奠定一定的基础。
丹参Salvia miltiorrhiza Bunge为唇形科(Labiatae)鼠尾草属Salvia L. 植物,以其干燥根及根茎入药,在临床上被广泛应用于心脑血管疾病、癌症以及各种炎症的治疗[11, 12]。随着丹参资源的开发和利用,丹参药材的需求量日益增长。使用生物技术手段来挖掘丹参的抗逆基因并进一步研究植物抗逆机制,是筛选和培育优良丹参种质的有效策略。在前期研究中,从丹参EST文库中筛选并克隆得到一条胁迫相关基因SmLEA,推测该基因所编码的蛋白属于晚期胚胎蛋白LEA14家族成员[13, 14, 15]。SmLEA基因在丹参的根、茎、叶中均有表达,并且受到ABA、脱水、高盐和低温等诱导作用[16]。研究表明,SmLEA基因在大肠杆菌和丹参中过量表达后提高了大肠杆菌的耐盐性和丹参的耐盐、耐旱性[10]。为进一步深度挖掘丹参的抗逆基因和阐述丹参的抗逆机制,本研究从丹参中克隆得到一个新的LEA基因SmLEA2,采用生物信息学方法对该基因进行了预测和分析,通过实时荧光定量PCR检测分析SmLEA2的表达特征,初步预测该基因的功能,为该领域的研究提供一定的理论依据。
1 材料与方法1.1 材料
丹参Salvia miltiorrhiza Bunge种子经笔者鉴定后收集于陕西天士力植物药业商洛有限公司商州药源基地,在盛有蛭石-草木灰(2∶1)的土壤中萌发,将长至2~3 cm的幼苗移到营养钵中,在人工气候箱(宁波,RXZ型-500D)中培养,光照强度8 000 lx,光周期为光照16 h/黑暗8 h,温度(25±2)℃,湿度48%。培养2个月的丹参幼苗用于DNA、RNA的提取和各种胁迫处理。取苗龄2个月丹参不同部位的新鲜组织,用于基因器官特异性的表达检测。取二年生丹参的花苞(F1),盛开1 d(F2)、3 d(F3)、5 d(F4)的花,未成熟种子(S1),成熟种子(S2),用于基因不同发育时期的表达检测。
DNA提取试剂盒、RNA提取试剂盒和DNase消化试剂购自Omega公司;反转录试剂盒、限制性内切酶(Dra I/EcoR V/Pvu II/Stu I)、T4 DNA连接酶、PrimeScript®RT Reagent Kit、SYBR Green II Premix Ex Taq、pMD19-T simple vector、DL 2000 Marker购自TaKaRa公司;大肠杆菌DH5α为本实验室保存。
1.2 MeJA、ABA处理方法
茉莉酸甲酯(methyl jasmonate,MeJA)处理时,用500 μmol/L MeJA溶液喷洒于2个月龄的丹参实生苗叶表面,分别于处理后0、1、2、4、6、8、24、48 h取全株样品。ABA处理时,用100 μmol/L ABA溶液喷洒于二月龄的丹参实生苗叶表面,分别于0、1、2、4、6、8、10、24、48 h取全株样品。
所有样品收集后迅速置于液氮中速冻,置于−80 ℃冻存备用。
1.3 核酸提取
丹参基因组DNA的提取参照CTAB法[17]。用Omega公司试剂盒提取总mRNA,按照反转录试剂盒说明书,以总mRNA为模板合成cDNA第一链。
1.4 文库的构建
文库构建按照BD Genome WalkerTM Universal Kit(Clontech)试剂盒说明书进行。
1.5 丹参LEA蛋白的克隆
对丹参转录组数据库序列进行BLAST分析,发现Unigene55769_danshen(844 bp)与其他物种中已报道的LEA基因具有很高的相似度,命名为SmLEA2。在其序列两端设计,上游引物LEA2-S:5’-TTGCTCACTTCACTTGTTCTCG-3’;下游引物LEA2-A:5’-CTTCCCCGTTCTTCGCAAT-3’。分别以丹参cDNA和gDNA为模板进行 PCR 扩增。将扩增产物回收,连接至pMD19-T simple vector,转化大肠杆菌DH5α,挑取单克隆,经菌落PCR筛选阳性克隆送至华大基因进行测序。
根据SmLEA2基因已有的序列设计引物,采用DNA Walking方法扩增得到该Unigene的5’和3’端侧翼序列,所用引物见表 1。该过程包含2个独立的PCR扩增,每一个扩增由2步PCR反应组成,反应条件参照文献方法[16],PCR产物经过纯化克隆连接到pMD19-T simple vector,转化大肠杆菌DH5α,经菌落PCR筛选阳性克隆送至华大基因进行测序。利用DNAStar软件将DNA Walking所得序列进行拼接得到该基因的全长以及启动子区。在此基础上设计基因全长引物SmLEA2s:5’-ATGGCGTCTTATGATAAGCC-AG-3’;SmLEA2a:5’-AGTGATGAATGTATACCAG-CTAAGG-3’。以丹参cDNA和gDNA为模板进行扩增。
| 表 1 SmLEA2基因5’和3’端侧翼序列克隆所用引物 Table 1Primers used in cloning of 5’ and 3’ region of SmLEA2 gene |
SmLEA2基因采用DNAStar、NCBI、EBI以及ExPASy等生物信息学软件和数据库进行分析和预测[13]。蛋白和核酸序列的组成、理化性质和开放阅读框分析利用DNAStar、ProtParam、pI/MV和ORF Finder等在线工具进行;蛋白质信号肽和跨膜结构域用SignalP和TMHMM软件预测;通过在线工具ProtScale分析蛋白的亲水性/疏水性;利用SOPMA在线工具对蛋白质二级结构进行预测;多序列比对利用Clustal W2和BLAST等在线工具完成;通过MEGA4.0邻接法(Neighbor-Joining,NJ)构建系统树;基因转录起始位点利用Softberry TSSP工具预测;另外用PlantCARE Database分析启动子区转录应答元件。
1.7 SmLEA2基因的表达分析
分别以丹参根、茎、叶、花的不同发育时期以及经MeJA、ABA处理的样品cDNA为模板进行实时荧光定量PCR分析。以丹参3-磷酸甘油醛脱氢酶基因(GAPDH)为内参,对SmLEA2基因进行表达分析,引物见表 2。反应条件参照文献方法[18],数据分析采用“2−ΔΔCt”的方法计算相对表达量[19],并用SPSS 13.0中One-way ANOVA方法进行单因素方差分析,利用Tukey test分析各样品间基因表达的显著性(P<0.05)。
| 表 2 实时荧光定量PCR检测SmLEA2基因表达所用引物 Table 2Primers used for analysis on expression of SmLEA2 by real-time qPCR |
2.1 SmLEA2基因的克隆与生物信息学分析
根据Unigene55769_danshen片段,通过DNA Walking的方法获得了SmLEA2基因全长(图 1)。拼接后得到该基因gDNA长为1 961 bp,包含1个外显子和1个内含子,并且内含子处于起始密码子的上游,开放读码框960 bp,编码319个氨基酸(图 2)。SmLEA2基因编码的蛋白质相对分子质量为35 340,等电点为4.77,为稳定性蛋白。另外SmLEA2蛋白缺乏半胱氨酸和酪氨酸,而富含亲水性氨基酸,这是大多数LEA蛋白的特征。进行BLAST保守性区域检索,发现SmLEA2蛋白包含一个LEA-2蛋白结构域,与其他植物中LEA一样具有典型的LEA-2结构域。
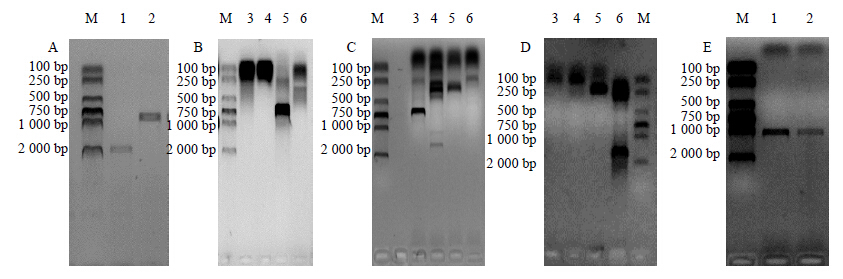 |
M-Marker A-不同模板Unigene55769_danshen片段的扩增,1-以基因组DNA为模板,2-以cDNA为模板 B、C-丹参SmLEA2基因5’侧翼区的2次扩增,3-用Dra I消化,4-用EcoR V消化,5-用Pvu II消化,6-用Stu I消化 D-SmLEA2基因3’侧翼区的扩增 E-SmLEA2基因开放阅读框验证 M-Maker. A-PCR amplification products of Unigene55769_danshen obtained using different templates. Lane 1, genomic DNA as template. Lane 2, cDNA as templates. B and C-PCR amplification products of the first and second cycles of 5’ flanking region of SmLEA2. Lanes showed different libraries used as template. Lane 3, digested with DraI, lane 4 with EcoRV, lane 5 with PvuII and lane 6 with StuI. D-PCR amplification products of 3’ flanking region of SmLEA2. E-PCR amplification products of SmLEA2 gene. 图 1 丹参SmLEA2基因及其5’侧翼区的扩增Fig.1 Analysis on size of SmLEA2 gene and its 5’ flanking region |
 |
a-SmLEA2基因的核酸序列及其编码的蛋白序列;b-SmLEA2基因的内含子序列(下划线表示) a-nucleotides sequence and deduced amino acid sequence of SmLEA2; b-intron of SmLEA2(designated by an underline) 图 2 SmLEA2基因核酸序列、编码蛋白序列以及内含子序列Fig.2 Nucleotide sequence, amino acid sequence, and intron DNA sequence of SmLEA2 |
蛋白质在细胞内的定位不同,预示着其将发挥不同的功能。SmLEA2蛋白无跨膜结构域和信号肽,定位在细胞质中,可能在细胞质中发挥作用。蛋白质的高级结构决定了蛋白质的生物功能,其预测分析对蛋白质的功能研究具有十分重要的意义。SmLEA2蛋白的二级结构预测显示该蛋白不规则卷曲为43.57%、延伸链为29.47%、α-螺旋为21.00%和β-转角为5.96%。SmLEA2蛋白主要是由不规则卷曲组成,其中α-螺旋和不规则卷曲有助于蛋白束缚水分子和盐离子[20, 21]。SmLEA2蛋白的三级结构具有1个α-螺旋和7个β-折叠,β-折叠呈反向平行。SmLEA2蛋白的三级结构预测可进一步揭示该蛋白的功能特征。
预测蛋白质的亲疏水性可为蛋白质的功能研究提供理论参考。SmLEA2的亲疏水性预测显示大部分氨基酸的分值为负值,从总体来说该蛋白为亲水性蛋白。其中氨基酸序列的两端多为亲水性氨基酸,中间多为疏水性氨基酸,预示着该蛋白在保护细胞脱水方面具有一定的作用。
2.2 同源性分析和系统发育比较蛋白比对(Protein-protein BLAST)结果显示,SmLEA2蛋白与GenBank已注册的可可蛋白(TcLEA2,XP_007026466)、刚毛柽柳蛋白(ThLEA,AHF21584)、红蓖麻蛋白(RcLEA14-A,XP_002533345)、拟南芥蛋白(AtLEA2,NP_181934)、蒺藜苜蓿蛋白(MtLEA14,XP_003617191)的一致性达到70%</ span>以上,相似性(positives)达到90%以上。对这6个蛋白进行蛋白序列比对分析的结果显示,SmLEA2在氨基酸序列第77~173位和第203~298位包含有在其他物种中已报道的LEA蛋白的保守功能域(图 3)。结合Blast-CD Search分析,SmLEA2具有结构域WHy,将SmLEA2归属于LEA-2超家族。
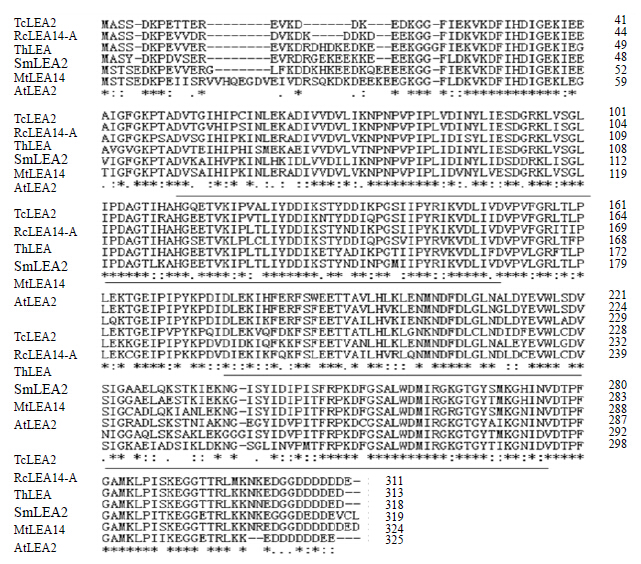 |
“*”表示6个蛋白都相同的氨基酸残基;“:”表示4个蛋白都相同的氨基酸残基;“•”代表 3个蛋白都相同的氨基酸残基;下划线表示WHy 结构域 “*”-incidates that six proteins with same amino acid residues; “:”incidates that four proteins with the same amino acid residues; “•”-incidates that three proteins with the same amino acid residues; WHy domain was underlined 图 3 SmLEA2与其他植物LEA 蛋白的多序列比对Fig.3 Comparison on amino acid sequence of SmLEA2 with that of other LEA proteins |
MEGA4.0软件平台上采用N-J方法构建系统进化树,对不同物种LEA氨基酸序列进行分子系统进化分析(图 4),包括上述同源序列比对5种蛋白,拟南芥LEA蛋白(AtLEA3、AtLEA5、AtLEA14、AtEM1、AtXER02),玉米LEA蛋白(玉米LEA3、玉米LEA14-A、玉米EMB5、玉米DHN1)和棉花LEA蛋白(DH11)。结果显示SmLEA2与抗逆蛋白TcLEA2和RcLEA14-A亲缘关系较近。
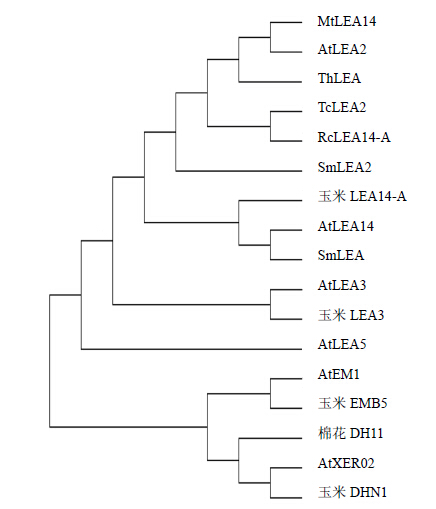 | 图 4 SmLEA2与其他相关LEA蛋白的系统进化树Fig.4 Phylogenetic tree of SmLEA2 with other related LEA proteins |
基因启动子由核心元件和转录调控区域2部分组成,核心元件包括TATA框和转录起始位点附近的起始子。对启动子区的分析有利于阐释基因的表达特征和调控机制。采用DNA Walking的方法获得SmLEA2基因5’启动子区长约860 bp的片段,该片段位于该基因内含子的上游,含有典型的植物启动子核心元件。软件预测发现SmLEA2基因ATG上游−983 bp处有1个TSS转录起始位点(图 5),并且该基因TSS的上游23 bp处有一个TATA box(真核基因转录核心元件)。启动子区有9个对转录效率有影响的CAAT box序列和1个5’ UTR Py-rich stretch元件。此外,该序列还包括多种顺式作用元件,包括ABRE、TGACG-motif、CGTCA-motif、ERE等与激素响应相关的顺式作用元件,MYB转录因子结合位点以及Box 4、CACGTGG-Box等与光诱导相关的元件等(表 3)。
 |
下划线表示核心启动子区 Promoter core region was underlined 图 5 SmLEA2基因启动子区序列及顺式作用元件Fig.5 Flanking region promoter sequence and cis-acting elements of SmLEA2 |
| 表 3 启动子区顺式作用元件的分析 Table 3Analysis on cis-acting elements of promoter sequences |
研究表明2个或2个以上ABRE元件可以激活ABA响应作用[22],在SmLEA2基因的启动子中,发现了5个ABRE元件。Abe等[23]发现MYB元件存在于拟南芥脱水应答基因rd22的启动子中,与脱水和ABA诱导有关。根据启动子区域中顺式作用元件的分析,推测该基因可能受到MeJA、ABA和逆境胁迫的诱导。
2.4 SmLEA2基因的表达特征分析基因的表达特征。结果表明:该基因为组成型表达基因,在丹参的根、茎、叶、花、种子中均有表达。在根、茎、叶中,SmLEA2基因在茎中的表达量最高(图 6-a);该基因在花和种子的各个发育时期表达量不同,SmLEA2的表达随着花的盛开和种子的成熟表达量显著上调,在S1中表达量最高,而在种子成熟后其表达量下降(图 6-b)。SmLEA2基因在不同部位和各个发育阶段中不均匀的表达可能与SmLEA2不同的功能密切相关。
 | *P < 0.05 ***P < 0.001 图 6 SmLEA2的表达分析Fig.6 Expression analysison SmLEA2 |
SmLEA2的表达响应MeJA的诱导(图 6-c),处理4 h后SmLEA2表达量显著上调,并在8 h达到峰值,约是对照(0 h)的3倍。 ABA处理后,SmLEA2的表达量呈上调趋势,在8 h达到峰值,约是对照(0 h)的52倍,8 h后该基因的表达量下降并趋于稳定(图 6-d)。
3 讨论LEA蛋白基因是植物体内一类重要的抗逆蛋白。本研究在丹参转录组数据库的基础上利用PCR技术和DNA Walking的方法克隆到了SmLEA2基因的全长(图 1)。SmLEA2与抗逆蛋白TcLEA2和RcLEA14-A亲缘关系较近(图 4),与拟南芥AtLEA2蛋白(NP_181934)的相似性高达90%以上,SmLEA2具有LEA-2结构域,属于LEA2大家族(图 3)。SmLEA2蛋白的二级结构主要表现为不规则卷曲,富含甘氨酸、赖氨酸等亲水性氨基酸,这也是LEA家族蛋白的特点,属于LEA蛋白成员。生物信息学分析SmLEA2与已报道的SmLEA蛋白具有类似的三级结构,但是它们的亲疏水性不同。SmLEA2为亲水性蛋白;SmLEA为疏水性蛋白,属于LEA14大家族[10],这预示着SmLEA和SmLEA2可能具有不用的功能和作用机制,这需要进一步的研究。
实时荧光定量PCR结果显示,SmLEA2基因为组成型表达基因,在丹参的根、茎、叶中均有表达,以茎中表达最为丰富(图 6-a)。SmLEA则在根中表达最为丰富,茎中表达量最低[13]。SmLEA2与SmLEA在不同部位的表达差异性,进一步暗示它们所发挥的功能或者发挥功能的作用机制有所不同。
在胚胎发育中,LEA蛋白在种子或胚胎的成熟时大量积累,在种子萌发时很快消失,这被认为是 LEA 蛋白在胚胎发育中呈现的特定表达模式[5]。实时荧光定量PCR结果显示,SmLEA2随着种子成熟其表达量逐步增加,而种子成熟后其表达量下降(图 6-b),预示着它在种子发育阶段中发挥着一定的功能。正常性种子发育末端都会发生成熟脱水事件,而SmLEA2蛋白在此阶段大量表达,表明该蛋白可能与种子的脱水耐性获得有着密切的关系。
利用DNA Walking的方法克隆获得了SmLEA2基因的5’侧翼序列(图 1-B、C)。经顺式作用元件预测(图 5),该区域含有多种与逆境胁迫相关的顺式作用元件,如ABRE、MYB、CGTCA-motif等,该基因可能受到MeJA、ABA和逆境胁迫的诱导。MeJA、ABA在植物各种环境胁迫应答中发挥着重要作用。MeJA参与 植物生长发育调控,并且与植物抗机械伤害和抗病性密切相关,可传导逆境信号并启动下游抗逆基因来提高植物的抗逆境胁迫能力[24]。实时荧光定量PCR分析结果显示,外源喷洒MeJA可显著诱导SmLEA2的表达(图 6-c)。由此推测,SmLEA2参与了丹参的抗逆反应过程。ABA参与控制植物生长和发育的多种生理过程,并且在植物抗逆性方面具有重要作用[25]。研究表明,某些LEA基因的启动子区域含有ABA响应元件(ABRES),胁迫信号通过ABA作用于响应元件,来调节LEA基因的表达[24]。结合实时荧光定量PCR结果表明SmLEA2的表达受ABA诱导(图 6-d),并可能通过ABA依赖型途径参与丹参的耐受胁迫的过程。
SmLEA基因受到ABA以及其他非生物因子如低温、高盐、干旱等的诱导[18],在大肠杆菌和丹参中过量表达该基因,验证了SmLEA基因与丹参的耐盐、耐旱作用有关[10]。SmLEA2基因可对MeJA和ABA做出响应,基因表达结果与预测的调控元件结果相符合。SmLEA2和SmLEA基因的表达都受到ABA的诱导,但它们的表达特征不尽相同。因此推测SmLEA2基因可能在丹参抗逆和防御反应中发挥作用,并且SmLEA2与SmLEA可能具有不用的作用机制,这需要进一步研究得到证实。
| [1] | 喻方圆, 徐锡增. 植物逆境生理研究进展 [J]. 世界林业研究, 2003, 16(5): 6-11. |
| [2] | Dure L, Greenway S C, Galau G A. Developmental biochemistry of cottonseed embryogenesis and germination: changing messenger ribonucleic acid populations as shown by in vitro and in vivo protein synthesis [J]. Biochemistry, 1981, 20(14): 4162-4168. |
| [3] | Peter F S, Shen Q X, David H T H. Structure and promoter analysis of an ABA-and stress-regulated barley gene HVA1 [J]. Plant Mol Biol, 1994, 26: 617-630. |
| [4] | Wise M. LEAping to conclusions: a computational reanalysis of late embryogenesis abundant proteins and their possible roles [J]. BMC Bioinformat, 2003, 4(2): 52-70. |
| [5] | 詹立平, 赵鑫, 邹学忠. 植物晚期胚胎富集蛋白的研究进展 [J]. 吉林林业科技, 2007, 36(2): 1-4. |
| [6] | Reyes J L, Rodrigo M J, Colmenero-Flores J M, et al. Hydrophilins from distant organisms can protect enzymatic activities from water limitation effects in vitro [J]. Plant Cell Environ, 2005, 28(6): 709-718. |
| [7] | Garay-Arroyo A, Colmenero-Flores J M, Garciarrubio A, et al. Highly hydrophilic proteins in prokaryotes and eukaryotes are common during conditions of water deficit [J]. Biol Chem, 2000, 275(8): 5668-5674. |
| [8] | Park S C, Kim C Y, Lee H S, et al. Sweetpotato late embryogenesis abundant 14 (IbLEA14) gene influences lignification and increases osmotic- and salt-stress tolerance of transgenic calli [J]. Planta, 233(3): 621-634. |
| [9] | Kim H S, Lee J H, Kim J J, et al. Molecular and functional characterization of CaLEA6, the gene for a hydrophobic LEA protein from Capsicum annuum [J]. Gene, 2005, 344(3): 115-123. |
| [10] | Wu Y C, Liu C L, Kuang J, et al. Overexpression of SmLEA enhances salt and drought tolerance in Escherichia coliand Salvia miltiorrhiza [J]. Protoplasma, 2014, 251(5): 1191-1199. |
| [11] | 中国药典 [S]. 一部. 2010. |
| [12] | 柳丽, 张洪泉. 丹参活性成分的现代中药药理研究进展 [J]. 中国野生植物资源, 2003, 22(6): 1-4. |
| [13] | 刘从龄, 王喆之. 丹参晚期胚胎蛋白基因SmLEA的克隆及表达分析 [J]. 生物技术通报, 2009, 30(5): 80-84. |
| [14] | 周宏骏, 武玉翠, 晋鑫鑫, 等. 丹参转录因子SmbHLH93的克隆及表达模式分析 [J]. 中草药, 2014, 45(23): 3449-3455. |
| [15] | 刘莉嘉, 杨鑫, 彭玉帅, 等. 丹参酮生物合成的关键酶研究进展 [J]. 中草药, 2015, 46(1): 140-147. |
| [16] | 刘从龄, 王喆之. 丹参晚期胚胎富集蛋白基因SmLEA的表达特征研究 [J]. 中国生物工程杂志, 2010, 30(1): 51-55. |
| [17] | Doyle J J, Doyle J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue [J]. Phytochem Bull, 1987, 19: 11-15. |
| [18] | Wang D H, Yao W, Song Y, et al. Molecular characterization and expression of three galactinol synthase genes that confer stress tolerance in Salvia miltiorrhiza [J]. J Plant Physiol, 2012, 169(18): 1838-1848. |
| [19] | Vandesompele J, de Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes [J]. Genome Biol, 2002, 3(7): 11. |
| [20] | Garay-Arroyo A, Colmenero-Flores J M, Garciarrubio A, et al. Highly hydrophilic proteins in prokaryotes and eukaryotes are common during conditions of water deficit [J]. Biol Chem, 2000, 275(8): 5668-5674. |
| [21] | Swire-Clark G A, Marcotte W R J. The wheat LEA protein Em functions as an osmoprotective molecule in Saccharomyces cerevisiae [J]. Plant Mol Biol, 1999, 39(1): 117-128. |
| [22] | Urano K, Maruyama K, Ogata Y, et al. Characterization of the ABA-regulated global responses to dehydration in Arabidopsis by metabolomics [J]. Plant J, 2009, 57(6): 1065-1078. |
| [23] | Abe H, Urao T, Ito T, et al. Arabidopsis AtMYC2 (bHLH) and AtMYB2(MYB) function as transcriptional activators in abscisic acid signaling [J]. Plant Cell, 2003, 15(1): 63-78. |
| [24] | Chong J J, Yang D D. Methyl jasmonate as vital substance in plants [J]. Trends Genet, 2003, 19(7): 409-413. |
| [25] | 童超. ABA生理功能与信号转导相关综述 [J]. 科技资讯, 2008(10): 44-45. |
 2015, Vol. 46
2015, Vol. 46


