中药饮片(processed pieces of Chinese materia medica)是中药材经炮制加工后可用于中医临床的产品,许多中药饮片来自于天然植物、昆虫、动物或矿物,自身带有大量微生物。中药饮片来源的多样性与加工、运输和储藏的随意性使得中药饮片极易受到微生物污染,并已影响到饮片自身和其下游中成药产品的质量和安全性[1, 2, 3, 4]。由于中药饮片样品的特殊性,其微生物检验方法与一般化学药和中成药在取样量、检验步骤和评价标准上均有不同。《欧洲药典》8.0版(EP 8.0)和《日本药典》16版(JP 16)中已明确收载了中草药(天然药物)微生物限度的检查方法和限度标准[5, 6]。
虽然,《上海市中药炮制规范》2008版已经收载了965个中药饮片品种,《中国药典》2010版一部中收载药材593种和饮片822种,但除直接入口的中药品种外都未规定微生物限度标准,也没有针对性的微生物检查方法[7]。我国中药饮片微生物检查方法和标准长期处于缺失状态。中药饮片的炮制过程多数较为简单,通过传统的挑拣和切制等传统工艺极可能带入新的污染。即使经过加热或酒精处理等工艺也不能完全去除潜在的微生物致病性风险[8],尤其是耐热菌和各类微生物的毒素残留[9, 10, 11]。中药饮片的微生物污染情况未能得到应有的关注,导致饮片中微生物污染相关的安全评价缺失。本研究通过对上海地区生产的常见的10种中药饮片微生物污染情况的调查,初步掌握中药饮片的生物污染负载水平,了解中药饮片的微生物危害因子,为中药饮片微生物污染风险评估和炮制过程中的微生物控制提供数据支持。
2 方法与结果 2.1 中药饮片样品采集本研究收集上海地区市场上常见的10种中药饮片共计94批次,由上海5家中药饮片生产厂家提供,分别为上海华宇药业有限公司(HY)、上海青浦中药饮片厂(QP)、上海康桥中药饮片厂(KQ)、上海虹桥中药饮片厂(HQ)和上海养和堂中药饮片厂(YHT)(表 1)。其中山慈菇采集到4个批次,其余9个品种均采集到10个批次,每批次样品量不少于100 g。样品均由笔者按《中国药典》2010年版各药材项下相关要求鉴定,结果见表 1。
| 表 1 试验所用中药饮片样品 Table 1 Processed pieces of CMM tested in this study |
称取25 g样品至无菌拍打袋中,加入pH 7.0氯化钠-缓冲蛋白胨水溶液225 mL,用均质器拍打1 min,静置1 min后取清液为1∶10供试液。按《中国药典》2015年版第3公示稿中“非无菌产品微生物限度检查:微生物计数法”(1105)检查需氧菌总数计数(TAMC)与霉菌和酵母菌总数计数(TYMC)。其中,TAMC检查采用1∶10供试液及其之后的5个连续的10倍梯度稀释液,TYMC(培养基中含庆大霉素0.1 g/L)检查采用1∶10供试液及其之后的4个连续10倍梯度稀释液。另取上述1∶10供试液10 mL,立即放入沸水浴中处理30 min,迅速冷却至室温。取经加热处理后的供试液,按TAMC检查方法测定耐热菌数。
2.2.2 需氧菌总数计数中药饮片是非无菌产品,在生产加工过程中微生物控制措施不严格,因此在全部样品中均检出需氧性微生物(表 2)。样品的TAMC结果介于101~108 CFU/g(图 1)。样品连翘和山慈菇的TAMC计数结果要高于其他饮片品种,平均污染量大于105 CFU/g。川楝子(炒)的TAMC结果是所有中药饮片中最低的,平均污染量为102 CFU/g。在川芎、甘草和山慈菇中,不同批次样品间的TAMC结果差异可达到4个数量级以上。
| 表 2 中药饮片样品微生物项目检验结果 Table 2 Microbial results of processed pieces of CMM |
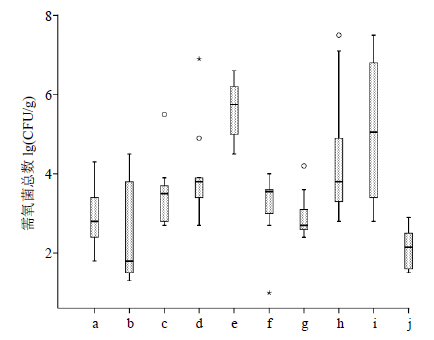 |
a-山药 b-炙甘草 c-玄参 d-川芎 e-连翘 f-赤芍 g-醋延胡索 h-甘草 i-山慈菇 j-川楝子 ○-代表离群数值 *-代表极端离群数值,下图同 a-Dioscoreae Rhizoma b-Glycyrrhizae Radix etRhizoma Praeparata cum Melle c-Scrophulariae Radix d-Chuanxiong Rhizoma e-Forsythiae Fructus f-Paeoniae Radix Rubra g-vinegar processed Corydalis Rhizoma h-Glycyrrhizae Radix etRhizoma i-Cremastrae Pseudobulbus j-Toosendan Fructus ○-mild outlier *-extreme outlier,same as following figures 图 1 中药饮片样品需氧菌总数计数结果Fig.1 TAMCresultsof processed pieces of CMM |
中药饮片中霉菌和酵母菌也是常见的微生物污染源[3]。本实验中除山药、炙甘草和醋延胡索有部分批次样品未检出霉菌和酵母菌外,其余7种饮片均检出霉菌或酵母菌(表 2),总体检出率为90.4%(85/94)。样品的TYMC污染程度介于101~107 CFU/g。连翘中的TYMC结果最高,平均污染量接近105 CFU/g。不同批次山慈菇样品之间的差异较大,最低污染量为101 CFU/g,而最高可以达到107 CFU/g(图 2)。
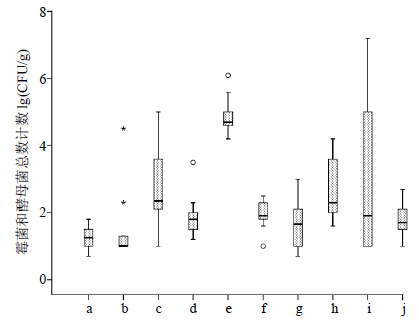 | 图 2 中药饮片样品中霉菌和酵母总数计数结果Fig.2 TYMC results of processed pieces of CMM |
本实验中所有种类的中药饮片均经100 ℃煮沸处理30 min后均能检出活性微生物,耐热菌总体检出率为76.6%(72/94),耐热菌污染程度介于100~104 CFU/g(图 3)。耐热菌的存活是中药饮片加工成中成药或煎煮汤药后产品变质腐败、导致药效下降的主要原因。微生物在药物中生长产生的代谢产物也会对患者健康产生未知的安全隐患。
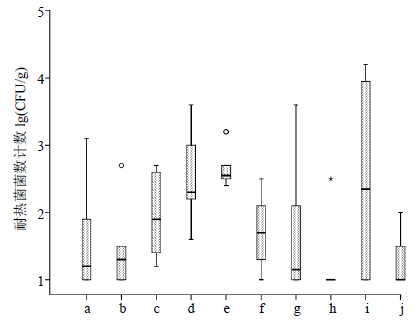 | 图 3 中药饮片样品中耐热菌计数结果Fig.3 Heat-resistant strains enumeration results of processed pieces of CMM |
按“2.2.1”中方法制备供试液,其余步骤按《中国药典》2015年版第3公示稿“非无菌产品微生物限度检查:控制菌检查法”(1203)的规定进行沙门菌、大肠埃希菌、耐胆盐革兰阴性菌(MPN法)、金黄色葡萄球菌、铜绿假单胞菌和白色念珠菌的检查。其中,对检出大肠埃希菌阳性的样品按EP 8.0中大肠埃希菌MPN定量方法重新检查。
分别按照食品安全国家标准GB 4789.5-2012和GB 4789.11(2010年征求意见稿)进行志贺氏菌和溶血性链球菌的检查。
2.3.2 耐胆盐革兰阴性菌检查对耐胆盐革兰阴性菌采用MPN定量方法进行检查,有21批样品检出阳性结果(表 3),占全部样品的22.3%(21/94)。其中,最高污染量可到达106<N<107 MPN/g。耐胆盐革兰阴性菌在103~106 MPN/g检出的样品占全部耐胆盐革兰阴性菌阳性样品的76.2%(16/21)。
| 表 3 中药饮片样品中耐胆盐革兰阴性菌计数结果 Table 3 Bile-tolerant Gram-negative bacteria results of processed pieces of CMM |
全部94批样品中仅有1批山慈菇样品检出大肠埃希氏菌阳性,经MPN定量方法检测结果为102 MPN/g<N<103 MPN/g。所有样品均未检出沙门菌、金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、志贺氏菌和溶血性链球菌。
2.4 微生物限度标准判断将94批中药饮片微生物检验结果分别与EP 8.0、JP 16和USP 37中相关的微生物限度标准进行比较。其中,EP 8.0“5.1.8”的A类产品(用于沸水浸出和煎煮的含有草药成分和含(或不含)有辅料的草药产品)、JP 16“G4 Microorganisms”中I类产品(需经沸水处理的产品)和USP 37膳食补充剂“2023”的“含植物成分及其制品”(使用前用沸水处理的植物)中对饮片微生物限度标准进行了规定。
按EP 8.0标准判断本次中药饮片样品的不合格率为5.3%(5/94);按JP 16标准判断不合格率为18.1%(17/94);按USP 37标准判断不合格率为23.4%(22/94)(表 4)。上述3个国家和地区的药典对中药类品种判断标准各不相同,但都对中药相关产品的微生物限度标准提出了要求。与化学药品的生产实施严格的GMP审查和监管不同,我国中药饮片的加工水平低,过程控制和风险控制体系目前无法有效达到外国药典的限度要求,也是我国药典迟迟无法推进中药饮片微生物限度标准制定的现实原因。
| 表 4 欧洲、日本和美国药典中草药(天然药物)相关微生物限度标准比较 Table 4 Comparison on microbial limit standards related to herbal drug (natural drug) in EP,JP,and USP |
根据炮制工艺中是否涉及加热处理步骤,将10种饮片分成2类。第Ⅰ类为炮制工艺不涉及加热处理的中药饮片;第II类为炮制工艺涉及加热处理的中药饮片,包括蜜炙、醋制、清炒、炒制、蜜炒、醋炒、盐炒和蒸制等。本实验中,采用IBM SPSS Statistics 19统计学软件对Ⅰ类和Ⅱ类炮制工艺样品的微生物计数进行配对t检验。其中,TAMC和耐热菌计数在I类和II类炮制工艺样品之间有极显著差异(P<0.01)(表 5),说明第II类中药饮片[炙甘草、醋延胡索和川楝子(炒)]的TAMC和耐热菌计数均整体低于第I类产品。涉及加温处理的炮制工艺能够有效降低中药饮片中细菌类污染。但是,经过第Ⅱ类工艺处理的饮片也存在高微生物污染的情况,可能的原因是加热工艺不能有效杀灭微生物(尤其是霉菌和酵母菌);饮片中耐热菌的存在和繁殖;贮存和运输等过程中引入的外源性污染。
| 表 5 Ⅰ类和Ⅱ类炮制工艺微生物负载配对t检验 Table 5 Statistical analysis on bio-burden of Type Ⅰ and Ⅱ process by t-test |
与中药材和中成药质量标准相比,中药饮片的微生物质量控制被长期忽视[12]。许多研究表明中药饮片普遍的受到多种微生物的污染[2, 13],由于缺少监控和调查,其微生物污染程度已经十分严重[14]。在对临床袋装饮片进行调查的结果显示,有10%以上的产品含有超过103 CFU/g的存活微生物污染[15, 16]。在实际污染中,有大量耐热微生物及多种耐热毒素(如:金黄色葡萄球菌肠毒素和黄曲霉素等)可以在饮片炮制和煎煮后保存活性,是患者用药的巨大隐患[9, 10, 11]。有研究表明,中药饮片在制作成袋装煎煮液后仍有不同程度的微生物污染,是导致饮片汤剂保质期缩短的主要原因[17]。中药饮片作为中成药和中药汤剂等的最主要中间体需要国家层面制定更有效的控制标准进行规范。
中药在日本和欧盟都被视为药品进行管理,但在美国仅作为营养和膳食补充剂进行管理,即保健品。但上述3个国家或地区的药典标准中,结合了中药的加工过程和使用方法,虽未明确说明适用于中药饮片,但标准规定的范畴已将其涵盖。这些标准中均有对TAMC、TYMC和相关控制菌的检查项目,给生产和加工过程提出了较为严格的要求。由于缺少对中药饮片中微生物污染负载的全国性、系统性的统计数据和研究,同时考虑到中国中药产业的发展水平和生产现状,《中国药典》还无法向外国药典一样对中药饮片中TAMC和TYMC的限度做出统一规定。但在中药饮片中增加对微生物限度的规定是规范中药产业生产安全性的必然趋势。目前,在《中国药典》2015版公示稿中已经对沙门菌和耐胆盐革兰阴性菌进行了规定。在《中国药典》增加中药饮片微生物污染限度标准仍然需要经历一段时间的数据积累和分析的过程。
目前,我国在饮片加工企业生产车间内还未形成有效的微生物污染控制体系,无论是原料控制、厂房环境和人员操作都极有可能引入各种微生物污染。虽然,我国有GMP对中药饮片厂的环境和条件进行约束,但要求过于宽泛,无法有效控制外源性污染物的混入。我国的饮片加工企业整体生产卫生条件较差,缺乏对环境的有效控制,一旦外源性致病因子混入,会造成无法控制的潜在隐患。因此,采用卫生指示菌计数(TAMC、TYMC和耐胆盐革兰阳性菌)作为评价样品加工过程中受微生物污染程度的重要指标,能够真实、有效地反映目前中药饮片在各个环节的卫生状况,是对中药饮片产品卫生水平的初步评估。
此外,本实验虽未检出沙门氏菌和金黄色葡萄球菌等致病微生物,但并不代表此类致病菌不会存在于饮片样品中。目前,《中国药典》规定采用TSB肉汤培养基进行第一步增菌是为了让受损伤的微生物恢复活力,但在较高的微生物污染背景下,非选择性的增菌也增加了对目标致病微生物生长的干扰,降低了检出率。本实验对10种中药饮片的致病菌项目都按《中国药典》2015年版公示稿进行了方法适用性检查,发现在选择性平板上虽有目标控制菌的典型菌落出现,但背景干扰十分严重,建议《中国药典》在中药饮片控制菌检查过程中适当增加培养基的选择性,以减少背景菌的干扰,提高目标控制菌的检出率。
本研究对上海地区生产的10种中药饮片进行微生物项目的检查,发现我国中药饮片整体卫生水平较低,微生物负载较高,即使经加热炮制处理,仍有大量残留微生物存活,是中药饮片使用中的一大安全隐患。建议进一步开展中药饮片微生物危害的风险评估工作,完善中药饮片微生物相关标准的制定,强化中药饮片生产过程管理和控制,保障中药饮片的使用安全。
| [1] | Enayatifard R, Asgarirad H, Kazemi-Sani B. Microbial quality of some herbal solid dosage forms [J]. Afr J Biotechnol, 2010, 9(10): 1701-1705. |
| [2] | Alwakeel S S. Microbial and heavy metals contamination of herbal medicines [J]. Res J Microbiol, 2008, 3(12): 683-691. |
| [3] | Czech E, Kneifel W, Kopp B. Microbiological status of commercially available medicinal herbal drugs-a screening study [J]. Planta Med, 2001, 67(3): 263-269. |
| [4] | 李闽真, 马群飞, 傅武胜. 市售中药材霉菌污染情况和优势种群分布的研究 [J]. 中国卫生检验杂志, 2013, 23(17): 3351-3355. |
| [5] | EP 8. 0. <2.6.12> [S]. 2014. |
| [6] | JP 16. <5.02> [S]. 2011. |
| [7] | 中国药典 [S]. 一部. 2010. |
| [8] | Egbebi A O. Microbiological safety of herbal drinks sold in Ado Ekiti Metropolis [J]. Adv Trop Med Pub Health Int, 2011, 1(2): 79-83. |
| [9] | 柳旭伟, 葛文霞. 金黄色葡萄球菌肠毒素 [J]. 微生物学杂志, 2008, 28(5): 86-91. |
| [10] | 范一灵, 潘峰, 史贤明. 金黄色葡萄球菌分子检测技术的常用靶基因 [J]. 微生物学杂志, 2008, 28(3): 72-77. |
| [11] | 吴兆蕃. 黄曲霉毒素的研究进展 [J]. 甘肃科技, 2010, 26(18): 89-93. |
| [12] | 毛菊敏, 李水福. 建议尽快完善中药饮片质量标准 [J]. 中草药, 2002, 33(9): 869-870. |
| [13] | 秦筱茂, 郭顺星. 药材霉菌及霉菌毒素污染现状分析 [J]. 中国中药杂志, 2011, 36(24): 3397-3404. |
| [14] | 张秋实. 中药饮片霉菌污染状况的调查 [J]. 甘肃中医学院学报, 1998, 15(2): 62-63. |
| [15] | 郭辉, 胡淑华, 王新华. 70种袋装饮片质量卫生学检查报告 [J]. 基层中药杂志, 1998, 12(2): 17-18. |
| [16] | 陶红. 影响中药煎剂微生物限度检查结果的因素及控制措施 [J]. 中国药房, 2010, 21(11): 1055-1056. |
| [17] | 梁学政, 陈惠红, 唐勇琛, 等. 袋装中药煎煮液的微生物限度检查 [J]. 广西中医药大学学报, 2013, 25(3): 156-158. |
 2015, Vol. 46
2015, Vol. 46


