2. 广东药学院中药学院, 广东 广州 510006
2. School of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China
茶树油(tea tree oil,TTO)是从桃金娘科(Myrtaceae)白千层属Melaleuea互叶白千层Melaleuca ahemifolia的新鲜枝叶中经水蒸气蒸馏得到的无色至淡黄色挥发油[1, 2],茶树油由100多种化学成分组成,其中松油烯-4-醇是主要活性成分,占茶树油30%~40%[3]。茶树油通过激活单核细胞而有效抑制炎性介质产生,抗菌谱广,对金黄色葡萄球菌、大肠杆菌、绿脓杆菌、白色念珠菌等具有较强的天然抗菌活性以及消炎作用,临床主要用于治疗痤疮、皮癣、手足癣、炎症丘疹、唇疱疹、化脓伤口等皮肤感染疾病[4, 5]。茶树油环保无污染、渗透性强,具有性质温和、高效低毒、无刺激性等优点,被广泛应用于日化、医药以及香精香料等行业[6, 7]。
微乳凝胶(microemulsion-based gels,MBGs)是将药物与适宜的油、乳化剂、助乳化剂、水按一定比例混合制得的微乳加入至凝胶基质中,形成澄清透明、均一稳定凝胶网状结构[8, 9, 10]。作为新型透皮给药载体,微乳凝胶具有微乳和凝胶的双重优点,能增加难溶性药物溶解度,提高生物利用度,降低药物毒性、刺激性和不良反应;同时能提高微乳的黏度,改善与皮肤黏附性和涂展性,延长药物滞留时间,克服微乳流动性强、生物黏附性差、难以涂布以及微乳因长期贮存时水分蒸发而导致乳化剂浓度升高引起的皮肤刺激性问题,从而促进水难溶性药物的释放和吸收[11, 12, 13]。微乳凝胶均匀细腻,具有良好的生物相容性和稳定性,无油腻感、易洗除,对皮肤与黏膜无刺激性[14],且易被机体代谢,适合于皮肤局部外用治疗,可作为易挥发、水难溶性药物的新型透皮给药载体。
因此,本实验针对茶树油水溶解度低、易挥发,且因使用浓度过大、用药时间过长或贮藏不当可能引起的皮肤干燥、瘙痒等刺激性问题[15],结合微乳凝胶的优点,将茶树油制成微乳凝胶,以期达到增加茶树油溶解度、提高稳定性、降低刺激性、改善药物透皮吸收、增强药物疗效的目的,为进一步研究与开发茶树油新剂型提供依据。
1 仪器与试剂BP211D型十万分之一电子分析天平,德国赛多利斯集团;JB-2型恒温磁力搅拌器,上海智光仪器仪表有限公司;IS126型pH酸度计,上海豪迈仪器科技有限公司;Zetasizer Nano ZS90型纳米粒度及Zeta电位分析仪,英国Malvern公司;NDJ-8S型旋转式数字黏度计,上海昌吉地质仪器有限公司;UV-1102型紫外可见分光光度计,上海天美科学仪器有限公司;TGL-16G台式离心机,上海安亭科学仪器厂。茶树油,广西南宁万家辉香料有限公司,质量分数91.93%(以挥发性成分总量计算),松油烯-4-醇38.02%,批号20140418;辛酸癸酸聚乙二醇甘油酯(Labrasol,批号146070)、二乙二醇单乙醚(transcutol P),法国Gattefosse公司;聚氧乙烯氢化蓖麻油(Cremophor RH-40,批号57184468E0)、聚氧乙烯醚(35)蓖麻油(Cremophor EL-35,批号50526668E0)、15-羟基硬脂酸聚乙二醇酯(Solutol HS-15,批号21464288Q0),德国BASF公司;聚山梨酯80(Tween 80,批号20130401)、聚乙二醇400(PEG 400,批号20121201)、1,2-丙二醇(批号20120401),南京威尔化工有限公司;甘油,国药集团化学试剂有限公司,批号20080522;卡波姆-980,廊坊聚通化工有限公司,批号14180;甲醇(批号2014801,分析纯)、三乙醇胺(批号100125),天津富宇精细化工有限公司;水为超纯水;其他试剂均为市售分析纯。
2 方法与结果 2.1 茶树油微乳的处方筛选与优化 2.1.1 微乳的制备称取茶树油、乳化剂适量,加入至助乳化剂中,水浴加热至完全溶解,搅拌均匀得澄清透明的油相混合物,于恒温磁力搅拌下将该油相混合物滴入适量蒸馏水中乳化,制得微乳。
2.1.2 乳化剂与助乳化剂的配伍试验分别以Tween 80、Cremophor RH-40、Cremophor EL-35、Solutol HS-15为乳化剂,以PEG 400、transcutol P、1,2-丙二醇与甘油为助乳化剂,将茶树油、乳化剂与助乳化剂按质量比2∶2∶1混合,固定总质量为0.50 g,于40 ℃恒温水浴加热溶解,搅拌均匀得油相混合物,将该油相混合物逐滴滴入50 mL蒸馏水中乳化,以700 nm透光率(I,该波长药物、辅料自身无吸收,透光率仅与粒径大小成反比。透光率评分标准:100%~98%,30分;98%~90%,25分;90%~80%,20分;80%~70%,15分;70%~60%,10分;<60%,0分)、微乳液外观性状(II,评分标准:淡蓝、澄清透明,30分;淡蓝、半透明,25分;浅白、半透明,15分;乳白、不透明,10分;分层、油滴、絮状物,0分)、15 000 r/min离心30 min稳定性(III,评分标准:无变化,20分;分层、油滴、絮状物,0分)以及常温避光静置24 h的外观性状(IV,评分标准:澄清、无分层,20分;浑浊、无分层,15分;分层、油滴、絮状物,0分)为评价指标,I~IV比例分别为30%、30%、20%、20%,进行综合评分,考察乳化剂与助乳化剂的配伍情况,结果见表 1。当PEG 400为助乳化剂,Tween 80、
| 表 1 乳化剂与助乳化剂的配伍试验结果 Table 1 Compatibility test results of emulsifiers and co-emulsifiers |
Cremophor RH-40与Cremophor EL-35分别为乳化剂时均能形成澄清透明的微乳,透光率最大,乳滴粒径最小,且15 000 r/min离心30 min后无分层,常温避光静置24 h后微乳稳定。
2.1.3 伪三元相图的绘制根据配伍试验结果,分别称取适量茶树油、Tween 80与PEG 400;茶树油、Cremophor RH-40与PEG 400;茶树油、Cremophor EL-35与PEG 400,首先按乳化剂与助乳化剂的质量比(Km)=9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9配制一系列乳化剂与助乳化剂混合物,再将各混合物与茶树油分别以9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8、1∶9的质量比混合,固定体系总质量为1.0 g,30 ℃水浴加热溶解,搅拌均匀得油相混合物。于恒温磁力搅拌下分别将该油相混合物滴入50 mL蒸馏水中乳化,并进行综合评分,筛选出80分以上的处方。采用Origin 7.0软件绘制茶树油-Tween 80-PEG 400、茶树油-Cremophor RH-40-PEG 400、茶树油-Cremophor EL-35-PEG 400的伪三元相图,确定微乳区域,结果见图 1。由相图结果可知,与图 1-A、C相比,图 1-B的微乳区域面积最大,在此区域内茶树油能迅速乳化,且乳化效果较好。结合配伍试验与伪三元相图结果,筛选Cremophor RH-40为乳化剂,PEG 400为助乳化剂,且选择载油量最大、乳化剂用量相对少的处方为最优处方。因此,确定茶树油- Cremophor RH-40-PEG 400质量比为3∶6∶1。
 | 图 1 茶树油微乳伪三元相图Fig.1 Pseudo-ternary phase diagram of TTO microemulsion |
按质量比为3∶6∶1分别精密称取0.3 g茶树油、0.6 g Cremophor RH-40与0.1 g PEG 400,置于30 ℃水浴加热溶解,搅拌均匀得澄清透明的油相,将该油相分别于30、40、50、60 ℃恒温磁力搅拌下逐滴滴入50 mL蒸馏水中乳化,转速为100 r/min。分别以微乳外观性状、透光率以及药物相对质量分数为考察指标,考察乳化温度对茶树油微乳的影响,结果见表 2。茶树油微乳透光率随乳化温度的升高而降低,粒径随之而增大。当乳化温度为30 ℃时,所得微乳澄清透明,粒径最小,常温静置24 h仍澄清透明,且无分层、油滴以及絮状物析出。因此,选择30 ℃为茶树油微乳的乳化温度。
| 表 2 乳化温度对乳化效果的影响 (n = 3) Table 2 Influence of temperature on emulsification effect (n = 3) |
分别精密称取0.3 g茶树油,0.6 g Cremophor RH-40与0.1 g PEG 400,置于30 ℃恒温水浴加热溶解,搅拌均匀得油相混合物,将该油相混合物于30 ℃恒温磁力搅拌下分别滴入10、20、30、50 mL蒸馏水中乳化,以微乳外观性状与透光率为筛选指标,考察稀释倍数对微乳乳化效果的影响,结果见表 3。微乳的透光率随稀释倍数的增大而提高,粒径随之而减小。当蒸馏水≥30 mL,即稀释倍数≥100倍时,均能形成澄清透明的茶树油微乳,透光率均>85%,常温静置24 h微乳仍稳定。因此,选择油与水的质量比为1∶100。
| 表 3 稀释倍数对乳化效果的影响 Table 3 Influence of dilution multiple on emulsification effect |
称取卡波姆-980适量,加入甘油适量润湿,加蒸馏水至100 g,搅拌均匀,静置24 h使其充分溶胀,滴加体积分数为20%三乙醇胺溶液调pH至一定值,3 000 r/min离心10 min脱气,即得。
2.3.2 卡波姆-980用量的筛选称取卡波姆-980粉末适量,加入蒸馏水至100 g,搅拌均匀,静置24 h使其充分溶胀。以凝胶基质的外观性状、成型性、黏稠度、涂展性、黏度[(25±2)℃,4号转子,转速为12 r/min]为评价指标,考察卡波姆-980的用量分别为0.3%、0.5%、0.8%、1.0%、1.2%、1.5%时对凝胶的影响。其中,外观包括凝胶的澄清透明度、有无光泽、有无沉淀等;涂展性分为轻质-快速铺展、中质-慢速铺展与厚质-难以铺展。卡波姆-980用量的筛选结果见表 4。当卡波姆-980用量0.5%~1.0%时,均能形成澄清透明、无沉淀,色泽光亮、均匀细腻,黏稠度适中,易于涂布,且成型性较好的凝胶,符合凝胶基本质量要求。因此,选择卡波姆-980用量为0.5%~1.0%。
| 表 4 卡波姆-980用量的筛选结果 Table 4 Concentration screening results of carbopol-980 |
称取卡波姆-980粉末0.5 g,分别加入5、8、10、12、15 g甘油润湿,加蒸馏水至100 g,搅拌均匀,静置24 h使其充分溶胀。以凝胶的外观性状、黏稠度、油腻感、涂展性、黏度[测定条件(25±2)℃,4号转子,转速为12 r/min]与保湿率为考察指标,采用单因素考察甘油的用量范围,结果见表 5。
| 表 5 甘油用量的筛选结果 Table 5 Screening results of glycerol amount |
凝胶黏度随甘油用量的增加而增大,当甘油用量≥12%时,黏稠度、油腻感随之增强较为显著,凝胶不均匀,且外观结团现象明显,致使凝胶基质较难涂展。当甘油用量为5%~10%时,凝胶基质澄清透亮,均匀细腻,黏稠度适中,较易涂展且不油腻。因此,选择甘油用量为5%~10%。
2.3.4 pH值的筛选称取卡波姆-980粉末0.5 g,加入甘油8 g润湿,加蒸馏水至100 g,搅拌均匀,静置24 h使其充分溶胀作为凝胶基质,滴加体积分数为20%三乙醇胺溶液分别将凝胶基质pH值调至4.0、5.0、6.0、7.0、8.0。以凝胶的外观性状、成型性、黏稠度、涂展性与黏度[(25±2)℃,4号转子,转速为12 r/min]为考察指标,筛选合适的pH值范围,结果见表 6。
| 表 6 pH值的筛选结果 Table 6 Screening results of pH value |
凝胶黏度随pH值增大而增加,当pH值为4.0时,黏度较低,流动性较强,皮肤黏附性较差;当pH值为7.0~8.0时,较为黏稠,有明显结团现象,影响其皮肤涂展性;当pH值为5.0~6.0时,黏稠度适中,均匀细腻,且较易涂展。因此,选择体积分数为20%三乙醇胺溶液调节pH值为5.0~6.0。
2.4 正交设计优化凝胶处方根据单因素考察结果,初步确定空白凝胶的处方组成及其范围:卡波姆-980用量0.5%~1.0%,甘油用量5%~10%,体积分数20%三乙醇胺溶液调节pH值5.0~5.5。选取卡波姆-980用量(A)、甘油用量(B)、pH值(C)为考察因素,每个因素选择3个水平,采用L9(34) 因素水平表进行正交设计试验,以空白凝胶基质外观性状、黏稠度、油腻性与涂展性为评价指标,每个指标各占25分,计算并比较综合评分,筛选空白凝胶最优处方组成与比例。正交设计因素水平及结果见表 7,方差分析结果见表 8。
| 表 7 凝胶处方筛选的L9(34) 正交设计结果 Table 7 Results of L9(34) orthogonal test for prescription selection of gelatum |
根据表 7结果,采用直观分析法对正交设计结果进行极差分析,影响空白凝胶的因素由大到小依次为A(卡波姆-980用量)>B(甘油用量)>C(pH值),即卡波姆-980用量影响最大,其次是甘油用量,pH值影响最小。由正交设计结果得最优凝胶基质处方组成为A1B1C3。由方差分析结果可知,卡波姆-980用量、甘油用量与pH值的F值均<19.00(表 8),表明3者对凝胶基质的综合评分均无显著性影响(P>0.05)。因此,确定空白凝胶基质的最优处方为A1B1C3,即0.5%卡波姆-980、5%甘油、滴加体积分数为20%三乙醇胺溶液调pH值至5.5。
| 表 8 凝胶处方筛选方差分析表 Table 8 Analysis of variance results for prescription selection of gelatum |
根据配伍试验与伪三元相图筛选并优化处方,结合制备工艺考察,茶树油微乳制备方法如下:称取0.3 g茶树油、0.6 g Cremophor RH-40加入0.1 g PEG 400中,30 ℃水浴加热至完全溶解,搅拌均匀得澄清透明油相混合物,将该油相混合物于30 ℃恒温磁力搅拌下滴入30 mL蒸馏水中乳化,制得澄清透明、淡蓝乳光的茶树油微乳。称取0.5 g卡波姆-980,加入甘油5 g润湿,加蒸馏水至100 g,搅拌均匀,静置24 h使其充分溶胀作为凝胶基质。将茶树油微乳缓慢加至已溶胀好的20 g卡波姆-980凝胶基质中,搅拌均匀,滴加体积分数为20%三乙醇胺溶液调pH值至5.5,加蒸馏水至50 g,3 000 r/min离心10 min除去气泡,获得澄清透明、均匀细腻、黏稠度适中,且涂展性良好的茶树油微乳凝胶。
2.6 茶树油微乳凝胶的质量评价 2.6.1 外观性状茶树油微乳凝胶为澄清透明、均匀细腻、黏稠度适中,无油腻性,且涂展性良好的半固体凝胶。
2.6.2 粒径大小与Zeta电位测定取茶树油微乳适量,采用Zetasizer Nano ZS 90纳米粒度及Zeta电位分析仪测定,其粒径分布见图 2,Zeta电位分布见图 3。结果表明茶树油微乳平均粒径为(38.38±2.30)nm,多分散系数为0.654±0.039,粒度分布均匀;Zeta电位平均值为(-56.00±5.82)mV。
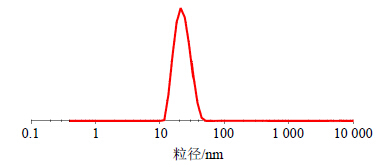 | 图 2 茶树油微乳的粒径分布图Fig.2 Particle size distribution of TTO microemulsion |
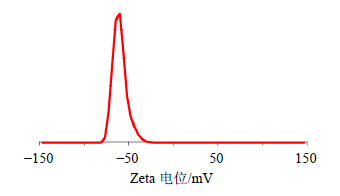 | 图 3 茶树油微乳Zeta电位分布图Fig.3 Zetapotential distribution of TTO microemulsion |
取3批茶树油微乳凝胶(批号分别为20150201、20150202、20150203)适量,分别测定pH值,结果茶树油微乳凝胶pH值分别为5.52、5.51、5.52,符合皮肤局部外用制剂对pH值的要求。
2.6.4 黏度的测定取3批茶树油微乳凝胶(批号分别为20150201、20150202、20150203)适量,采用NDJ-8S旋转式数字黏度计测定微乳凝胶的黏度,结果茶树油微乳凝胶的黏度分别为48 830、48 840、48 833 Pa∙s,RSD为0.01%(n=3)。
2.6.5 保湿率的测定取3批茶树油微乳凝胶(批号分别为20150201、20150202、20150203)适量,精密称定干燥至恒定的样品质量(m0),将微乳凝胶均匀涂布于载玻片上,将该玻片置于室温(25±2)℃、相对湿度(RH)为43%(饱和碳酸钾溶液)的恒温、恒湿密封干燥器中。经放置24、36、48 h后取出样品,分别精密称量样品放置不同时间的质量(mt),根据公式:保湿率=mt/m0,计算样品保湿率。结果3个批号茶树油微乳凝胶经放置24、36、48 h后保湿率平均值分别为(96.74±0.52)%、(95.55±0.51)%、(94.18±0.57)%,表明保湿性良好,有利于在皮肤上涂展。
2.7 茶树油微乳凝胶的定量测定 2.7.1 测定波长的选择(1)茶树油甲醇溶液:精密移取10 mg茶树油,甲醇溶解并定容至10 mL量瓶中,超声混匀,制得质量浓度为1.0 mg/mL茶树油甲醇溶液。精密量取1.0 mg/mL茶树油甲醇溶液1.2 mL,甲醇稀释并定容至10 mL量瓶中,超声混匀,制得120 μg/mL茶树油甲醇溶液。
(2)茶树油供试液:精密称取0.20 g茶树油微乳凝胶(约相当于茶树油1.2 mg),甲醇溶解并定容至10 mL量瓶中,超声混匀,制得质量浓度为120 μg/mL茶树油供试液。
(3)空白对照液:精密称取不含茶树油的空白微乳凝胶0.20 g,甲醇溶解并定容至10 mL量瓶中,超声混匀,制得空白对照液。以甲醇为空白参照,于200~400 nm进行紫外扫描,结果见图 4。空白对照液对茶树油的测定无干扰,且茶树油供试液与茶树油甲醇溶液于264.5 nm波长有最大紫外吸收。因此,选择264.5 nm作为茶树油紫外检测波长。
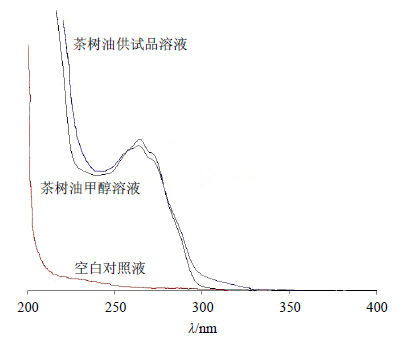 | 图 4 茶树油于甲醇中紫外扫描图谱Fig.4 UV scanning spectra of TTO in methanol |
精密移取10 mg茶树油,甲醇溶解并定容至10 mL量瓶中,超声混匀,制得质量浓度为1.0 mg/mL茶树油甲醇溶液。分别精密量取1.0 mg/mL茶树油甲醇溶液0.5、0.8、1.0、1.2、1.5、2.0 mL,甲醇稀释并定容至10 mL量瓶中,超声混匀,制得质量浓度分别为50、80、100、120、150、200 μg/mL茶树油溶液。分别以甲醇为空白参照,于264.5 nm测定吸光度(A)值,以A为纵坐标,茶树油质量浓度为横坐标进行线性回归,得回归方程:A=0.005 C-0.000 5,r=0.999 5。结果茶树油溶液在50~200 μg/mL线性关系良好。
2.7.3 样品测定分别取3批茶树油微乳凝胶(批号分别为20150201、20150202、20150203)各0.20 g(相当于茶树油1.2 mg),置于10 mL量瓶中,甲醇超声溶解并定容至刻度,混匀。于264.5 nm处测定A值,根据标准曲线计算茶树油微乳凝胶中的药物质量浓度。结果3个批次茶树油微乳凝胶中含茶树油的质量浓度分别为5.77、5.79、5.82 mg/g。
2.8 茶树油微乳凝胶的稳定性考察 2.8.1 高速离心试验取3批茶树油微乳凝胶(批号分别为20150201、20150202、20150203)适量,分别置于离心管中,10 000 r/min离心30 min,结果3批茶树油微乳凝胶离心后除去气泡,外观澄清透明,均匀细腻,无油水分离,未见分层、沉淀等不稳定现象,涂展性良好,表明茶树油微乳凝胶高速离心后稳定。
2.8.2 耐寒试验取3批茶树油微乳凝胶(批号分别为20150201、20150202、20150203)适量,于-5 ℃冰箱中放置24 h,取出后恢复至室温,结果与试验前无明显差异,外观仍澄清透明,均匀细腻,涂展性良好,无分层、泛粗、浮油、变稀以及油水分离现象,色泽无变化;3个批号茶树油微乳凝胶的pH值分别为5.52、5.51、5.52;黏度分别为48 839、48 847、48 856 Pa∙s,含茶树油分别为5.63、5.71、5.60 mg/g。
2.8.3 耐热试验取3批茶树油微乳凝胶(批号分别20150201、20150202、20150203)适量,于40 ℃烘箱中放置24 h,取出后恢复至室温,结果除茶树油质量浓度有一定下降外,其余指标与试验前无明显差异。外观仍澄清透明,均匀细腻,较易涂展,无分层、浮油、变稀以及油水分离现象,色泽无变化;3个批号茶树油微乳凝胶pH值分别为5.49、5.50、5.48;黏度分别为48 840、48 845、48 860 Pa∙s;分别含茶树油5.05、5.18、5.24 mg/g,表明制剂应低温贮存。
3 讨论 3.1 乳化剂的种类乳化剂种类及其用量是影响成乳能力以及乳滴粒径的重要因素,乳化剂过于亲水或过于疏水均不利于油相的乳化[16]。在制备O/W型微乳中,通常选用亲水亲油平衡值(HLB)8~18、毒性较小非离子型乳化剂。伪三元相图结果表明Cremophor RH-40乳化效果最好,形成相图微乳区域最大,这是由于非离子型乳化剂Cremophor RH-40的HLB值为14~16,尤其适用于含挥发油、香料或其他疏水物质的增溶并乳化在油与乳化剂形成的界面膜中,具有良好乳化性能和润湿能力,且Cremophor RH-40基本无毒,对皮肤无刺激性[17],已被广泛应用于局部外用制剂。
3.2 凝胶基质的用量根据《现代药物制剂技术丛书-经皮给药新剂型》[18],以凝胶外观性状、成型性、黏稠度、油腻感、细腻性、流动性与涂展性为评价指标,筛选凝胶基质的种类及其浓度。结果表明,选择卡波姆-980为凝胶基质,且用量为0.5%~1.0%时,成型性好、黏稠度适中,且涂展性良好,可延长药物在皮肤表面滞留时间。这是因为卡波姆-980为白色、疏松性粉末,具有较强的吸湿性和酸性,可溶于水、甘油等形成水或醇-水胶体溶液,在低质量分数时形成澄明溶液,在质量分数较大时形成半透明凝胶,是最常用的凝胶基质[19]。因此,通过调整卡波姆-980用量可以获得黏稠度适宜的基质。同时,卡波姆无毒、无刺激性,能吸收组织渗出液,增加药物作用,有利于分泌物的排除,尤其适宜治疗脂溢性皮肤病,已广泛应用于制剂领域。
3.3 甘油的用量凝胶剂因放置时间延长容易失水,出现结块硬化现象,或者因包装、贮藏条件不严密而形成干胶团,致使在皮肤上难以涂展,容易引起皮肤干燥、瘙痒等刺激性问题。因此,需要在凝胶基质中加入保湿剂以增强凝胶的稳定性与保湿性[20]。与1,2-丙二醇相比,甘油的保湿效果较好,且刺激性较小。因此,结合正交设计得甘油用量5%,所得茶树油微乳凝胶保湿性良好。
3.4 pH值的筛选卡波姆的黏稠度除了受浓度影响以外,还受介质pH值的影响。因此,通过调节pH值至适宜范围以获得黏稠度适宜的卡波姆凝胶。本实验通过单因素筛选得pH值为5.0~6.0,这是因为卡波姆分子结构中含有52%~68%的酸性基团,1%水分散体pH值为2.5~3.0,具有一定酸性,此时羧基几乎不解离;当用三乙醇胺等碱性物质中和后,羧基开始解离,离子化产生负电荷间相互排斥作用,使卷曲的聚合物分子链伸展,聚合物溶胀形成凝胶,黏度增加。当pH值为6.0~12.0时具有最大黏度;当pH值<4.0或pH值>12.0时黏度下降[21]。正交设计试验结果表明,调节pH值至5.5,所得卡波姆凝胶黏稠度适中,符合皮肤局部外用制剂对pH的要求。
3.5 药物的溶解温度茶树油微乳中的药物质量浓度随溶解温度升高而降低,这是由于茶树油具有挥发性,在预微乳制备中分别考察溶解温度与时间对茶树油微乳的影响,结果与30 ℃相比,40 ℃加热时所得茶树油微乳浓度下降,但当加热温度<30 ℃时,乳化剂Cremophor RH-40由液态变成固态,难以将茶树油乳化,这是由于Cremophor RH-40凝固点为21~23 ℃,呈白色、半固体状,当加热至30 ℃熔点时,Cremophor RH-40液化成淡黄色、黏稠状液体[17]。因此,为确保Cremophor RH-40较好的乳化,同时避免茶树油挥发,选择30 ℃为加热溶解温度,有利于茶树油微乳的形成与稳定。
3.6 乳化温度乳化温度影响微乳的外观性状、透光率与粒径大小。茶树油微乳的透光率随乳化温度升高而降低,粒径随之而增大,当乳化温度由30 ℃升高至40 ℃时,微乳透光率由91.5%下降至65.8%,溶液由澄清透明变为半透明,这是由于非离子型乳化剂水溶液温度升高时,分子热运动加剧,结合在氧原子上的水分子脱落,形成的氢键受到破坏,使其亲水性降低,乳化剂在水中溶解度下降,使原来透明的溶液变浑浊,影响其乳化能力[22]。因此,综合考虑Cremophor RH-40的熔点以及茶树油挥发性,选择30 ℃为乳化温度。
3.7 微乳与凝胶基质混合微乳与凝胶基质的混合方式对茶树油微乳凝胶有一定影响。在茶树油微乳中加入卡波姆-980凝胶基质粉末,与微乳静置24 h溶胀后所得茶树油微乳凝胶外观呈乳白色浑浊,澄清度下降,且药物质量浓度下降,这可能是因为当卡波姆-980粉末溶于茶树油微乳的水相时,改变了茶树油微乳处方中的油/水比例,破坏茶树油微乳结构,从而影响微乳的形成与稳定。除此之外,茶树油微乳凝胶中的药物质量浓度因茶树油挥发而导致其质量浓度下降。因此,本实验选择将茶树油微乳缓慢加至已溶胀好的凝胶基质中,所得茶树油微乳凝胶澄清透明、成型性好,黏稠度适中,pH值、保湿率等均符合局部外用制剂要求。
| [1] | Carson CF, Hammer K A, Riley T V. Melaleuca alternifolia (tea tree) oil: a review of antimicrobial and other medicinal properties [J]. Clin Microbiol Rev, 2006, 19(1): 50-62. |
| [2] | Carson C F, Riley T V. Safety, efficacy and provenance of tea tree (Melaleuca alternifolia) oil [J]. Contact Dermatitis, 2001, 45(2): 65-67. |
| [3] | Ninomiya K, Maruyama N, Inoue S, et al. The essential oil of Melaleuca alternifolia (tea tree oil) and its main component, terpinen-4-ol protect mice from experimental oral candidiasis [J]. Biol Pharm Bull, 2012, 35(6): 861-865. |
| [4] | Pazyar N, Yaghoobi R, Bagherani N, et al. A review of applications of tea tree oil in dermatology [J]. Int J Dermatol, 2013, 52(7): 784-790. |
| [5] | 胡忆雪, 姚雷, 黄健, 等. 茶树油对3种痤疮致病菌的抑制作用研究 [J]. 上海交通大学学报: 农业科学版, 2011, 29(1): 88-92. |
| [6] | Hammer K A. Treatment of acne with tea tree oil (melaleuca) products: A review of efficacy, tolerability and potential modes of action [J]. Int J Antimicrob Agents, 2015, 45(2): 106-110. |
| [7] | 李娟, 李小瑞. 茶树油的性质及其应用 [J]. 日用化学工业, 2003, 33(5): 323-325. |
| [8] | 祝雨薇, 蒋曙光, 周建平. 伊曲康唑温敏微乳凝胶的研制 [J]. 中国新药杂志, 2013, 22(16): 1942-1947. |
| [9] | Sabale V, Vora S. Formulation and evaluation of microemulsion-based hydrogel for topical delivery [J]. Int J Pharm Invest, 2012, 2(3): 140-149. |
| [10] | 党翔吉, 魏立明, 韩姗姗, 等. 复方栀子凝胶的处方工艺研究 [J]. 中草药, 2013, 44(21): 2982-2987. |
| [11] | Doktorovova S, Souto E B. Nanostructured lipid carrier- based hydrogel formulations for drug delivery: a comprehensive review [J]. Expert Opin Drug Deliv, 2009, 6(2): 165-176. |
| [12] | 林媛媛, 刘静, 王冬梅, 等. Box-Behnken试验设计法优化宝泻灵凝胶膏剂处方及其体外透皮特性研究 [J]. 中草药, 2014, 45(9): 1238-1244. |
| [13] | Sahoo S, Pani N R, Sahoo S K. Microemulsion based topical hydrogel of sertaconazole: formulation, characterization and evaluation [J]. Colloids Surf B Biointerfaces, 2014, 120: 193-199. |
| [14] | 王利胜, 张升, 刘丽萍, 等. 青藤碱微乳凝胶的制备及体外透皮特性研究 [J]. 中药新药与临床药理, 2011, 22(1): 21-24. |
| [15] | Hammer K A, Carson C F, Riley T V, et al. A review of the toxicity of Melaleuca alternifolia (tea tree) oil [J]. Food Chem Toxicol, 2006, 44(5): 616-625. |
| [16] | Cho Y H, Kim S, Bae E K, et al. Formulation of a cosurfactant-free O/W microemulsion using nonionic surfactant mixtures [J]. J Food Sci, 2008, 73(3): E115-121. |
| [17] | Rowe R C, Sheskey P J, Weller P J. 药用辅料手册 [M]. 郑俊民主译. 第4版. 北京: 化学工业出版社, 2005. |
| [18] | 郑俊民. 现代药物制剂技术丛书-经皮给药新剂型 [M]. 北京: 人民卫生出版社, 2006. |
| [19] | 梅清华, 励石寒, 高玲. 卡波姆凝胶制备的新方法 [J]. 中国医院药学杂志, 2006, 26(1): 82-83. |
| [20] | 郭红叶, 伊博文, 闫小平, 等. 新型辅料卡波姆在凝胶剂中应用现状 [J]. 中国实验方剂学杂志, 2013, 19(17): 371-374. |
| [21] | 苏杰, 张钧寿, 吴葆金, 等. 卡波姆-新型药物辅料 [J]. 中国药学杂志, 2000, 35(9): 579-581. |
| [22] | 王世荣, 李祥高, 刘东志, 等. 表面活性剂化学 [M]. 第2版. 北京: 化学工业出版社, 2010. |
 2015, Vol. 46
2015, Vol. 46



