2. 武警后勤学院, 天津市职业与环境危害防治重点实验室, 天津 300309
2. Tianjin Key Laboratory for Occupational and Environmental Hazard Prevention and Control, Logistics University of People's Armed Police Force, Tianjin 300309, China
在治疗复杂疾病的临床实践中,人们发现单靶点药物越来越难得到预期的治疗效果,而且,药物的使用常常伴随严重的毒副作用,制约了单靶点药物的进一步发展。随着网络药理学及系统生物学的发展,人们对疾病的发病机制和病理过程的研究更加透彻,发现复杂疾病(如肿瘤、艾滋病等)受多个基因的调控,病理过程涉及多重靶点以及多个相关信号通路的变化,因此,多靶点药物在复杂疾病的治疗中体现出巨大优势[1, 2]。
多靶点药物(multi-target drugs)能够同时作用于同一疾病的多个不同病理环节、多种不同靶点而发挥协同治疗作用,使总效应大于各单效应之和,以达到最佳的治疗效果。多靶点药物广义上讲,包括多组分多靶点药物和单组分多靶点药物。多组分多靶点药物已在复杂疾病治疗中得到广泛应用,如糖尿病和高血压等的联合用药以及抗免疫缺陷病毒(HIV)的高效抗逆转录病毒疗法(highly active anti-retrovirus therapy,HAART)。而严格意义上的多靶点药物是指单组分多靶点药物,即可以同时选择性作用于多个分子靶点的单组分药物。这类药物是同一分子里的不同基团协同作用的结果,与多组分多靶点药物相比,具有单一的理化性质和均一的药动学特性,可避免药物之间的相互作用及由此带来的毒副作用,具有减少服药量、便于服用等优点[3]。目前,主要通过筛选法和合理药物设计获得单组分多靶点药物,一些单组分多靶点药物在恶性肿瘤、心血管疾病等复杂疾病治疗领域已经取得了一定进展[4]。
艾滋病(AIDS)受到全球性的关注和防范,近年来新感染人数逐年下降,但随着感染者生命的延长,患者总数还在逐年上升,因此,新型抗HIV药物的研发和AIDS治疗方案的提升都十分必要。HIV分2种亚型HIV-1、HIV-2,其中HIV-1致病力强,一直是防治AIDS的重点。目前,已探明HIV-1的生命周期包括吸附、融合、逆转录、整合、转录和翻译以及装配及释放等多个环节,其中的逆转录酶(RT)、整合酶(IN)、蛋白酶(PR)、核糖核酸酶H(RNase H)、表面糖蛋白(gp120)、膜内蛋白(gp41)等都可作为抗HIV-1的药物靶点。治疗AIDS的上市药物有30多种,包括14种RT抑制剂、10种PR抑制剂、3种IN抑制剂、2种融合/进入抑制剂以及7种合剂[5]。但由于HIV-1的高变异性,几乎所有的药物都面临耐药,临床上广泛应用的HAART,虽然大大降低了AIDS的发病率和死亡率,但严重的毒副作用和药物耐受,仍使越来越多的患者难从现有常规药物治疗中受益,因此单组分多靶点抗HIV-1药物成为药物研发者关注的热点。
抗HIV-1单组分多靶点药物主要通过合理药物设计合成或筛选得到。我国天然产物资源丰富,近年来又发现了许多对艾滋病有效的中药,从中筛选出活性较好的HIV-1多靶点抑制剂,并对其结构进行改造,合成高活性衍生物,是开发抗HIV-1多靶点药物的重要途径。目前已经发现其中一部分黄酮类、苯丙素类、多糖类、三萜及其苷类、多酚类以及蛋白和肽类等化合物对HIV-1具有多靶点抑制作用[6]。本药物设计实验室利用分子模拟技术和计算机辅助药物设计方法,对中药化学数据库[7]和自建的抗HIV中药化学成分数据库[8]等进行虚拟筛选,从中也发现了一些针对HIV-1 IN和RNase H的双靶点抑制剂,并从分子水平揭示了其作用位点和作用机制[9]。本文将结合本实验室的工作,综述天然产物来源抗HIV-1多靶点抑制剂的研究进展。
1 黄酮类化合物黄酮类化合物(flavonoids)泛指2个具有酚羟基的苯环通过中央3碳原子相互连接而成的一系列化合物,具有广泛的药理活性,特别是具有抗HIV-1的活性。
从黄芩Scutellaria baicalensis Georgi中提取的黄酮类化合物黄芩苷(baicalin)和黄芩素(baicalein)都有多靶点抑制HIV-1的活性。黄芩苷不仅能结合于HIV-1 RNase H和IN,抑制RNase H和IN活性,而且还能干扰HIV-1囊膜蛋白与细胞表面的辅助受体结合,阻止HIV-1进入靶细胞[10, 11]。黄芩素则通过抑制HIV-1 RT的活性来抑制HIV-1的复制,IC50为37.97 μmol/L,此外黄芩素还可以结合到HIV-1 IN催化核心区域的疏水区,使IN结构发生改变,阻止HIV-1进入宿主细胞线粒体[12, 13]。邓联柏等[9]运用计算模拟技术,通过分子对接也显示黄芩素作用点位于HIV-1 RT的RNase H区域和IN的疏水区域。
Wang等[14]研究发现,从滇黄芩Scutellaria amoena C. H. Wright提取分离的灯盏花乙素(scutellarin)能不同程度地抑制重组HIV-1 RT的活性、阻断HIV-1吸附和融合。此外,在细胞实验和临床耐药病毒株实验中灯盏花乙素也显示出良好的抗HIV-1活性。
槲皮素(quercetin)存在于多种植物的花、叶、果实中,具有抗氧化、抗癌、抗病毒等多种生物活性。Mahmood等[15]从蔷薇科植物突厥蔷薇Rose damascene Mill. 分离得到槲皮素,研究发现槲皮素能够不可逆的抑制gp120与CD4细胞的结合,同时还能够抑制HIV-1 RT和PR的活性(EC50=330.86、66.17 μmol/L)。此外,Qian等[16]从桦木科植物硬桤木Alnus firma Sieb. -Zucc. 叶中分离得到槲皮素及其衍生物等14个化合物,通过活性研究发现槲皮素对HIV-1 RT和PR具有一定的抑制作用。以上具有抗HIV活性的黄酮类化合物的结构见图 1。
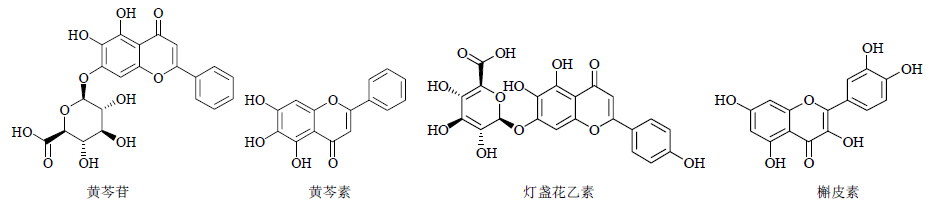 | 图 1 部分具有抗HIV-1活性的黄酮类化合物Fig.1 Some flavonoids with anti-HIV activity |
Tewtewkul等[17]从夹竹桃科植物黄夹竹桃Thevetia peruviana Schum.中分离得到一系列双糖及三糖黄酮苷,测定其对HIV-1 DNA依赖的DNA聚合酶活性(DDDP)和RNA依赖的DNA聚合酶活性(RDDP)及HIV-1 IN的抑制活性,发现其中8个化合物(表 1)可以同时抑制HIV-1 RT和IN。
| 表 1 来源于T. peruviana的HIV-1 RT和IN抑制剂活性 Table 1Inhibitory activity of HIV-1 RT and IN inhibitors from T. peruviana |
苯丙素类化合物(phenylpropanoids)是一类苯环与3个直链碳连在一起为单元(C6-C3)构成的化合物。这类化合物有的单独存在,有的是多个单元聚合存在,包括苯丙酸类、香豆素类和木脂素类等化合物。
2.1 苯丙酸类苯丙酸类化合物是由酚羟基取代的芳香环与丙烯酸构成的一类酚酸类化合物。申秀民等[18]研究发现苯丙酸二聚体迷迭香酸(rosmaric acid)能够抑制HIV-1 RT和IN的活性。其结构式见图 2。
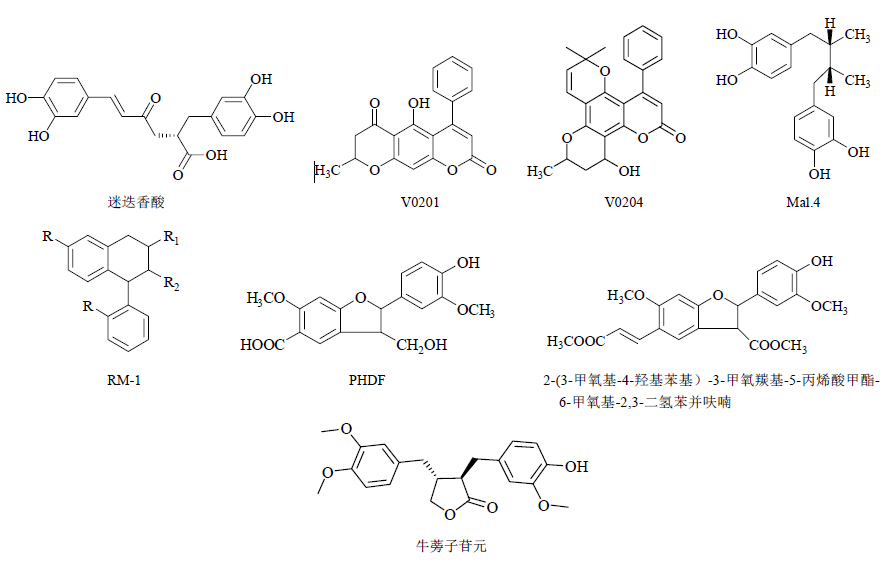 | 图 2 部分具有抗HIV-1活性的苯丙素类化合物Fig.2 Some phenylpropanoids with anti-HIV-1 activity |
香豆素类化合物(coumarins)是邻羟基桂皮酸内酯类成分的总称。20世纪90年代初在马来西亚的热带雨林植物藤黄科胡桐属植物胡桐(Calophyllum lanigerum)中,分离得到对HIV-1有强烈抑制作用的化合物calannolide A(EC50=0.1 μmol/L,IC50=20 μmol/L)[19]。董飚等[20, 21]合成的三环及四环双吡喃香豆素衍生物V0201和V0204显示出对HIV-1 RT和HIV-1 PR的抑制活性,可以作为抗HIV-1多靶点先导化合物进一步开发和研究。实验测得V0201抑制HIV-1 RT和PR的IC50分别为(0.78±0.10)μmol/L和(3.56±0.57)μmol/L;V0204抑制HIV-1 RT和PR的IC50分别为(15.15±2.15)μmol/L和(1.63±0.61)μmol/L。V0201和V0204的结构式见图 2。
2.3 木脂素类木脂素类化合物(lignans)是具有苯丙烷骨架的2个结构通过其中β,β′或C-8,8′相连形成的一类天然产物。这类化合物具有抗肿瘤、抗氧化、肝保护、杀虫、中枢神经系统保护以及抗HIV-1病毒等多种生物活性。芳基丁烷及芳基丁烯类木脂素Mal.4是来源于植物Larrea tridentataSesse & Moçiño ex DC. 的具有抗HIV-1活性的化合物,能够作用于HIV-1病毒复制周期的多个环节,不仅可以阻断HIV-1前病毒的转录,即在病毒生命周期开始前就起作用,而且可通过作用于HIV-1病毒基因末端重复87与40位之间特定的核苷酸序列来破坏Tat调节的复制[22]。
Fujihashi等[22]研究发现芳基环辛烷类木脂素的抗HIV-1活性主要是通过抑制HIV-1 IN的活性和逆转录过程而实现,其中二溴衍生物比其天然产物具有更强的活性,且具有更好的选择性。
杨颖等[23]从1 000多个天然产物中筛选得到具有抑制HIV-1病毒复制作用的化合物RM-1,RM-1是从润楠属植物中分离得到的二芳基丁烷类衍生物经系列结构改造而成,属于芳基萘类木脂素,IC50为0.420 μmol/L,与阳性药奈韦拉平(nevirapine)活性相当,且对HIV-1活病毒也有效。RM-1为RT双重抑制剂,其抑制RT的RDDP和RNase H的IC50分别为1.50、2.33 μmol/L。
苯并二氢呋喃新木脂素类化合物2-(4′-羟基- 3′-甲氧基苯基)-3-羟甲基-6-甲氧基-2,3-二氢苯并呋喃-5-甲酸(PHDF)是从新疆紫草Arnebia euchroma (Royle) Johnst中分离得到的具有抗HIV-1的有效成分。2-(3-甲氧基-4-羟基苯基)-3-甲氧羰基-5-丙烯酸甲酯-6-甲氧基-2,3-二氢苯并呋喃是合成PHDF的中间产物,张蕊等[24]通过初步筛选这个中间产物对HIV-1 PR、IN以及RT的活性结果表明,其在浓度为120.65 μmol/L时,对HIV-1 PR的抑制活性为61.0%,IC50为20.77 μmol/L,与阳性药茚地那韦(indinavir)比较相对较弱;抑制HIV-1 RT的IC50为164.81 μmol/L,与阳性药奈韦拉平(nevirapine)相比活性较弱;对HIV-1 IN无明显抑制作用。以上具有抗HIV活性的木脂素类化合物的结构见图 2。
此外,Jang等[25]从日本榧树Torreya nucifera (L.) Sieb. et Zucc. 树皮的甲醇提取物中获得木脂素牛蒡子苷元 [(-)-arctigenin],在体内可以抑制HIV-1 IN和拓扑异构酶II的活性。
3 多糖类化合物多糖类化合物(polysaccharides)是由10个以上单糖通过苷键连接而成的糖类化合物,按照来源分类可以分为植物类多糖、动物类多糖和真菌类多糖等。多糖具有广泛的生物活性,研究发现多糖类化合物除了具有抗HIV-1 RT和IN活性作用,能够阻断病毒的吸附和进入过程,还对HIV-1感染模型有明显免疫功能上调的作用[26]。
彭宗根等[27]研究发现,从牛膝Achy ranthesbidentata Blume中分离纯化获得的植物类多糖牛膝多糖(achyranthes bidentata polysaccharides)经硫酸酯化为牛膝多糖硫酸酯后,具有抗HIV-1 IN和RT的活性,IC50分别为(2.948±0.556)和(0.155±0.030)μmol/L。
目前,已在海藻中发现了不少具有抗HIV-1活性的天然产物,其活性成分为硫酸多糖。λ-角叉菜胶(λ-carrageenans)是第一个被发现具有抗HIV-1活性的天然硫酸多糖。体外实验证明其不影响正常细胞,但能阻断病毒对细胞的吸附,抑制HIV-1 RT活性。研究发现λ-carrageenans的抗HIV-1活性取决于亲水基团与疏水基团的比例关系。另外,甘草多糖能影响HIV-1病毒合胞体形成,阻断病毒的吸附和进入过程[28]。
Rusnati等[29]研究发现动物类多糖肝素(heparin)能与Tat结合,阻断HIV-1的复制转录过程,还能抑制病毒吸附和合胞化过程。此外,阎作伟等[30]通过分子模拟研究肝素与HIV-1膜表面蛋白gp120相互作用,推测肝素分子在体外实验中抑制HIV-1病毒进入细胞的原因是肝素分子阻挡了辅助受体和gp120蛋白的结合,导致gp120的构象变化受阻,使gp41无法进行细胞融合。
真菌类多糖聚酯sargassum能够抑制HIV-1 RT活性,干扰病毒与宿主细胞吸附,增强机体免疫,抑制Tat对PKCδ的活化[30]。
4 三萜及其苷类化合物多数三萜类化合物(triterpenoids)是由30个碳原子组成的萜类化合物,根据“异戊二烯定则”,多数三萜被认为是由6个异戊二烯缩合而成。该类化合物在自然界广泛存在,有的以游离形式存在,有的则与糖结合成苷的形式存在。三萜及其苷类具有广泛的生物活性,研究发现三萜类化合物具有抗HIV-1的活性,其中部分能够作用于HIV-1的多个关键酶。
甘草素(glycyrrhizin,GL)属于齐墩果烷型五环三萜类化合物,来源于甘草属植物甘草的根及根茎。研究表明其可通过抑制细胞膜蛋白激酶C和P的活性抑制HIV-1感染,还可通过抑制HIV-1 RT的活性而发挥作用,Nakashima等[31]和Harada[32]通过实验发现甘草素能够作用于HIV-1病毒的脂质双层质膜,通过降低膜的流动性来抑制病毒对宿主细胞的感染性。
熊果酸(ursolic acid)[33]是一种乌苏烷型的五环三萜类化合物,在植物中分布较广,研究发现其主要的作用靶点为HIV-1 RT、PR,抑制HIV-1复制的IC50为8.9 μmol/L。
白桦酸(betulinic acid)是天然的羽扇豆烷型三萜类化合物,具有较强的抗HIV-1活性,为了进一步改善其理化性质、药动学、生物利用度和抗HIV-1活性,研究者对其结构进行了一系列的改造,得到了一些多靶点抑制HIV-1活性的白桦酸衍生物。Kashiwada等[34]通过对白桦酸C-3位的修饰改造得到的化合物3-O-(3′,3′-二甲基琥珀酰基)-白桦酸(PA457)的EC50<3.5×10-4 μmol/L和治疗指数(TI)分别比白桦酸提高了4 000倍和2 000倍。作为一种新型HIV-1成熟抑制剂,< span lang="EN-US" xml:lang="EN-US">PA457作用于病毒复制的后期,抑制病毒衣壳蛋白前体p25裂解为成熟衣壳蛋白p24;对核苷和非核苷类RT抑制剂以及PR抑制剂的耐药病毒株都具有良好的抑制活性[35]。目前,PA457已完成临床II期评价[36]。以上具有抗HIV活性的三萜类化合物的结构见图 3。
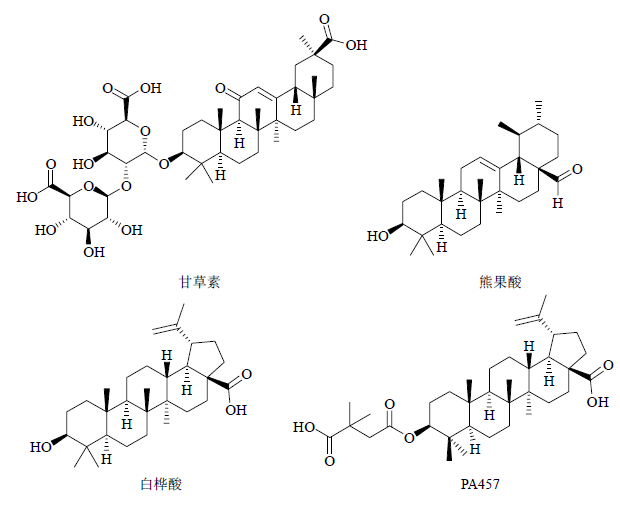 | 图 3 部分具有抗HIV-1活性的三萜类化合物Fig.3 Some triterpenoids with anti-HIV-1 activity |
多酚(polyphenols)是具有多个酚羟基的化合物,广泛存在于常见的植物性食物,如可可豆、茶、红酒、蔬菜以及水果中,具有抗氧化、抗肿瘤、抗菌、抗病毒等多种生物活性。
姜黄素(curcumin)来源于姜科植物姜黄Curcuma longa L. 的根茎,研究表明姜黄素抗HIV-1的分子机制包括抑制HIV-1 IN、PR、LTR活性、抑制HIV-1组蛋白和反式作用因子Tat的乙酰化以及显著降低HIV-1基因表达的作用[37],其中姜黄素分子抑制HIV-1 PR的IC50=100 μmol/L[12]。目前姜黄素已经进入AIDS患者的临床试验性治疗阶段。
紫草酸B(lithospermic acid B)是一种缩酚酸类多羟基化合物,为丹参的成分之一。彭宗根等[38]对紫草酸B的抗HIV-1活性研究表明,紫草酸B能够在体外抑制HIV-1 IN和PR,其IC50分别为(7.97±1.59)和(34.84±1.11)μmol/L,但对HIV-1 RT无效。
绿茶中的表没食子儿茶素没食子酸酯(EGCG)等儿茶素类化合物可通过多种途径作用于HIV-1,江筠等[39]从莲藕中分离得到没食子儿茶素 [(+/-)- gallocatechin]、儿茶素 [(-)-catechin],通过实验测定其抑制HIV-1 RT的IC50分别为10.41、9.58 μmol/L;同时,在浓度为228.56 μmol/L时,没食子儿茶素和儿茶素对PR的抑制率达< span lang="EN-US" style='letter-spacing:-.1pt' xml:lang="EN-US">17.61%和15.66%。而阳性对照PR抑制剂pepstatin A的抑制率仅为7.36%。此外,没食子儿茶素和儿茶素可提高细胞免疫应答水平,增强细胞抵御病毒感染的能力。儿茶素还可以通过下调肿瘤坏死因子-α(TNF-α)的表达和抑制Tat(反式激活因子,Tat通过核小体因子和特定的机制发挥转录激活的作用)对病毒LTR的激活直接抑制HIV-1的复制[40]。以上具有抗HIV活性的多酚类化合物的结构见图 4。
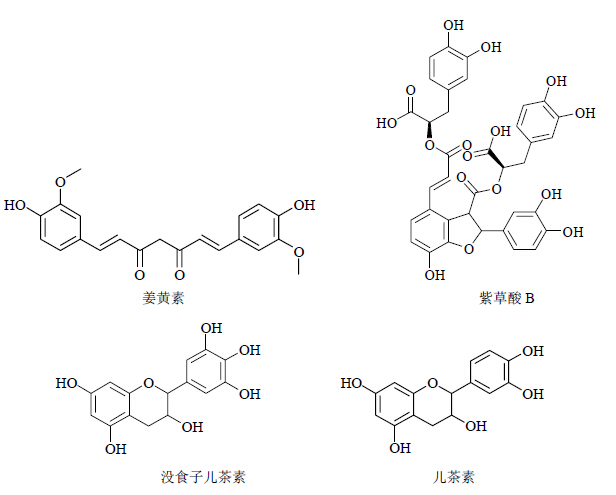 | 图 4 部分具有抗HIV-1活性的多酚类化合物Fig.4 Some polyphenols with anti-HIV-1 activity |
在HIV-1进入宿主细胞的过程中,病毒粒子的外膜糖蛋白(gp41和gp120)起到了关键作用。首先gp120与靶细胞上的CD4分子和辅助受体(趋化因子受体CCR5或CXCR4等)结合,导致gp41的构型发生改变,从而启动病毒包膜与靶细胞膜的融合。植物凝集素(phytohemagglutinin,PHA)是一类具有特异糖结合活性的蛋白,甘露糖特异结合的植物凝集素和N-乙酰氨基葡萄糖特异结合的植物凝集素可通过与包膜蛋白gp120及gp41上的特异性糖基化位点相结合抑制HIV-1与宿主细胞的融合,从而抑制HIV-1的复制[40, 41]。
一些动物来源的肽类和蛋白类化合物也具有多靶点抑制抗HIV-1病毒的作用。Ng等[42]通过对从牛奶中分离出的乳铁蛋白(lactoferrin,Lf)、乳过氧化物酶、glycolactin、lactogenin、α-乳白蛋白、β-乳球蛋白和酪蛋白7种蛋白质抑制HIV-1的RT、PR和IN的活性进行测试,发现其中Lf强烈抑制HIV-1 RT,对PR和IN只有较弱的抑制作用;α-乳白蛋白、β-乳球蛋白和酪蛋白抑制HIV-1 PR和IN,但对RT没有活性;glycolactin则能够强烈抑制HIV-1 PR和IN的活性,中等程度抑制HIV-1 RT的活性。
7 其他植物来源的HIV-1多靶点抑制剂醌类化合物(quinones)是分子内具有不饱和环二酮结构(醌式结构)或容易转变成这样结构的天然有机化合物。金丝桃素(hypericin)是从金丝桃科植物贯叶连翘Hypericum perforatum L. 等植物中分离得到的萘骈二蒽酮衍生物,能够作用于HIV-1病毒PR和RT[43]。曲晓波等[44]对金丝桃素分子结构及其与HIV-1病毒PR作用的分子动力学进行研究,阐明了金丝桃素与HIV-1 PR在酶的催化活性位点的氢键作用模式。胡冬华等[45]从分子水平研究金丝桃素与HIV-1 RT的相互作用,结果表明金丝桃素与HIV-1 RT以氢键相互作用和π-π相互作用结合。
Ishiyama等[46]从冲绳海绵Hippospongia sp. 中提取得到taurospongin A(图 5),分子中含有1个牛磺酸和2个脂肪酸残基。Taurospongin A对DNA聚合酶β和HIV-1 RT有不用程度的抑制作用,IC50分别为9.46和8.78 μmol/L,研究表明其抑制活性可能与磺酸功能团的存在有关[47]。
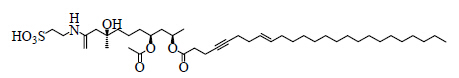 | 图 5 taurospongin A的结构Fig.5 Structure of taurospongin A |
通过对天然产物来源的HIV-1多靶点抑制剂进行综述,发现黄酮类化合物是HIV-1多靶点抑制剂来源最多的一类化合物,而且,这些多靶点抑制剂大多是抑制HIV-1 RT、IN和RNase H的活性,这些发现为下一步多靶点抑制剂的筛选指明了重点研究方向。目前,对天然产物抗HIV-1多靶点抑制剂的研究还处在起步阶段,特别是对抑制剂与酶相互作用的多靶点机制更有待进一步加强。应用虚拟筛选和计算机辅助药物设计等手段,可以加快HIV-1多靶点抑制剂先导化合物的发现进程;通过模拟靶蛋白与活性分子之间的相互作用,有助于分析多靶点HIV-1抑制剂的作用机制,并为发现新型抗HIV-1多靶点抑制剂的先导化合物及其结构改造提供理论支撑和技术指导。本课题组已在这方面做了一些工作,运用分子模拟技术和计算机辅助药物设计方法,通过构建抑制剂的药效团模型和靶蛋白的活性中心模型,从中药化学成分数据库中筛选得到多种结构类型的IN和RNase H双靶点抑制剂,并在分子水平揭示了它们抗HIV-1的多靶点机制[9, 48],为开发多靶点抗HIV-1药物奠定了理论基础。
| [1] | Park I W, Han C, Song X, et al. Inhibition of HIV-1 entry by extracts derived from traditional Chinese medicinal herbal plants [J]. BMC Compl Altern Med, 2009, 9(29): 1-12. |
| [2] | 郭彦伸, 郭宗儒. 多靶点药物分子设计 [J]. 药学学报, 2009, 44(3): 276-281. |
| [3] | 李爱秀. 多靶点药物的研究及筛选策略的提出 [J]. 武警后勤学院学报: 医学版, 2013, 22(11): 1030-1034. |
| [4] | 展鹏, 刘新泳, 李潇, 等. 抗艾滋病药物设计新策略: 多靶点及多价态结合配体 [J]. 中国药物化学杂志, 2013, 23(5): 406-416. |
| [5] | Ebrahim O, Mazanderani A H. Recent developments in HIV treatment and their dissemination in poor countries [J]. Inf Dis Rep, 2013, 5(Suppl 1): 2-7. |
| [6] | 刘延泽, 许利嘉, 肖伟, 等. 中医药抗艾滋病优势的科学分析与前景展望 [J]. 中草药, 2012, 43(9): 1672-1684. |
| [7] | 周家驹, 谢桂荣, 严新建. 中药原植物化学成分手册 [M]. 北京: 化学工业出版社, 2004. |
| [8] | 邓联柏, 李爱秀, 靳玉瑞, 等. 中药抗艾滋病复方中单味中药的运用情况分析 [J]. 中医学报, 2013, 28(177): 155-157. |
| [9] | 邓联柏, 李爱秀, 靳玉瑞, 等. 运用计算模拟技术揭示黄芩素抗HIV的新机制 [J]. 武警后勤学院学报: 医学版, 2013, 22(9): 753-755. |
| [10] | Muraglia E, Kinzel O, Gardelli C, et al. Design and synthesis of bicyclic pyrimidinones as potent and orally bioavailable HIV-1 integrase inhibitors [J]. J Med Chem, 2008, 51(4): 861-874. |
| [11] | Melamed J Y, Egbertson M S, Varga S, et al. Synthesis of 5-(1-H or 1-alkyl-5-oxopyrrolidin-3-yl)-8-hydroxy-[1,6]- naphthyridine-7-carboxamide inhibitors of HIV-1 integrase [J]. Bioorg Med Chem Lett, 2008, 18(19): 5307-5310. |
| [12] | Wu J, Attele A, Zhang L, et al. Anti-HIV activity of medicinal herbs: usage and potential development [J]. Am J Chin Med, 2001, 29(1): 69-81. |
| [13] | Ahn H C, Lee S Y, Kim J W, et al. Binding aspects of baicalein to HIV-1 integrase [J]. Mol Cells, 2001, 12(1): 127-130. |
| [14] | Wang Q, Ding Z H, Liu J K, et al. Xanthohumol, a novel anti-HIV-1 agent purified from Hops humuluslupulus [J]. Antivir Res, 2004, 64(3): 189-194. |
| [15] | Mahmood N, Piacente S, Pizza C, et al. The anti-HIV activity and mechanisms of action of pure compounds isolated from Rosa damascene [J]. Biochem Biophys Res Commun, 1996, 229(1): 73-79. |
| [16] | Qian K, Morris-Natschke S L, Lee K H. HIV entry inhibitors and their potential in HIV therapy [J]. Med Res Rev, 2009, 29(2): 369-393. |
| [17] | Tewtrakul S, Nakamura N, Hattori M, et al. Flavanone and flavonol glycosides from the leaves of Thevetia peruviana and their HIV-1 revrese transcriptase and HIV-1 integrase inhibitory activities [J]. Chem Pharm Bull, 2002, 50(5): 630-635. |
| [18] | 申秀民, 陈鸿珊, 彭宗根, 等. 丹参中的一个新化合物及其抗HIV活性 [J]. 中草药, 2004, 35(7): 725-728. |
| [19] | Kostova I. Coumarins as inhibitors of HIV reverse transcriptase [J]. Curr HIV Res, 2006, 4(3): 347-363. |
| [20] | 黎文海, 侯金明, 尤启冬, 等. 3,4-二取代香豆素类衍生物的合成及其对HIV-1逆转录酶的抑制活性 [J]. 中国药科大学学报, 2013, 44(1): 28-34. |
| [21] | 董飚, 马涛, 章天, 等. 吡喃香豆素衍生物对HIV-1的抑制作用及其构效关系 [J]. 药学学报, 2011, 46(1): 35-38. |
| [22] | Fujihashi T, Hara H, Sakata T, et al. Anti-human immunodeficiency virus (HIV) activities of halogenated gomisin J derivatives, new nonnucleoside inhibitors of HIV type 1 reverse transcriptase [J]. Antimicrob Agents Chemother, 1995, 39(9): 2000-2007. |
| [23] | 杨颖. HIV-1复制抑制剂的寻找及作用机制的研究 [D]. 北京:中国医学科学院北京协和医学院, 2012. |
| [24] | 张蕊. 新疆紫草抗HIV-1有效成分PHDF中间体的合成及活性筛选 [D]. 乌鲁木齐: 新疆医科大学, 2013. |
| [25] | Jang Y P, Kim S R, Kim Y C, et al. Neuroprotective dibenzylbutyrolactone lignans of Torreya nucifera [J]. Planta Med, 2001, 67(5): 470-472. |
| [26] | 张敏, 王军文. 单味中草药有效成分抗HIV-1作用机制的研究进展 [J]. 湖南中药杂志, 2013, 29(7): 152-153. |
| [27] | 彭宗根, 陈鸿珊, 郭志敏, 等. 牛膝多糖硫酸酯体外和体内抗艾滋病病毒作用 [J]. 药学学报, 2008, 43(7): 702-706. |
| [28] | 何伟, 张超, 王冬, 等. 抗HIV海洋天然活性成分及其作用机制研究概况 [J]. 中国海洋药物, 2004, 100(4): 43-45. |
| [29] | Rusnati M, Cohrini D, Oreste P, et al. Interaction of HIV-1 tat protein with heparin. Role of the backbone structure, sulfation, and size [J]. J Biol Chem, 1997, 272(17): 11313-11320. |
| [30] | 阎作伟, 胡远东, 李松, 等. 肝素与HIV-1膜表面蛋白gp120相互作用的预测和模拟 [J]. 高等学校化学学报, 2004, 25(3): 522-525. |
| [31] | Nakashima H, Matsui T, Yoshida O, et al. A new anti-human immunodeficiency virus substance, glycyrrhizin sulfate; endowment of glycyrrhizin with reverse transcriptase-inhibitory activity by chemical modification [J]. Jpn J Cancer Res, 1987, 78(8): 767-771. |
| [32] | Harada S. The broad anti-viral agent glycyrrhizin directly modulates the fluidity of plasma membrane and HIV-1 envelope [J]. Biochem J, 2005, 392(1): 191-199. |
| [33] | Lee J S, Miyashiro H, Nakamura N, et al. Two new triterpenes from the rhizome of Dryopteris crassirhizoma, and inhibitory activities of its constituents on human immunodeficiency virus-1 protease [J]. Chem Pharm Bull, 2008, 56(5): 711-714. |
| [34] | Kashiwada Y, Hashimoto F, Cosentino L M, et al. Betulinic acid and dihydrobetulinic acid derivatives as potent anti-HIV agents [J]. J Med Chem, 1996, 39(5): 1016-1017. |
| [35] | Stoddart C A, Joshi P, Sloan B, et al. Potent activity of the HIV-1 maturation inhibitor bevirimat in SCID-hu Thy/Liv mice [J]. PLoS One, 2007, doi: 10. 1371/journal. pone. 0001251. |
| [36] | Smith P F, Ogundele A, Forrest A, et al. Phase I and II study of the safety, virologic effect and pharmacokinetics/ pharmacodynamics of single-dose 3-O-(3',3'- dimethylsuccinyl) betulinic acid (bevirimat) against human immunodeficiency virus infection [J]. Antimicrob Agents Chemother, 2007, 51(10): 3574-3581. |
| [37] | Vajragupta O, Boonchoong P, Morris G M, et al. Active site binding modes of curcumin in HIV-1 protease and integrase [J]. Bioorg Med Chem lett, 2005, 15(14): 3364-3368. |
| [38] | 彭宗根, 高雷, 董飚, 等. 紫草酸B的抗HIV-1活性研究 [J]. 中国新药杂志, 2008, 17(5): 389-393. |
| [39] | 江筠, 王常荣, 李宁, 等. 莲藕抗氧化多糖的抗HIV-1整合酶作用研究 [J]. 南开大学学报, 2010, 43(4): 42-47. |
| [40] | Jiang Y, Ng T B, Liu Z K, et al. Immunoregulatory and anti-HIV-1 enzymeactivities of antioxidant components from lotus (Nelumbo nucifera Gaertn.) rhizome [J]. Biol Sci Rep, 2011, 31(5): 381-390. |
| [41] | Balzarini J, Laethem K V, Hatse S, et al. Profile of resistance of human immunodeficiency virus to mannose-specific plant lectins [J]. J Virol, 2004, doi: 10. 1128/JVI.78.19.10617-10627. |
| [42] | Ng T B, Lam T L, Au T K, et al. Inhibition of human immunodeficiency virus type 1 reverse transcriptase, protease and integrase by bovine milk proteins [J]. Life Sci, 2001, 69(19): 2217-2223. |
| [43] | Meruelo D, Lavie G, Lavie D, et al. Therapeutic agents with dramatic antiretroviral activity and little toxicity at effective doses: Aromatic polycyclic diones hypericin and pseudohypericin [J]. Proc Natl Acad Sci USA, 1988, 85(14): 5230-5234. |
| [44] | 曲晓波, 苏忠民, 胡冬华, 等. 金丝桃素分子结构及其与HIV病毒蛋白酶作用的分子动力学研究 [J]. 高等学校化学学报, 2009, 30(7): 1402-1405. |
| [45] | 胡冬华, 高颖, 邵琛, 等. 贯叶连翘有效成分金丝桃素与HIV逆转录酶相互作用的研究 [J]. 分子科学学报, 2008, 24(4): 280-283. |
| [46] | Ishiyama H, Ishibashi M, Ogawa A, et al. Taurospongin A, a novel acetylenic fatty acid derivative inhibiting DNA polymerase beta and HIV reverse transcriptase from sponge Hippospongia sp. [J]. J Org Chem, 1997, 62(12): 3831-3836. |
| [47] | Christopher J H, Shigeo Y, Steven V L, et al. Use of π-allyltricarbonyliron lactone complexes in the synthesis of taurospongin A: a potent inhibitor of DNA polymerase β and HIV reverse transcriptase [J]. Org Biomol Chem, 2003, 1(10): 1664-1675. |
| [48] | 邓联柏. 基于中药化学成分库筛选HIV核糖核酸酶H抑制剂及核糖核酸酶H与整合酶双重抑制剂 [D]. 石家庄: 河北医科大学, 2013. |
 2015, Vol. 46
2015, Vol. 46


