2. 温州医科大学药学院, 浙江 温州 325035
2. School of Pharmaceutical Sciences, Wenzhou Medical University, Wenzhou 325035, China
糖尿病肾病(diabetic nephropathy,DN)是慢性糖尿病微血管并发症之一。DN的病理分子机制很复杂,涉及不同种刺激因素和信号通路,包括肾素-血管紧张素系统(RAS)、炎症与自身免疫反应、氧化应激和糖代谢紊乱等,但是近年越来越多的研究显示炎症反应与DN的发生发展密切相关,并认为DN是一种炎症性疾病[1, 2, 3]。高血糖诱导肾脏组织中炎症信号通路和炎症介质水平上升以及炎性细胞浸润,随后导致肾细胞发生一系列的损伤性病理改变[2, 4]。通过抑制炎症反应缓解DN的发生发展已成为治疗DN的一种重要手段。
姜黄素(结构见图 1)是从姜科植物的根茎中提取的一种化学成分,具有多种药理活性,包括抗炎、抗肿瘤和抗氧化等[5],但是由于姜黄素具有化学结构不稳定、体内代谢快和生物利用度低等缺点,限制了其在临床中的进一步应用[6]。因此,国内外学者通过多种方法获得了结构稳定的姜黄素类似物[7],其中单羰基姜黄素类似物 (1E,4E)-1-(4-羟基-3-甲氧基苯基)-5-(2-硝基苯基)戊-1,4-二烯-3-酮(WZ35,结构见图 1)具有比姜黄素更强的体内稳定性和生物活性。前期研究发现WZ35具有较强的抗炎活性[8]。本实验利用链脲佐菌素(STZ< span style='font-family:宋体; letter-spacing:.2pt'>)构建小鼠1型糖尿病模型,观察WZ35对DN的缓解作用,检测血清和肾脏组织中的炎症因子和趋化因子的基因表达,初步探讨姜黄素类似物治疗DN的分子机制,为DN的治疗提供候选药物。
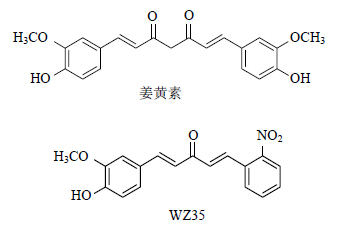 | 图 1 姜黄素及其类似物WZ35的化学结构Fig.1 Chemical structures of curcumin and its WZ35 |
姜黄素(国药集团化学试剂有限公司,批号F20111027,分析纯);WZ35(自制,质量分数>95%);STZ(Sigma);CD68抗体(Santa Cruz);M-MLV逆转录试剂盒(Invitrogen);苏木素-伊红染液,碧云天生物技术有限公司;尿素氮(BUN)和肌酐(Cr)试剂盒,南京建成生物工程研究所;SYBR Green PCR Premix HS Taq(Bio-rad);PCR引物(Invitrogen)。
1.2 仪器血糖仪和血糖试纸(B. BRAUN);酶标仪(Spectra max M2);石蜡包埋机(Thermo);石蜡切片机(LEICA);低温离心机(Thermo);电泳仪、曝光仪、RT-qPCR仪、PCR仪(Bio-rad);正置相差显微镜(Nikon);水浴锅(Sumsuny)。
1.3 动物雄性C57BL/6小鼠,体质量20~22 g,购自上海斯莱克实验动物有限公司,动物合格证号SCXK(沪)2012-0002。
2 方法 2.1 糖尿病模型的制备与给药40只C57BL/6小鼠,SPF动物房适应性饲养1周。随机分为对照组、模型组、姜黄素组和WZ35组,每组10只。模型组和给药组小鼠ip给予STZ 100 mg/kg,对照组小鼠ip柠檬酸缓冲液(pH 4.5)。自由取食取水1周后检测血糖,血糖高于12 mmol/L的小鼠视为造模成功。给药组小鼠每天ig给予姜黄素(20 mg/kg)[9, 10]和WZ35(20 mg/kg)[9, 10],对照组和模型组小鼠ig等量0.5%羧甲基纤维素钠,连续给药9周。每周检测血糖和体质量,给药结束后处死小鼠收集血液和肾脏组织,计算肾脏指数(肾脏质量/体质量)。
2.2 血清BUN和Cr的检测收集的血液经过4℃、3 000 r/min离心10 min,收集血清,按照试剂盒说明书检测血清中Cr和BUN。
2.3 肾脏组织病理学观察将小鼠肾脏组织以4%多聚甲醛固定24 h,石蜡包埋,5 μm切片,HE染色。80 ℃烤片0.5 h,二甲苯脱蜡,乙醇梯度水化,苏木素染色5 min,洗净后1%盐酸乙醇分化,流水冲洗反蓝,伊红染色1~3 min,蒸馏水洗净,梯度乙醇脱水,二甲苯透明,中性树胶封片。显微镜下观察肾脏病理变化并拍照。
2.4 RT-qPCR检测肾脏组织中炎症因子和趋化因子取3 mm×3 mm×3 mm肾组织,制备匀浆,按照Trizol试剂盒说明书提取总RNA,使用M-MLV逆转录试剂盒合成cDNA,使用Bio-rad实时定量PCR仪进行定量PCR。检测肾脏组织中的炎症因子白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)和趋化因子细胞间黏附分子-1(ICAM-1)mRNA表达量。
2.5 免疫组化分析肾脏巨噬细胞浸润情况 将包埋好的肾组织5 μm切片,免疫组化染色CD68表征巨噬细胞浸润。将组织切片梯度脱水,0.01 mol/L柠檬酸钠缓冲液高压抗原修复2 min,PBS洗净后3%双氧水去除内源性过氧化物酶,1% BSA封闭30 min,CD68(1∶100)一抗4 ℃孵育过夜,加入对应的二抗(1∶200)37 ℃孵育2 h,加入DAB显色3 min,洗净DAB,中性树脂封片镜检。 2.6 统计学方法数据均以x±s表示,用GraphPad Prism 5.0软件作图,Student’s t 检验用于统计学分析。
3 结果 3.1 对1型糖尿病小鼠体质量和血糖的影响每周体质量监测结果表明,与对照组相比,糖尿病模型小鼠的体质量明显下降,姜黄素和WZ35对体质量下降没有缓解作用。血糖数据表明,糖尿病模型小鼠的血糖明显升高,姜黄素和WZ35不影响血糖的变化。结果见图 2。
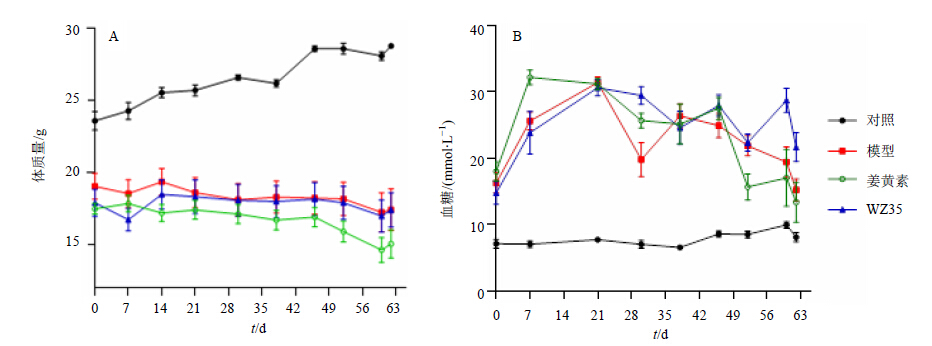 | 图 2 姜黄素和WZ35对1型糖尿病小鼠体质量 (A) 和血糖 (B) 的影响 (x±s,n = 10)Fig.2 Effects of curcumin and its WZ35 on body weight (A) and blood glucose (B) in type 1 diabetic mice (x±s,n = 10) |
肾脏指数可以反映肾脏组织的大体损伤情况,与对照组比较,模型组小鼠肾脏指数明显增加(P<0.05),姜黄素及WZ35对增加的肾脏指数无明显影响。与对照组比较,糖尿病模型小鼠血清中BUN和Cr水平显著增加(P<0.05、0.01);姜黄素能明显降低糖尿病小鼠血清Cr水平;WZ35能明显降低糖尿病模型小鼠血清中BUN和Cr水平(P<0.05、0.01),且WZ35作用效果比姜黄素更加明显。结果见图 3。
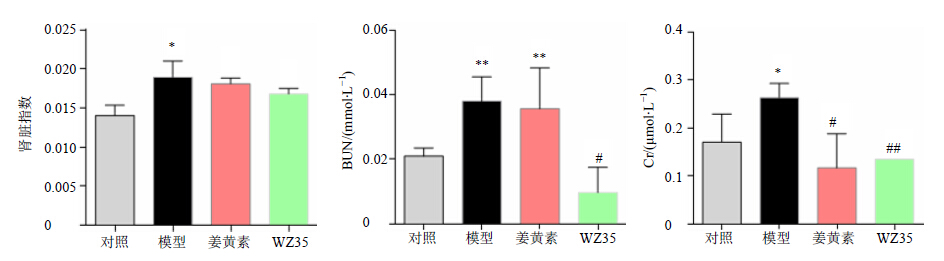 |
与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01 *P < 0.05 **P < 0.01 vs control group; #P < 0.05 ##P < 0.01 vs model group 图 3 姜黄素和WZ35对1型糖尿病小鼠肾脏损伤指标的影响 (x±s,n = 10)Fig.3 Effects of curcumin and its WZ35 on renal damage indexes in type 1 diabetic mice (x±s,n = 10) |
HE染色检测肾组织的病理性变化发现,模型组小鼠的肾小管紊乱、肾小球硬化和扩张、弥漫性肾小球系膜基质扩张和外周血管壁增厚,说明糖尿病明显引起肾脏损伤。WZ35可以明显改善糖尿病引起的肾组织病理性损伤,姜黄素也能明显缓解肾损伤,但效果不如WZ35明显。结果见图 4。
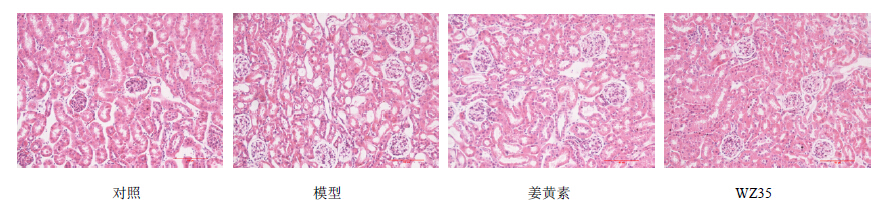 | 图 4 姜黄素和WZ35对1型糖尿病小鼠肾组织病理性损伤的影响Fig.4 Effects of curcumin and its WZ35 on pathological damage of renal tissue in type 1 diabetic mice |
采用RT-qPCR实验技术检测肾脏组织的炎症因子和趋化因子的基因表达水平,结果表明模型组小鼠肾脏组织中炎症因子TNF-α和IL-6以及趋化因子ICAM-1的mRNA水平明显升高(P<0.05、0.01、0.001);姜黄素和WZ35明显抑制1型糖尿病小鼠肾脏组织中炎症因子和趋化因子的基因表达(P<0.05、0.01)。结果见图 5。
 |
与对照组比较:*P<0.05 **P<0.01 ***P<0.001;与模型组比较:#P<0.05 ##P<0.01 *P < 0.05 **P < 0.01 ***P < 0.001 vs control group; #P < 0.05 ##P < 0.01 vs model group 图 5 姜黄素和WZ35对1型糖尿病小鼠肾脏组织炎症因子和趋化因子基因表达的影响 (x±s,n = 10)Fig.5 Effects of curcumin and its WZ35 on gene expression of inflammatory cytokines and chemokine in kidney tissue of type 1 diabetic mice (x±s,n = 10) |
CD68是巨噬细胞表面的一种特异性抗原[11],图 6为肺组织的CD68染色,与对照组相比,模型组肾脏组织有大量的巨噬细胞浸润,姜黄素和WZ35能明显抑制肾脏组织巨噬细胞的浸润。
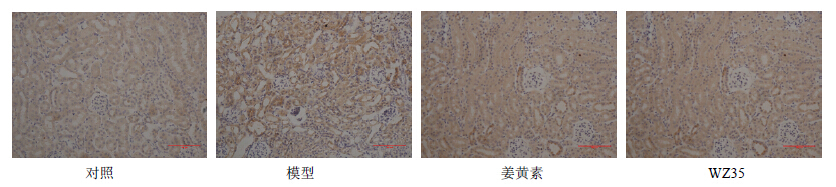 | 图 6 姜黄素和WZ35对1型糖尿病小鼠肾脏组织巨噬细胞浸润的影响Fig.6 Effects of curcumin and its WZ35 on macrophages infiltration of kidney tissue in type 1 diabetic mice |
DN是糖尿病最常见的微血管并发症之一,也是导致慢性肾衰竭的主要原因之一,其转变至终末期肾病(ESRD)的速度比一般的肾脏疾病要快很多[12]。DN的病理分子机制很复杂,涉及了不同种刺激因素和信号通路,包括肾素-血管紧张素系统、炎症与自身免疫反应、氧化应激反应、终末糖基化产物、糖代谢紊乱、蛋白激酶C和G蛋白信号通路等[1, 13, 14]。近年来,越来越多的证据显示炎症反应及促炎因子与DN的发生发展密切相关,并认为DN是一种炎症性(免疫性)疾病[2]。一般认为,高糖激活了组织或胞内的损伤和应激相关信号通路,其中慢性炎症反应成为糖尿病并发症的重要病理因素之一。高血糖诱导的肾组织中炎症介质(如TNF-α、IL-6、IL-1β等)水平上升以及炎性细胞浸润和聚集,随后导致肾小球、肾小管、系膜和间质发生一系列的损伤性病理改变。巨噬细胞炎症反应能介导DN的发生发展[13, 14, 15, 16]。在DN患者的慢性炎症过程中,肾组织巨噬细胞不断浸润和增多[17]。
已有报道指出姜黄素通过抑制炎症反应缓解DN。持续口服姜黄素(每天50 mg/kg或者15~30 mg/kg)明显改善糖尿病肾脏功能[18]。Chiu等[19]报道ip姜黄素(150 mg/kg)持续40 d,可以通过抑制p300和核因子-κB(NF-κB)通路防治DN。尽管已有很多研究报道姜黄素的肾脏保护作用,但姜黄素的低生物利用度导致用药量很大。本实验发现,姜黄素及其类似物WZ35不能明显改善糖尿病引起的体质量下降和血糖升高,但是对于肾脏损伤起到明显的缓解作用,包括抑制血清中Cr和BUN的升高以及肾组织的病理学变化。说明姜黄素和WZ35不是通过降糖作用缓解DN。对其缓解DN的机制进行研究发现姜黄素和WZ35可以通过抑制趋化因子ICAM-1的表达,降低糖尿病小鼠肾脏组织中巨噬细胞的浸润,减少炎症因子的表达从而缓解DN。
本研究证实了单羰基姜黄素类似物WZ35能够通过抑制炎症因子表达和炎症细胞浸润缓解DN,具有很好的开发前景。但是WZ35缓解DN的具体分子机制并未阐明,是否与其先导化合物姜黄素的分子机制相同,将在以后的研究中深入探讨。
| [1] | Tavafi M. Diabetic nephropathy and antioxidants [J]. J Nephropathol, 2013, 2(1): 20-27. |
| [2] | Wada J, Makino H. Inflammation and the pathogenesis of diabetic nephropathy [J]. Clin Sci, 2013, 124(3): 139-152. |
| [3] | Leehey D J, Singh A K, Alavi N, et al. Role of angiotensin II in diabetic nephropathy [J]. Kid Int, 2000, 58: S93-S98. |
| [4] | Lenz O, Fornoni A, Ijaz A, et al. Role of inflammation in diabetic nephropathy [J]. Curr Diabetes Rev, 2008, 4(1): 10-17. |
| [5] | 罗廷顺, 李洪文, 刘正文, 等. 姜黄素的提取分离与药理作用研究进展 [J]. 现代药物与临床, 2011, 26(2): 102-107. |
| [6] | Prasad S, Gupta S C, Tyagi A K, et al. Curcumin, a component of golden spice: From bedside to bench and back [J]. Biotechnol Adv, 2014, 32(6): 1053-1064. |
| [7] | 王敏姗, 姜程曦, 张亚利. 含氮杂环的单羰基姜黄素类似物的合成及抗炎活性 [J]. 中草药, 2014, 45(24): 3532-3537. |
| [8] | Wang Z, Zou P, Li C L, et al. Synthesis and biological evaluation of novel semi-conservative mono-carbonyl analogs of curcumin as anti-inflammatory agents [J]. Med Chem Comm, 2015. doi: 10.1039/C5MD00114E. |
| [9] | Fang Q L, Zhao L P, Wang Y, et al. A novel chalcone derivative attenuates the diabetes-induced renal injury via inhibition of high glucose-mediated inflammatory response and macrophage infiltration [J]. Toxicol Appl Pharmacol, 2015, 282(2): 129-138. |
| [10] | Zhong P, Wu L P, Qian Y Y, et al. Blockage of ROS and NF-κB-mediated inflammation by a new chalcone L6H9 protects cardiomyocytes from hyperglycemia-induced injuries [J]. BBA-Molecular Basis Dis, 2015, 1852(7): 1230-1241. |
| [11] | Holness C L, Simmons D L. Molecular cloning of CD68, a human macrophage marker related to lysosomal glycoproteins [J]. Blood, 1993, 81(6): 1607-1613. |
| [12] | Rossing P. Diabetic nephropathy: Worldwide epidemic and effects of current treatment on natural history [J]. Curr Diabetes Rep, 2006, 6(6): 479-483. |
| [13] | Turgut F, Bolton W K. Potential new therapeutic agents for diabetic kidney disease [J]. Am J Kidney Dis: Off J Nat Kidney Foundat, 2010, 55(5): 928-940. |
| [14] | Lee F T, Cao Z, Long D M, et al. Interactions between angiotensin II and NF-κB-dependent pathways in modulating macrophage infiltration in experimental diabetic nephropathy [J]. J Am Soc Nephrol, 2004, 15(8): 2139-2151. |
| [15] | Lim A K, Tesch G H. Inflammation in diabetic nephropathy [J]. Mediators Inflamm, 2012. doi: 10.1155/2012/146154. |
| [16] | Navarro-González J F, Mora-Fernández C, de Fuentes M M, et al. Inflammatory molecules and pathways in the pathogenesis of diabetic nephropathy [J]. Nat Rev Nephrol, 2011, 7(6): 327-340. |
| [17] | Chow F Y, Nikolic-Paterson D J, Atkins R C, et al. Macrophages in streptozotocin-induced diabetic nephropathy: Potential role in renal fibrosis [J]. Nephrol Dial Transplant, 2004, 19(12): 2987-2996. |
| [18] | Sharma S, Kulkarni S K, Chopra K. Curcumin, the active principle of turmeric (Curcuma longa), ameliorates diabetic nephropathy in rats [J]. Clin Exp Pharmacol P, 2006, 33(10): 940-945. |
| [19] | Chiu J, Khan Z A, Farhangkhoee H, et al. Curcumin prevents diabetes-associated abnormalities in the kidneys by inhibiting p300 and nuclear factor-κB [J]. Nutrition, 2009, 25(9): 964-972. |
 2015, Vol. 46
2015, Vol. 46


