2. 浙江省省级药学类工程实践教学基地, 浙江 杭州 310053;
3. 浙江中医药大学生命科学院, 浙江 杭州 310053
2. Provincial Pharmaceutical Engineering Practice Teaching Base in Zhejiang, Hangzhou 310053, China;
3. College of Life Science, Zhejiang Chinese Medical University, Hangzhou 310053, China
姜黄素(curcumin)是从姜科(Zingiberaceae)姜黄属Curcuma L. 植物姜黄Curcuma longa L. 的根茎中提取的一种天然有效成分,具有抗炎、抗肿瘤、调血脂、抗动脉粥样硬化等多种药理活性,且安全性高、毒副作用小[1, 2]。然而,姜黄素在酸性和中性条件下难溶,碱性条件下易降解,体内消除半衰期(t1/2)为(159.28±18.12)min,绝对生物利用度为4.13%[3],口服后大部分以原型排出体外,代谢过快,生物利用度低[4, 5, 6],极大地限制了其临床应用。为了克服以上缺陷,张继芬等[7]以磷脂为主要材料,制备合适的载体改善姜黄素的吸收,高振坤等[8]制备姜黄素-羟丙基-β-环糊精包合物以改善理化性质,但结果均不理想。因此,本研究以活性成分为切入点,姜黄素为活性成分和葡甲胺(meglumine)为共晶形成物,通过氢键相互作用使它们相连,制备了新的姜黄素葡甲胺共晶(meglucumin cocrystal,MGC,结构见图 1)化合物[9, 10, 11, 12, 13, 14, 15],以大鼠在体肠单向灌流为模型,采用UV法测定各肠段吸收速率常数(Ka)和表观渗透系数(Papp),并以姜黄素为对照,观察对比MGC肠吸收参数是否变化和改善,为研究MGC新共晶化合物的药学资料提供了参考。
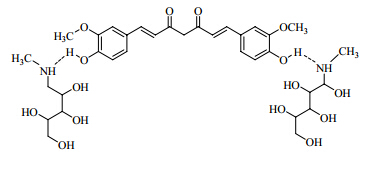 | 图 1 MGC的化学结构Fig.1 Chemical structure of MGC |
Krebs-Ringer’s溶液(K-R液,由氯化钠7.8 g、氯化钾0.35 g、氯化钙0.37 g、碳酸氢钠1.37 g、磷酸二氢钠0.32 g、氯化镁0.02 g、无水葡萄糖1.4 g,蒸馏水溶解并稀释至1 L制得);其余试剂(分析纯);MGC(一种橙红色、针状结晶,分子式C35H54N2O10,自制,批号N20130502);甲醇(色谱纯,购自美国Tedia公司);3%戊巴比妥钠由浙江中医药大学实验动物中心提供;所有实验用水均为超纯水。姜黄素对照品(质量分数99.6%,批号20110801),购自上海三爱思试剂有限公司。
1.2 仪器UV-2550型紫外可见分光光度计(日本岛津公司);XS105DU电子分析天平(Mettler Toledo公司);HH-6数显恒温水浴锅、BT-100恒流泵(上海泸西分析仪器厂有限公司);梅特勒XS-105型电子分析天平(梅特勒-托利多仪器上海有限公司);Synergy UV型超纯水仪 [密理博(上海)贸易有限公司];DZF-6050型真空干燥箱(上海一恒科技有限公司);TGL-16B高速离心机(上海安亭科学仪器厂);XW-80A型旋涡混合器(上海医大仪器厂);WZ-50C2微量注射泵(浙江大学医学仪器有限公司)。
1.3 实验动物健康雄性SD大鼠,体质量(220±20)g,购自上海西普尔-必凯实验动物有限公司,合格证号SCXK(沪)2013-0016。本实验中所有动物实验操作均符合《浙江省实验动物管理条例》有关规定。
2 方法与结果 2.1 肠灌流液中姜黄素的UV测定方法 2.1.1 检测波长的选择配制姜黄素乙醇溶液,于200~800 nm进行扫描,得到在425 nm处有最大吸收。
2.1.2 供试液的配制姜黄素供试液的配制:精密称取姜黄素对照品粉末15 mg,适量的无水乙醇溶解,用配好的K-R液(用碳酸氢钠调pH=8.0)定容至250 mL量瓶中,摇匀,得到60 μg/mL(0.163 mmol/L)的姜黄素供试液。MGC供试液的配制:精密称取MGC粉末30.98 mg,适量无水乙醇溶解,用配好的K-R液(用葡甲胺调pH=8.0)定容至250 mL量瓶中,摇匀,得到123.92 μg/mL(0.163 mmol/L)的MGC供试液。
2.1.3 方法专属性考察分别取空白灌流液、MGC供试液及其灌流液各1 mL置10 mL量瓶中,乙醇定容,摇匀,用UV法考察空白肠灌流液的内源性成分是否对姜黄素检测有干扰。结果表明在425 nm波长下,肠灌流液中成分不干扰姜黄素的测定。
2.1.4 标准曲线的制备精密称取姜黄素对照品10.0 mg置10 mL量瓶中,加入适量乙醇,溶解,定容,取0.100 mL用乙醇定容至10 mL,摇匀,得10 μg/mL贮备液。分别精密吸取贮备液0.1、0.5、1.0、2.0、4.0 mL,置于10 mL量瓶中,加入K-R液,稀释至刻度定容,摇匀,得质量浓度0.10、0.50、1.00、2.00、4.00 μg/mL系列对照品溶液。按“2.1.1”项下检测波长测定吸光度(A)值,以A对质量浓度(C)进行线性回归。得标准曲线方程:A=0.167 34 C+0.010 22,r=0.999 90(n=5),姜黄素在0.293 5~5.868 0 μg/mL线性关系良好,符合测定要求。
2.1.5 精密度试验取1、2、4 μg/mL的低、中、高质量浓度的MGC溶液在425 nm波长下测定5次,得到A值,计算精密度。测得的精密度RSD分别为0.75%、1.1%、0.96%(n=5)。
2.1.6 稳定性试验将2 μg/mL姜黄素和MGC供试液,置于37 ℃水浴保温3 h,每隔30 min取样,在425 nm波长下测定各时间点的A值。结果在3 h内,MGC浓度的RSD为1.8%,姜黄素浓度的RSD为2.6%,稳定性良好。
2.2 大鼠在体肠吸收实验本实验使用恒流泵,将供试液匀速泵入大鼠肠段内。实验前用供试液冲洗管道至流出液端口药物质量浓度与供试液药物质量浓度相同,以消除实验过程中管路对药物的吸附影响。手术前,大鼠禁食24 h,自由饮水。实验时,大鼠ip 3%戊巴比妥钠溶液(0.15 mL/100 g)麻醉,在腹正中切开3 cm,分离肠管,对考察的部位两端剪切后插管,结扎固定,部分缝合伤口,用浸有生理盐水的脱脂棉覆盖、保湿、红外灯保温。用预热的37 ℃的9.0 mg/mL氯化钠溶液将肠段清洗干净,再用空气将9.0 mg/mL氯化钠排净。实验时取MGC供试液(预热至37 ℃)100 mL,先以1 mL/min的体积流量灌流15 min,排除肠内气泡,再将体积流量调至0.2 mL/min灌流30 min后,开始计时。从第1滴供试液滴下,开始计时,前45 min的灌流液舍去,而后每隔10 min迅速更换已知质量的离心试管,并称质量。计算泵入供试液的质量和每10 min内收集到流出液的质量。直至135 min结束实验。将考察的肠段剪下,分别测其长度和内径。取样0.5 mL,用无水乙醇定容至10 mL量瓶中,在425 nm波长下测定A值,根据标准曲线计算姜黄素的质量浓度。按以下公式计算姜黄素吸收速率常数(Ka)和表观渗透系数(Papp)。
Ka=[1-(ρout/ρin)×(Vout/Vin)]×(v/πr2l)
Papp=-v×ln[(ρout/ρin)×(Vout/Vin)]/2πrl
Vin和Vout分别为灌入的供试液和收集的供试液体积(采用质量法计算,假设灌流进出口的溶液密度一样),v为灌流体积流量,ρin、ρout分别为进口和出口灌流液中药物的质量浓度,l和r分别为被灌流肠段的长度和横截面半径
分段考察各肠段区间:十二指肠段自幽门1 cm处,空肠肠段距幽门15 cm处,回肠肠段自盲肠上行20 cm处,结肠肠段从盲肠后端至直肠,全肠段为自十二指肠上部至回肠下部。
结果表明十二指肠段为MGC的主要吸收部位,与其他肠段比较差异显著;而其他肠段间比较,差异不显著,结果见表 1。MGC在全肠段的吸收与姜黄素比较,发现姜黄素的吸收有明显的提高,MGC的Ka和Papp较姜黄素分别提高了1.53和2.21倍,见表 2。MGC在大鼠小肠上部分吸收较好,在结肠段相对吸收较差。
表 1 MGC在大鼠各肠段的吸收参数 ( ±s, n = 5)
Table 1 Absorption parameters of MGC in different parts of intestine of rats ( ±s, n = 5)
Table 1 Absorption parameters of MGC in different parts of intestine of rats ( ±s,n = 5) ±s,n = 5) |
表 2 姜黄素和MGC在大鼠全肠段的吸收参数 ( ±s, n = 5)
Table 2 Absorption parameters of curcumin and MGC in total segaments of intestine of rats ( ±s, n = 5)
Table 2 Absorption parameters of curcumin and MGC in total segaments of intestine of rats (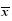 ±s,n = 5) ±s,n = 5) |
小肠是药物的主要吸收部位。在体肠吸收中,单向灌流法使用简单,吸收速率最稳定,能较好地模拟体内环境,国内外多采用此法研究药物的肠吸收[16, 17]。通常,大鼠在体肠吸收实验中多用酚红作为供试液体积的标记物,但灌流过程中酚红也存在一定程度的肠吸收,鉴于酚红对姜黄素测定有干扰,本实验选择质量分析法对体积进行校正。
Fagerholm等[18]报道大鼠小肠全肠段的Papp<1.8×10-4 cm/min,或Papp>1.2×10-3 cm/min时,表明药物难吸收或完全吸收。前期实验结果在水中溶解度(25 ℃):MGC是0.14 mg/L,与姜黄素0.04 mg/L相比,提高3.5倍。本实验结果表明姜黄素Papp为3.112×10-3 cm/min与MGC的6.871×10-3 cm/min均属于肠易吸收化合物,姜黄素修饰成MGC后,水溶性和渗透性有了较明显的提高。该结果提示MGC生物利用度得到了较好的改善,具体药动学参数有待后续测定。
因姜黄素难溶于水,常规方法得不到澄清溶液,所以很难进行肠吸收实验,并收获客观数据。因为肠道含有Na+、K+等无机离子,所以本实验姜黄素供试品溶液用碳酸氢钠调pH 8.0后,获得澄清供试液,因此,姜黄素大鼠肠吸收为姜黄素钠盐数据。
虽然MGC水溶性有所提高,但按常规方法得不到澄清供试品溶液,很难进行肠吸收实验,并收获客观数据,所以,本实验用葡甲胺调pH 8.0,可获得澄清供试品溶液,由于供试液引入葡甲胺,可规避MGC的水解,获得客观数据。
| [1] | Anand P, Thomas S G, Sundaram C, et al. Biological activities of curcumin and analogues made by man and mother nature [J]. Biochem Pharm, 2008, 76(11): 1590-1611. |
| [2] | 李小江, 贾英杰, 张文治, 等. 姜黄素对A549细胞亚群SP及NON-SP细胞凋亡的诱导作用 [J]. 中草药, 2013, 44(18): 2581-2584. |
| [3] | 张立康, 汪小珍, 李婉姝. 姜黄素在大鼠体内药代动力学和生物利用度研究 [J]. 中国药理学通报, 2011, 27(10): 1458-1462. |
| [4] | Camila S M, Cristiane M, Ana C N, et al. Curcumin-β-cyclodextrin inclusion complex: stability, solubility, characteristic by FT-IR, FT-Raman, X-ray diffracotion and photoacoustic spectroscopy, and food application [J]. Food Chem, 2014, 153: 361-370. |
| [5] | Soma D, Sreenivasan K. Conjugation of curcumin into alginate enhances aqueous and stability of curcumin [J]. Carbohydr Polym, 2014, 99(2): 499-507. |
| [6] | 韩刚, 霍文, 李秋影. 姜黄素的稳定性研究 [J]. 中成药, 2007, 29(2): 291-293. |
| [7] | 张继芬, 唐勤, 莫婷. 姜黄素磷脂载体的表征及肠吸收研究 [J]. 中国药学杂志, 2012, 47(21): 1736-1740. |
| [8] | 高振坤, 王兰. 姜黄素-羟丙基-β-环糊精包合物的制备及其理化性质研究 [J]. 中国药房, 2007, 18(13): 999-1000. |
| [9] | 马坤, 高静, 马磊. 药物的共晶与盐 [J]. 中国药科大学学报, 2012, 43(5): 475-480. |
| [10] | 高缘, 祖卉, 张建军. 药物共晶研究进展 [J]. 化学进展, 2010, 22(5): 829-836. |
| [11] | Adam J, Padmini K, Lukasz W, et al. Cocrystals of quercetin with improved solubility and oral bioavail-abilility [J]. Mol Pharm, 2011, 8(5): 1867-1876. |
| [12] | Perlovich G L, Manin A N. Design of pharmaceutical cocrytals for drug solubity improvement [J]. Russ J General Chem, 2014, 84(2): 407-414. |
| [13] | Song J X, Yan Y, Yao J, et al. Improving the solubility of lenalidomide via cocrystals [J]. Am Chem Soc, 2014, 14: 3069-3077. |
| [14] | Thakuria R, Delori A, William J, et al. Pharmaceutical cocrystals and poorly soluble drugs [J]. Int J Pharm, 2013, 453(1): 101-125. |
| [15] | Sanphui P, Tothadi S. Salt and cocrystals of slidenafil with dicarboxylic acids: solubility and pharmaceutic advantage of the glutarate salt [J]. Mol Pharm, 2013, 10(12): 4687-4697. |
| [16] | Xie Y S, Ren X L, Pan G X, et al. The assessment of absorption of periplocin in situ via intestine perfusion of rats by HPLC [J]. Biomed Chromatogr, 2008, 22(2): 196-201. |
| [17] | Raoof A A, Butler J, Devane J G. Assessment of regional differences in intestinal fluid movement in the rat using a modified in situ single pass perfusion mode [J]. Pharm Res, 1998, 15(8): 1314-1316. |
| [18] | Fagerholm U, Johansson M, Lennerna S H. Comparison between permeability coefficients in rat and human [J]. Pharm Res, 1996, 13(9): 1336-1342. |
 2015, Vol. 46
2015, Vol. 46


