2. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001;
3. 江苏省企业院士工作站, 江苏 连云港 222001
2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China;
3. Jiangsu Enterprise Academician Workstation, Lianyungang 222001, China
最近几年,将药物作用网络与生物网络整合在一起的网络药理学方法被应用到生命科学的多个领域,如新药靶的识别、先导化合物的发现、作用机制的研究、药物临床前疗效和安全性评价等,其中以分子对接、药-靶网络构建以及网络特征分析为基础的多靶点整体调控的思维方法正逐渐被用于预测中药主要活性成分群和潜在靶标群,阐述中药作用机制。这种基于系统思维的研究方法更符合中医药的思维模式:调控失衡的生物系统(疾病)恢复到固有平衡[1, 2]。
老年痴呆中50%~60%为阿尔茨海默病(Alzheimer’s disease,AD),它是一种以记忆力丧失和认知功能障碍为主要特点的原发性灰质脑病。临床表现为进行性痴呆,其病因尚不明确,假说有多种,如神经递质缺陷、炎症、自由基损伤、淀粉样蛋白、神经毒作用、激素缺乏、细胞凋亡等[3]。目前FDA已批准的治疗AD的临床药物主要针对胆碱酯酶和NMDA(N-methyl-D-aspartic acid)受体[4],这类药物主要以改善患者的痴呆症状和提高日常生活能力为主,并不能逆转疾病进展且存在较多副作用。而中药在防治复杂性疾病方面有诸多优势,尤其是近年来在抗老年痴呆方面有较多的研究。如由石杉科植物千层塔中提取的一种生物碱石杉碱甲作为第二代乙酰胆碱酯酶抑制剂被美国FDA批准上市用于治疗AD;此外,石杉碱甲还具有促进神经生长因子的产生、阻断NMDA受体过度激活、调节抗氧化酶活性、缓解线粒体功能紊乱、清除活性氧簇等作用[5]。从多年生草本植物远志的根中提取的细叶远志皂苷不仅能透过血脑屏障,通过阻断乙酰胆碱的水解来改善认知能力[6],还能降低β淀粉样蛋白(Aβ1-40)和Aβ1-42的分泌[7]。正因为中药这种多成分、多靶点、多途径治疗的特点,使得中药在治疗AD药物开发中成为热点。本研究采用网络药理学方法对赤芍、黄柏中的成分及其抗AD作用机制进行研究,为后续的实验研究提供理论支撑和指导。
1 实验方法 1.1 分子数据集的收集和处理从北京大学化学与分子工程院创建的中药信息数据库CHDD[8]及Beilstein数据库中检索赤芍、黄柏2种药材,共得到199种不同结构的化合物,导入Cerius 2(4.10版)软件加氢后,选用CHARMm力场进行构象优化,优化时能量阈值设定为1×10-3 J/mol,然后再将优化后的分子结构导入Discovery Studio(2.5版)中的General purpose模板来计算相关描述符。另外,经过大量有关AD发病机制文献的调研,选择了23个较为重要的靶蛋白(表 1),并按照分辨率不高于0.25 nm原则从RSCB的PDB库[9]中下载含有原配体的靶蛋白非模建的晶体结构,导入Discovery Studio 2.5中的Clean protein和Forcefiled中的CHARMm力场进一步对这些靶蛋白进行修饰、加氢以及自动分配原子类型和部分电荷,并根据靶蛋白复合物中配体的中心点坐标确定结合的活性位点。
| 表 1 与AD发病机制相关的靶蛋白 Table 1 Target proteins related to mechanism of AD |
分子描述符是一些描述分子属性的数值,可用于药物的构效分析,根据分子描述数值点所构成的化学空间可以描述化合物集合的多样性,并分析化合物集合之间的相似性[10]。利用Discovery Studio 2.5软件的General propose模块计算赤芍、黄柏所含每个分子的分子描述符,本研究中化合物主要采用以下分子描述符,分子结构信息描述符:相对分子质量(molecular weight)、可旋转键数(number of rotatable bonds)、氢键受体数目(number of H bond acceptors)、氢键给体数目(number of H bond donors)、分子环数(number of rings)、分子芳香环数(number of aromatic rings);空间结构信息描述符:分子体积(molecular volume)、分子表面面积(molecular surface area)、分子极性表面积(molecular fractional polar surface area)、molecular SASA、molecular fractional polar SASA、molecular SAVol、脂水分配系数(aLog P)[11]。
所有分子描述符使用Discovery Studio软件的General purpose模块将所有的分子描述符在IBM IntellistationZ pro工作站上进行计算,并根据里宾斯基(Lipinski)[12]的“类药五原则(rule of five)”对化合物的类药性进行分析。
1.3 分子对接与打分将处理过的靶蛋白和化合物分别导入Auto Dock 4.0进行半柔性对接计算。对接时,对于每个化合物采用拉马克遗传算法(lamarckian genetie algorithm,LGA)进行小分子在蛋白质配体中活性位点的能量优化,具体参数设置如下:以蛋白-配体复合物中配体分子的坐标为盒子中心,格点数为4 nm×4 nm×4 nm,格点间隔为0.037 5 nm,初始种群数为150,能量优化最大迭代次数为l.75×107,并以此作为优化终止条件;随机选取起始构象和取向,平移步长为0.2 nm,旋转步长为50°,突变率为0.02,交叉率为0.8,局部搜索频率为0.06;每一个化合物,对接过程重复采样次数设置为20;其余均为默认设置。
1.4 分子靶蛋白作用网络的构建根据分子对接计算结果,以靶蛋白复合物中的原配体对接分数为阈值,分子与相关靶标对接打分函数高于阈值的即认为该靶标与赤芍或黄柏中的化学成分具有相互作用,再从中抽取较高得分(score≥6)的分子与靶蛋白导入Cytoscape 2.8.1网络分析软件[13],构建分子与靶蛋白相互作用的网络(图 1),其中分子、靶蛋白用节点(node)表示,边(edge)表示分子与靶蛋白间的相互关系,某个分子与某个靶蛋白存在相互作用,则它们就会通过edge连接起来。之后进一步通过Cytoscape软件中的Network analyzer插件分析网络特征:网络度(degree)、介数(betweenness)、网络密度(network density)、最短路径等,预测赤芍、黄柏可能的活性分子群、潜在靶蛋白等。
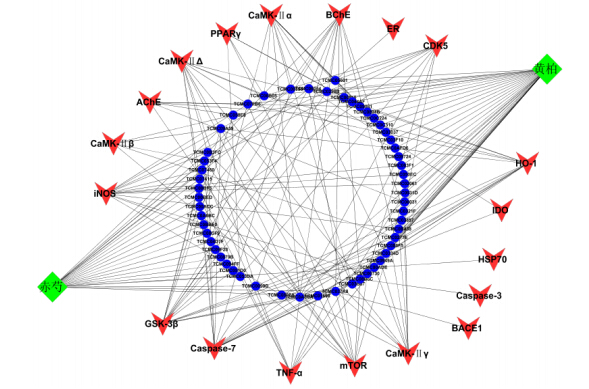 | 图 1 赤芍、黄柏成分分子-靶蛋白的作用网络图 Fig.1 Network chart of molecular-target protein in compounds in Chishao and Huangbai |
计算出的分子描述符统计分析结果见表 2,表中列出了主要分子描述符的最大值、最小值、平均值、中位值。
| 表 2 赤芍、黄柏所含成分的分子描述符 Table 2 Molecular descriptors of compounds in Chishao and Huangbai |
根据“类药五原则”,口服药物必须满足以下特点:相对分子质量小于500,氢键给体数目小于5,氢键受体数目小于10,脂水分配系数小于5,可旋转键的数量不超过10个。表 2数据显示,赤芍、黄柏所含成分平均相对分子质量460.68,中位值为424.70;氢键给体数目平均值4.57,中位值为3.00;氢键受体数目平均值9.04,中位值为6.00;脂水分配系数平均值2.20,中位值为1.73;可旋转键的数目平均值为5.07,中位值为4.00;大部分满足类药五原则,整体上具有较好的口服吸收性质。而分子极性表面积(分子极性表面积=分子极性表面积比值×分子表面面积/100)平均值为1.333 6(≤1.4 nm2)和可旋转键数平均值为5.07(≤7),中位数为4.00,表明赤芍、黄柏中的分子大多都具有较好的生物利用度(≥20%)[13]。
2.2 分子-靶蛋白网络特征分析网络分析既可以提供生物网络的一般特征,同时也能计算具体节点的拓扑学特征,进而有助于从复杂关系中获得潜在的生物信息。对分子-靶蛋白网 络的总体特征分析表明:平均网络度为5.5,平均最短路径为2.661,网络密度为0.073,网络中心度为0.377,网络异质性为0.948。赤芍、黄柏中既存在一个分子与多个靶蛋白作用的现象,同时也存在不同分子作用同一个靶蛋白的现象,这也正符合了中药多组分、多靶点协同作用的特点。
节点的网络度和介数常用于网络特征分析来评估生物网络中的药靶,故又对生物网络中各化合物与靶蛋白的相互作用情况做了进一步分析,部分重要节点的网络特征值见表 3。从化合物的网络特征分析来看,GSK-3β为分子-靶蛋白网络中网络度最好的靶蛋白,17个分子与GSK-3β有较好的亲和力,其次分别为caspase-7、诱导性一氧化氮合酶(iNOS)、丁酰胆碱酯酶(BchE)、HO-1、mTOR。越来越多的研究表明,在Aβ沉积的AD患者脑部中,PI3K/ Akt/GSK-3β信号通路存在很大的改变[15],GSK-3β在AD病程发展中(如记忆障碍、tau蛋白磷酸化、小胶质细胞介导的炎症、炎性因子的释放、突触丢失和神经元死亡等)发挥着至关重要的作用[16];而关于caspase-7和AD的相关性研究报道还比较少,但Nakagawa等[17]通过研究证明,caspase-7可以激活caspase-12,caspase-12的激活导致了很多系统的疾病:Aβ蛋白毒性导致的阿尔茨海默病、视网膜变性、呼吸系统感染等[18]。作为治疗AD最经典的靶蛋白胆碱酯酶(ChE)分两类:一类为乙酰胆碱酯酶(AchE),主要水解神经递质乙酰胆碱(Ach);二类为BchE。这两种胆碱酯酶都可以灭活Ach。故存在一种假说:阿尔茨海默病患者的胆碱酯酶抑制剂治疗不应仅针对AchE,还应针对BchE。iNOS在Aβ诱导的AD模型中发挥着重要的角色[19]。HO-1是一个重要的对氧化应激反应的细胞保护酶,研究显示,HO-1蛋白水平在AD患者脑实质(包括大脑新皮层、海马等结构)和脑血管显著升高,在大部分星形胶质细胞中表达增加,并与神经元纤维缠结,老年斑等病理结构共存[20, 21]。此外,也有大量研究证明AD患者体内mTOR通路存在异常,目前主要集中在mTOR对蛋白质合成和细胞周期再进入的调控上[22];在AD患者体内存在着mTOR通路的下调,这可能是与Aβ的细胞毒性有关,成为AD发展中导致神经元丢失和细胞凋亡的内在机制[23]。因此,赤芍和黄柏主要通过调控GSK-3β和mTOR信号通路并调节iNOS、BchE、HO-1这3种酶的活性及抗细胞凋亡来干预AD的发生发展。
| 表 3 赤芍、黄柏分子-靶蛋白网络中部分节点的网络特征分析 Table 3 Network features of part nodes in the D-T network in Chishao and Huangbai |
通过对赤芍、黄柏成分的分子描述符的分析发现赤芍、黄柏中的分子大多都满足类药五原则。通过对分子-靶蛋白的网络特征分析发现赤芍、黄柏分子具有多靶点特性,预测出了主要活性成分作用的蛋白,阐明了活性成分发挥作用的分子机制。
前期发现赤芍有很好地抗AD活性,如在体内和体外均能抑制Aβ缠结的生成并分解已生成Aβ缠结[24],可以通过调节细胞色素氧化酶及血管肌动蛋白水平来改善痴呆大鼠的行为[25],能够减弱Aβ多肽诱导的大鼠神经毒性[26, 27]等。另外黄柏也有关于抗AD的报道:能抑制Aβ诱导的PC12细胞的凋亡[28],黄柏的甲醇提取物能有效抑制小胶质细胞中炎症因子和NO的产生和释放,成为抗人神经退行性疾病脑部炎症的候选药物[29]等。此外,本实验室前期采用Aβ25-35诱导SH-SY5Y神经细胞损伤的AD细胞模型对多种中药组合物进行神经细胞保护活性筛选,发现赤芍-黄柏组合物的40%和95%的乙醇部位有非常好的抗Aβ损伤活性。经过网络分析发现,分子-靶蛋白网络中199个分子中,有6个化合物,如羽扇烯酮、β-谷甾醇等,与至少5个靶蛋白有较密切的关系,这6个分子中有5个来自于黄柏,1个来自于赤芍。β-谷甾醇是一种应用安全的天然药物,研究表明,β-谷甾醇具有抗炎、调节免疫和抗氧化等重要作用[30],对AchE的活性也有一定的抑制作用[31]。Kihadalactone B和柠檬苦素都属于柠檬苦素类化合物,具有抗炎和抗氧化活性[32],其他3个分子还未见有与AD发病机制相关的活性报道。赤芍、黄柏可能是通过抗炎、抗氧化及抑制胆碱酯酶活性来发挥抗AD作用的;故赤芍、黄柏有可能成为治疗AD的潜在药物。
中药成分复杂,且作用于多靶点、多途径,使中药活性成分及机制研究困难重重。网络药理学研究方法虽存在不少有待解决的问题,但其借助网络分析预测中药信号通路作用机制,为实验工作提供了方向指导,从而大大减少了实验工作的盲目性,为中药的物质基础和作用机制研究提供一种新思路。本研究预测出的赤芍、黄柏潜在活性成分及其靶点蛋白还有待于进一步进行实验验证。
| [1] | 张新庄, 萧伟, 徐筱杰, 等. 利用网络药理学方法研究热毒宁注射液抗流感病毒的分子作用机制 [J]. 物理化学学报, 2013, 29(7): 1415-1420. |
| [2] | Liu C X, Liu R, Fan H R, et al. Network pharmacology bridges traditional application and modern development of traditional Chinese medicine [J]. Chin Herb Med, 2015, 7(1): 3-17. |
| [3] | 聂纯. 治疗老年性痴呆的天然药物成分 [J]. 中草药, 2000, 31(7): 90-92. |
| [4] | Neugroschl J, Sano M. Current treatment and recent clinical research in Alzheimer's disease [J]. Mt Sinai J Med, 2010, 77(1): 3-16. |
| [5] | Zhang H Y, Tang X C. Neuroprotective effects of huperzine A: new therapeutic targets for neurodegenerative disease [J]. Trends Pharmacol Sci, 2006, 27(12): 619-625. |
| [6] | Lv J, Jia H, Jiang Y, et al. Tenuifolin, an extract derived from tenuigenin, inhibits amyloid-beta secretion in vitro [J]. Acta Physiol, 2009, 196(4): 419-425. |
| [7] | Jia H, Jiang Y, Ruan Y, et al. Tenuigenin treatment decreases secretion of the Alzheimer's disease amyloid beta-protein in cultured cells [J]. Neurosci Lett, 2004, 367(1): 123-128. |
| [8] | Qiao X, Hou T, Zhang W, et al. A 3D structure database of components from Chinese traditional medicinal herbs [J]. J Chem Inf Comput Sci, 2002, 42(3): 481-489. |
| [9] | Deshpande N, Addess K J, Bluhm W F, et al. The RCSB Protein Data Bank: a redesigned query system and relational database based on the mmCIF schema [J]. Nucl Acids Res, 2005, 33: 233-237. |
| [10] | Lipinski C, Hopkins A. Navigating chemical space for biology and medicine [J]. Nature, 2004, 432(7019): 855-861. |
| [11] | Gu J, Yuan G, Zhu Y, et al. Computational pharmacological studies on cardiovascular disease by Qishen Yiqi Diwan [J]. Sci China Series B: Chem, 2009, 52(11): 1871-1878. |
| [12] | Lipinski C A, Lombardo F, Dominy B W, et al. Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings [J]. Adv Drug Deliv Rev, 2001, 46(1/3): 3-26. |
| [13] | Smoot M E, Ono K, Ruscheinski J, et al. Cytoscape 2. 8: new features for data integration and network visualization [J]. Bioinformatics, 2011, 27(3): 431-432. |
| [14] | Meanwell N A. Improving drug candidates by design: a focus on physicochemical properties as a means of improving compound disposition and safety [J]. Chem Res Toxicol, 2011, 24(9): 1420-1456. |
| [15] | Jimenez S, Torres M, Vizuete M, et al. Age-dependent accumulation of soluble amyloid beta (Abeta) oligomers reverses the neuroprotective effect of soluble amyloid precursor protein-alpha (sAPP (alpha)) by modulating phosphatidylinositol 3-kinase (PI3K)/Akt-GSK-3beta pathway in Alzheimer mouse model [J]. J Biol Chem, 2011, 286(21): 18414-18425. |
| [16] | Hooper C, Killick R, Lovestone S. The GSK3 hypothesis of Alzheimer's disease [J]. J Neurochem, 2008, 104(6): 1433-1439. |
| [17] | Nakagawa T, Zhu H, Morishima N, et al. Caspase-12 mediates endoplasmic-reticulum-specific apoptosis and cytotoxicity by amyloid-beta [J]. Nature, 2000, 403(6765): 98-103. |
| [18] | 刘洪亮, 崔玉山. Caspase-12在内质网应激中的激活途径及与疾病关系研究进展 [J]. 环境卫生学杂志, 2011, 1(4): 41-45. |
| [19] | Colton C A, Wilcock D M, Wink D A, et al. The effects of NOS2 gene deletion on mice expressing mutated human AbetaPP [J]. J Alzheimers Dis, 2008, 15(4): 571-587. |
| [20] | Schipper H M. Heme oxygenase-1: role in brain aging and neurodegeneration [J]. Exp Gerontol, 2000, 35(6/7): 821-830. |
| [21] | Smith M A, Kutty R K, Richey P L, et al. Heme oxygenase-1 is associated with the neurofibrillary pathology of Alzheimer's disease [J]. Am J Pathol, 1994, 145(1): 42-47. |
| [22] | Swiech L, Perycz M, Malik A, et al. Role of mTOR in physiology and pathology of the nervous system [J]. Biochim Biophys Acta, 2008, 1784(1): 116-132. |
| [23] | 汝文娟, 唐少君, 钟翎. mTOR信号通路及其与阿尔茨海默病的关系 [J]. 中国比较医学杂志, 2010, 20(8): 70-75. |
| [24] | Fujiwara H, Tabuchi M, Yamaquchi T, et al. A traditional medicinal herb Paeonia suffruticosa and its active constituent 1,2,3,4,6-penta-O-galloyl-β-D-glucopyranose have potent anti-aggregation effects on Alzheimer's amyloid β proteins in vitro and in vivo [J]. J Neurochem, 2009, 109(6): 1648-1657. |
| [25] | Zhou J, Zhou L, Hou D, et al. Paeonol increases levels of cortical cytochrome oxidase and vascular actin and improves behavior in a rat model of Alzheimer's disease [J]. Brain Res, 2011, 1388: 141-147. |
| [26] | Lan Z, Chen L, Fu Q, et al. Paeoniflorin attenuates amyloid-beta peptide-induced neurotoxicity by ameliorating oxidative stress and regulating the NGF-mediated signaling in rats [J]. Brain Res, 2013, 1498: 9-19. |
| [27] | Zhong S Z, Ge Q H, Li Q, et al. Peoniflorin attentuates Aβ (1–42)-mediated neurotoxicity by regulating calcium homeostasis and ameliorating oxidative stress in hippocampus of rats [J]. J Neurol Sci, 2009, 280(1/2): 71-78. |
| [28] | Xian Y F, Lin Z X, Ip S P, et al. Comparison the neuropreotective effect of Cortex Phellodendri chinensis and Cortex Phellodendri amurensis against beta-amyloid- induced neurotoxicity in PC12 cells [J]. Phytomedicine, 2013, 20(2): 187-193. |
| [29] | Park Y K, Chung Y S, Kim Y S, et al. Inhibition of gene expression and production of iNOS and TNF-α in LPS-stimulated microglia by methanol extract of Phellodendri Cortex [J]. Int Immunopharmacol, 2007, 7(7): 955-962. |
| [30] | 魏金婷, 刘文奇. 植物药活性成分β-谷甾醇研究概况 [J]. 莆田学院学报, 2007, 14(2): 38-46. |
| [31] | 任建军, 师光禄, 王建文, 等. 薄荷中杀螨活性物质的分离与鉴定 [J]. 林业科学, 2009, 45(6): 77-82. |
| [32] | 姚晓颖, 韩永龙, 张玉玺, 等. 柠檬苦素的药理活性研究进展 [J]. 中国伤残医学, 2011, 19(3): 177-179. |
 2015, Vol. 46
2015, Vol. 46


