牛蒡子Arctii Fructus为菊科(Compositae)二年生草本植物牛蒡Arctium lappa L. 的干燥成熟果实,具有疏散风热、宣肺透疹、利咽散结、解毒消肿之功效,属于发散风热药[1]。现代研究表明,牛蒡子有抗菌、抗肿瘤、降血糖等功效[2],其所含的木脂素类成分牛蒡子苷的量大于5.0%[1],而牛蒡子苷元的量只有0.5%左右[3]。值得注意的是在各药理研究中牛蒡子起作用的主要成分是牛蒡子苷元,牛蒡子苷仅是前体物质[2, 4],如何产业化制备牛蒡子苷元须亟待解决。
牛蒡子苷元的制备已有文献报道,提取方法包括酶水解法[5]、基质固相分散法[6]、超临界萃取法[7]、微波法[8]、碱溶酸沉法[9]、酸水解法[10],文献大多采用酸水解法,再用乙醇提取得到粗提物;纯化方法主要是柱色谱法,多数以混合溶剂为洗脱剂,且至少需2次柱色谱分离[9, 10, 11, 12, 13, 14]。周渭渭等[15]将酸水解液萃取后,蒸干、溶解,以硅藻土拌样,再分别用石油醚、醋酸乙酯回流提取,蒸干醋酸乙酯提取液,得浸膏以丙酮结晶,再反复重结晶,得牛蒡子苷元纯品。本课题组在前人研究的基础上探索出了一种更适合工业化生产的工艺,该工艺能明显减少有机溶剂用量、缩短生产周期、减少生产成本,且安全性高、可操作性强,适合中试及以上规模制备牛蒡子苷元。
1 仪器与材料BS223S电子天平,北京赛多利斯仪器系统有限公司;Agilent 1100高效液相色谱仪,美国Agilent公司;DL-5M型大容量冷冻离心机,湖南赛特湘仪离心机仪器有限公司;DZF-6050型真空干燥箱,巩义市英峪高科仪器厂;BC-R2001FB型20 L旋转蒸发仪,上海贝凯生物化工设备有限公司。
牛蒡子购于临沂天一医药有限公司(产地山东,批号12022004),经中药制药共性技术国家重点实验室李守信高级工程师鉴定为菊科植物牛蒡Arctium lappa L. 的干燥成熟果实;牛蒡子苷元对照品,批号09092222,质量分数>98.0%,上海同田生物科技有限公司;盐酸,批号12038030,西陇化工股份有限公司;食用酒精,批号12039001,山东裕升生物科技有限公司;二氯甲烷、醋酸乙酯、丙酮、无水甲醇、无水乙醇均为分析纯,西陇化工股份有限公司;乙腈为色谱纯,默克股份两合公司。
2 方法和结果 2.1 分析方法 2.1.1 色谱条件Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-水(37∶63);体积流量1.0 mL/min;柱温30 ℃;检测波长283 nm;进样量10 μL;理论塔板数按牛蒡子苷元峰计算应不低于2 000。
2.1.2 对照品溶液配制精密称取牛蒡子苷元对照品24.9 mg,置于25 mL量瓶中,加无水甲醇溶解定容,得0.996 mg/mL的对照品溶液。
2.1.3 供试品溶液配制精密称取“2.3”项下制得的牛蒡子苷元粗品25.0 mg置于25 mL量瓶中,加无水甲醇溶解定容,得1.00 mg/mL的供试品溶液。
2.1.4 专属性量取约1.5 mL无水甲醇,滤过,得专属性空白溶液。取对照品溶液,专属性空白溶液和供试品溶液进样10 μL,由色谱图可见专属性良好。色谱图见图 1。
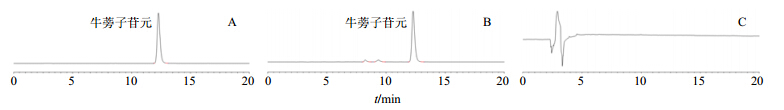 | 图 1 牛蒡子苷元的对照品 (A)、供试品 (B) 与空白 (C) 溶液的HPLC图Fig.1 HPLCof arctigenin reference substance (A),crude product (B),and blank (C) |
精密称取牛蒡子苷元对照品10.0、20.0、25.0、30.0、40.0 mg分别置于25 mL量瓶中,加无水甲醇溶解定容,得0.4、0.8、1.0、1.2、1.6 mg/mL的对照品溶液。每次进样10 μL,测定,以峰面积为纵坐标(Y),以对照品质量浓度为横坐标(X),绘制标准曲线,结果牛蒡子苷元回归方程为Y=8 410.6 X+119.86,r=0.999 9,进样质量浓度在0.4~1.6 mg/mL内呈良好的线性关系。
2.1.6 重复性试验精密称取130401批牛蒡子苷元粗品6份,分别置于25 mL量瓶中,加无水甲醇溶解定容,得供试品溶液。取对照品和供试品溶液进样。按外标法计算供试品的质量分数,得RSD值为0.32%,表明重复性良好。
2.1.7 精密度试验精密吸取对照品溶液,重复进样6次,测定峰面积,得RSD值为0.25%,表明仪器精密度良好。
2.1.8 稳定性试验精密吸取供试品溶液,于配制后0、4、8、12、24、36、48 h,按外标法计算供试品溶液的质量分数,计算RSD为0.70%,结果表明供试品溶液在48 h内稳定。
2.1.9 回收率试验精密称取牛蒡子苷元粗品9份置于25 mL量瓶中,分别精密称取对照品9份,每3份为1组,按质量分为低(80%)、中(100%)、高(120%)3组,分别加入上述相对应的25 mL量瓶中,加无水甲醇溶解定容,得供试品溶液。取对照品和供试品溶液进样。按外标法计算供试品的质量分数。计算得加样回收率平均值为99.08%,RSD为0.82%,表明回收率良好。
2.1.10 定量测定精密吸取牛蒡子苷元对照品溶液和供试品溶液进样测定,经计算得牛蒡子苷元质量分数。
2.2 粗提物的制备参照文献方法[10],将牛蒡子药材加6倍量3%盐酸溶液水解5 h,将酸水排出,牛蒡子加水洗至pH值为6~7,烘干,加6倍量30%乙醇提取2次,每次2 h,合并提取液。
牛蒡子苷元属木脂素类,极性小、亲水性差,可采用水沉除去亲水性物质。将所得30%乙醇提取液合并冷沉,离心取上清,减压浓缩至相对密度1.20~1.25,加入10倍量50~70 ℃的热水搅拌溶解,冷却至室温,再冷沉12 h,滤过取沉淀,干燥得牛蒡子粗提物(其中含牛蒡子苷元50.6%)。
2.3 牛蒡子苷元粗品的制备 2.3.1 粗提物提取溶剂的考察称取“2.2”项下所得粗提物3份,每份10 g(含牛蒡子苷元5.06 g),粉碎后分别用10倍量二氯甲烷、醋酸乙酯、丙酮,回流提取1次,提取时间1 h,提取液减压浓缩至稠膏,烘干后称质量,按“2.1”项下方法测定牛蒡子苷元的质量分数,确定最佳提取溶剂,结果见表 1。可知,醋酸乙酯和丙酮对牛蒡子苷元提取收率远高于二氯甲烷,醋酸乙酯提取率略低于丙酮,但牛蒡子苷元质量分数远高于丙酮,故最佳提取溶剂确定为醋酸乙酯。
| 表 1 提取溶剂的考察 Table 1 Investigation on extraction solvent |
采用单因素考察粗提物提取条件的最佳范围,考察因素见表 2。提取温度对提取率无明显影响,在10~70 ℃基本一致,故选择室温作为提取温度;其他3个因素对提取率影响较大,当提取时间为45 min、提取次数为3次、溶剂倍数为10倍时,提取率达到最大值。
| 表 2 单因素考察提取条件 Table 2 Investigation on single factor extraction conditions |
在单因素考察的基础上进行正交试验设计,考察因素为提取时间(A)、提取次数(B)、溶剂倍数(C)。正交试验方案与结果见表 3。
| 表 3 正交试验方案与结果 Table 3 Design and results of orthogonal test |
由表 3正交试验结果可知,影响牛蒡子苷元提取率的主要因素依次为B>A>C,即提取次数影响最大,其次为提取时间,再次为溶剂倍数。理论上以A3B3C3为最优组合,但各因素第2、3水平间差 距均明显小于第1、2水平间差距,故本着节约成本、降低能耗的原则,确定最优组合为A2B2C2,即加8倍量醋酸乙酯,搅拌提取2次,每次30 min。
按最优组合提取粗提物,将所得提取液减压浓缩至稠膏状,加入适量无水乙醇回流溶解,滤过,滤液减压浓缩至稠膏状,干燥,即得质量分数大于75.0%的牛蒡子苷元粗品。
2.4 单次结晶 2.4.1 单次结晶溶剂的考察称取“2.3”项下所得牛蒡子苷元粗品5份,每份10 g,粉碎后分别加4倍量二氯甲烷、醋酸乙酯、丙酮、无水甲醇、无水乙醇回流溶解,冷却至室温静置析晶。分别将析出的晶体用对应的溶剂淋洗,烘干后称质量,按“2.1”项下方法测定牛蒡子苷元的质量分数,确定最佳结晶溶剂,结果见表 4。可知,无水甲醇、无水乙醇结晶所得晶体性状、质量、质量分数均优于其他3种溶剂,但无水乙醇安全性高,故最佳结晶溶剂确定为无水乙醇。
| 表 4 单次结晶溶剂的考察 Table 4 Investigation on primary crystallization solvent |
称取“2.3”项下所得牛蒡子苷元粗品,每份10 g,采用单因素试验优化单次结晶的最佳条件,考察因素为结晶温度、溶剂倍数、析晶时间,结果见表 5~7。可知,单次结晶最佳条件为加2倍量无水乙醇回流溶解,冷却至室温,0~4 ℃静置析晶36 h,晶体用无水乙醇淋洗,干燥,即得质量分数大于97.0%的单次结晶。
| 表 5 单次结晶温度的考察 Table 5 Investigation on temperature for primary crystallization |
| 表 6 单次结晶溶剂倍数的考察 Table 6 Investigation on solvent multiple for primary crystallization |
| 表 7 单次结晶时间的考察 Table 7 Investigation on time for primary crystallization |
称取单次结晶2份,每份10 g,按“2.4.1”项下方法考察重结晶溶剂,确定最佳重结晶溶剂为无水乙醇。
2.5.2 重结晶条件的考察称取单次结晶3份,每份10 g,按“2.4.2”项下方法采用单因素试验优化重结晶的最佳条件,结果为加2倍量无水乙醇回流溶解,冷却至室温,0~4 ℃静置析晶24 h,晶体用无水乙醇淋洗,干燥,得成品,其牛蒡子苷元质量分数大于99.0%。
2.6 中试工艺验证将80 kg牛蒡子药材置于1 000 L搪瓷玻璃反应釜中,加入3%盐酸溶液480 L,水解5 h后沥干酸液,水洗牛蒡子至中性,烘干,加入30%乙醇290 L回流提取2次,合并提取液冷沉12 h,离心,取上清液减压浓缩至相对密度1.20~1.25,加入70 ℃水71 L搅拌溶解,冷却至室温,冷沉12 h,滤过取沉淀,将沉淀干燥得牛蒡子粗提物。
向粗提物中加入醋酸乙酯20 L常温搅拌提取2次,每次30 min,合并提取液减压浓缩至稠膏状,加入5 L无水乙醇回流溶解,滤过,滤液减压浓缩至稠膏状,干燥得粗品并测定其质量分数。
向粗品中加入无水乙醇2.9 L回流溶解,冷却至室温,0~4 ℃静置析晶36 h,晶体用无水乙醇淋洗,干燥得单次结晶并测定其质量分数。
向单次结晶中加入无水乙醇1.9 L回流溶解,冷却至室温,0~4 ℃静置析晶24 h,晶体用无水乙醇淋洗,干燥得成品并测定其质量分数。
按上述工艺投料3批,验证工艺的稳定性和可重复性,相关数据见表 8。可知,最终得到牛蒡子苷元质量为(728±12)g(RSD为1.72%),质量分数为(99.37±0.06)%(RSD为0.06%),收率稳定、工艺可行,为规模化生产奠定了研究基础。
| 表 8 3批中试的相关数据 Table 8 Data from three batches of semi-works production |
本研究所涉及的工艺主要包括制备粗提物、制备粗品、单次结晶、重结晶4个步骤,其中的提取过程参考文献资料[10]进行酸水解、乙醇提取;将乙醇提取物水沉取沉淀、干燥得干膏,通过单因素试验考察选用醋酸乙酯直接搅拌提取,再加乙醇热溶除杂,得质量分数大于75.0%的粗品;将粗品采用不同体积分数乙醇进行结晶,得质量分数大于99.0%的牛蒡子苷元。
水解后的牛蒡子乙醇提取时,所加乙醇的体积为质量体积比,但在中试放大生产时,水解后的牛蒡子在反应釜内烘干无法测量其质量,通过小试实验确定牛蒡子水解后质量约为原药材的60%,通过该比率可换算出水解后牛蒡子的质量,用以确定中试以上规模生产时所加乙醇的体积。
现有的牛蒡子苷元制备工艺主要采用2次柱色谱进行纯化,有机溶剂用量大,且多为混合溶剂不 易于回收利用,环境污染大;柱色谱上样量小、洗脱时流速太慢,如放大生产易造成生产周期长的缺陷,不适合在工业化规模上制备牛蒡子苷元。本研究制备工艺摒弃传统的有机溶剂萃取、大孔吸附树脂和硅胶柱色谱,而是采用直接将固形物用有机溶剂搅拌提取再结晶的方式,仅使用到了醋酸乙酯、乙醇,有机溶剂种类少,用量少,安全性高,且均为单一溶剂,能全部回收重复利用,大大减小了工艺运行的环保压力,与传统工艺相比操作简单,工艺用时大大缩短,制备得到牛蒡子苷元纯度高。经过多次中试放大验证,工艺稳定可行,为牛蒡子苷元的大规模制备提供了一种切实可行的工艺,将促进牛蒡子苷元的产业化进程。
| [1] | 中国药典 [S]. 一部. 2010. |
| [2] | 王潞, 赵烽, 刘珂. 牛蒡子苷及牛蒡子苷元的药理作用研究进展 [J]. 中草药, 2008, 39(3): 467-468. |
| [3] | 康凯, 窦德强, 刘淼, 等. 牛蒡不同部位、牛蒡子不同产地中牛蒡苷和牛蒡苷元含量比较及指纹图谱分析 [J]. 中国现代中药, 2009, 11(4): 23-27. |
| [4] | Nose M, Fujimoto T, Takeda T, et al. Structural transformation of lignan compounds in rat gastrointestinal tract [J]. Planta Med, 1992, 58(6): 520-523. |
| [5] | 欧志敏, 杨根生, 冯海. β-葡萄糖苷酶水解牛蒡子苷制备牛蒡子苷元 [J]. 药物生物技术, 2009, 16(5):443-446. |
| [6] | 高赛男, 杜雯雯, 李森, 等. 基质固相分散法提取牛蒡子中牛蒡子苷和牛蒡子苷元 [J]. 中国实验方剂学杂志, 2013, 19(23): 47-50. |
| [7] | 杨艳红, 蔡绍皙, 傅善全, 等. 两步法制备牛蒡子苷元 [J]. 精细化工, 2007, 24(9): 885-889. |
| [8] | 孙兆云, 董珊珊, 吕海涛, 等. 牛蒡子中牛蒡子苷元的微波辅助水解提取工艺 [J]. 食品科技, 2014, 39(1): 222-226. |
| [9] | 李洪福, 窦德强, 李馥睿, 等. 应用碱溶酸沉法制备牛蒡子苷元的研究 [J]. 辽宁中医杂志, 2010, 37(6): 1102-1103. |
| [10] | 吕智. 牛蒡子资源调查及牛蒡子苷元制备工艺研究 [D]. 大连: 辽宁中医药大学, 2009. |
| [11] | 侯蔷, 何凡, 窦德强. 牛蒡苷元新制备工艺 [J]. 中国新药杂志, 2011, 20(10): 871-873. |
| [12] | 卢孔旭. 牛蒡子苷及苷元的提取和纯化 [D]. 杭州: 浙江工业大学, 2011. |
| [13] | 叶胜强, 陈洁, 鲍伯胜, 等. 牛蒡苷元的提取及纯化 [J]. 中国兽药杂志, 2011, 45(2): 32-34. |
| [14] | 王宁, 林海珠, 刘红, 等. 牛蒡子木脂素类化合物的分离与制备 [J]. 西南师范大学学报: 自然科学版, 2013, 38(8): 104-107. |
| [15] | 周渭渭, 刘振国, 单淇, 等. 牛蒡子中牛蒡子苷元的分离及结构表征 [J]. 药物评价研究, 2010, 33(4): 279-283. |
 2015, Vol. 46
2015, Vol. 46


