超微粉碎技术是近年来发展起来的一项高新技术,中药材经超微粉碎可改善其加工性能,加快活性成分的溶出,提高活性成分生物利用度和中药材的利用率[1, 2, 3]。超微粉体是超微粉碎的最终产品,具有一般颗粒所不具有的一些特殊的理化性质,如良好的溶解性、分散性、吸附性、化学反应活性等[4]。
杜仲为杜仲科植物杜仲Eucommia ulmoides Oliv. 的干燥树皮,是中国名贵的滋补药材,具有补肝肾、强筋骨、安胎等功效[5, 6]。杜仲作为皮类药材,细胞壁结合紧密,有效成分难于溶出,利用超微粉碎,更有利于有效成分的溶出。本实验利用粒度分布仪、显微镜、扫描电子显微镜、红外光谱仪等仪器对杜仲普通粉体和超微粉体的理化特性进行了表征,采用HPLC法对杜仲普通粉体与超微粉体的有效成分 松脂醇二葡萄糖苷溶出度进行了测定比较,以期为杜仲的高效利用提供实验及理论指导。
1 仪器与材料HM-701超微粉碎机,北京环亚天元机械技术有限公司;ZN-400A型高速中药粉碎机,中南制药机械厂;倒置显微镜,日本尼康公司;S-3500N扫描电镜,日本日立公司;马尔文2000激光粒度仪,上海思百吉仪器系统有限公司;Nicolet5700傅里叶红外光谱仪,美国尼高力公司;RC-6D溶出度测试仪,天津市光学仪器厂;Agilent 1260高效液相色谱仪,安捷伦科技有限公司;Agilent 1260 Infinity二极管阵列检测器;FA1004N型电子天平,上海菁海仪器有限公司;SL-250型超声波清洗器,上海生析超声仪器有限公司;R210旋转蒸发仪,瑞士Buchi公司。
杜仲样品于2012年10月采集于江西省井冈山,由井冈山大学医学院生药学教研室彭才圣副教授鉴定为杜仲科植物杜仲Eucommia ulmoides Oliv. 的干燥树皮。松脂醇二葡萄糖苷(PDG)对照品,中国食品药品检定研究院,批号111537-201204,质量分数98%;胃蛋白酶(酶活力≥1 200.0 U/g)、胰蛋白酶(酶活力≥50 000 U/g),美国Amresco公司;甲醇为色谱纯;其余试剂为分析纯。
2 方法与结果 2.1 杜仲粉体的制备及粒度测定杜仲药材经充分干燥后,利用中药粉碎机粉碎得杜仲普通粉体;再利用超微粉碎机将经预粉碎后的杜仲药材(普通粉体)进行粉碎,分别得到不同粒径的杜仲超微粉体。实验中为探究不同粒径粉体特性而设置了高、中、低3个不同风机频率60、42、23 Hz进行实验。4个不同粒径的杜仲粉体分别记为杜仲普通粉体、60 Hz超微粉体、42 Hz超微粉体、23 Hz超微粉体。
利用激光粒度仪测定上述4种粉体的粒径,并绘制出以体积为基准的粒径频率分布图和累积分布图,得到各粉体的D10值、中位径D50值和D90值,D10值分别为18.262、12.186、8.902、11.971 μm,D50值分别为75.178、37.874、25.981、34.752 μm,D90值分别为1 246.248、91.842、61.240、76.459 μm,4种粉体的SPAN(跨距)值分别为16.334、2.103、2.014、1.856。
2.2 粉体的显微结构观察及细胞破壁率计算杜仲显微特征包括石细胞、胶丝、筛管、木栓细胞、淀粉粒[7]等,本实验中主要以胶丝和石细胞为观测对象。取适量粉末置于25 mL量瓶中,加水合氯醛适量,超声处理5 min,使粉末分散均匀,定容至刻度。精密吸取药液30 μL,装片,置于显微镜(×400)下观测并采集视野图片[8]。
通过图像分析仪观测杜仲普通粉体与42 Hz超微粉体的胶丝和石细胞特征显微结构,普通粉体在显微镜下能明显观察到杜仲的长胶丝,在超微粉体中胶丝较短,而且超微粉体中大部分的石细胞已破碎(图 1)。
 | 图 1 普通粉体胶丝 (A)、42 Hz超微粉体胶丝 (B)、普通粉体石细胞 (C)、42 Hz超微粉体石细胞 (D) 的显微结构Fig.1 Microstructure of silk gum of common powder (A),42 Hz powder (B),sclereids of common powder (C),and 42 Hz powder (D) of E. ulmoides |
理想破壁模型单元的细胞破壁率的计算公式为n>1时,破壁率η=1-(1-1/n)3(n为粉末粒径与细胞直径的比值);n≤1时,破壁率η=100%。李雅等[5]对多种中药材的各种细胞尺度进行分析,最后认为细胞最小尺寸可按10 μm进行确定,本实验亦以此标准作为理想破碎模型的细胞直径。
根据以上公式计算得出杜仲普通粉体、60 Hz超微粉体、42 Hz超微粉体、23 Hz超微粉体的破壁率分别为34.83%、60.14%、76.73%、63.87%。随着超微粉体粒径的减小,粉体的破壁率增大,但粒径减小到一定程度,破壁率反而下降。
2.3 粉体的表面形貌观察分别取上述4种粉体适量,铺于扫描电子显微镜(SEM)样品台上,喷金镀膜后置SEM下放大1 000倍观察杜仲粉体的结构及表面形态(图 2)。从整体上可以看出杜仲颗粒大小在逐渐减小,普通粉体颗粒大小形状不规则,表面粗糙,可以看到原药材的粉末特征。从42、23 Hz粉体和普通粉体来看,大小逐渐有均匀的趋势,颗粒表面越来越光滑,原药材特征越来越不明显。
 | 图 2 普通粉体 (A)、60 Hz超微粉体 (B)、42 Hz超微粉体 (C)、23 Hz超微粉体 (D) 的SEM扫描结构Fig.2 SEM photographs of common (A),60 Hz ultrafine (B),42 Hz ultrafine (C),23 Hz ultrafine (D) powders of E. ulmoides |
休止角的大小反映粉体颗粒之间相对运动的自由程度,影响休止角大小的因素是复杂的,包括物 料混合程度、颗粒大小、表面性质、荷电、湿度、堆积体的颗粒位置分布等[9]。表 1显示,随着杜仲粉体粒径的减小,休止角逐渐增大,原因是粒径越小,颗粒间相互黏附力越大,不利于粉体流动,故而休止角增大。
| 表 1 杜仲粉体休止角及ρ的测定 (n= 3) Table 1 Measurement on repose angle and heap density of powders of E. ulmoides (n = 3) |
粉体堆密度(ρ)系指颗粒质量(m)和颗粒所占容积体积(V)之比,即ρ=m/V。一定质量的粉体,粒径越小,粉体表面积逐渐变大,颗粒间的摩擦力逐渐增大,妨碍粉体颗粒的堆积,堆积体积增大,ρ减小,流动性变弱。由表 1可知,杜仲粉体的ρ随着粒径的减小而减小,杜仲粉体流动性随着粒度的减小而变弱,微粉化对杜仲粉体的流动性有不利影响。
2.5 杜仲粉体红外光谱图比较利用傅里叶红外光谱检测杜仲普通粉体与超微粉体,比较其红外谱图特征,4个样品在3 650~3 200、2 928~2 925、1 750~1 735、1 427~1 260、1 200~1 000 cm-1处分别有羟基、甲氧基、内酯羧基、不对称二甲基以及C-C键、C-O键的不对称振动吸收,4个样品吸收峰值在±20 cm-1内,主要官能团不发生变化,则杜仲超微粉碎不破坏其化学成分,能够保持杜仲的生物活性。
2.6 杜仲粉体提取率比较 2.6.1 超声提取法供试品溶液制备取杜仲普通粉体和60、42、23 Hz超微粉体各约0.5 g,称定质量,置具塞锥形瓶中,精密加入甲醇25 mL,称得总质量,再将锥形瓶放在超声波清洗器中超声提取20 min,放冷,再称定质量,用甲醇补足损失的质量,摇匀滤过,取续滤液,用0.45 μm微孔滤膜滤过,收集滤液,再加入3倍滤液体积的纯净水,混合均匀即得。用相同方法改变超声时间,分别提取40、60 min制得供试品溶液。
2.6.2 回流提取法供试品溶液制备取以上4种粉体各约2 g,称定质量,置500 mL圆底烧瓶中,精密加入甲醇100 mL,再将烧瓶放在温度为100 ℃的恒温水浴锅中回流提取20 min,趁热滤于100 mL量瓶中,经甲醇定容,用0.45 μm微孔滤膜滤过,收集滤液,再加入3倍滤液体积的纯净水,混合均匀即得。用相同方法改变回流时间,分别回流40、60 min制得供试品溶液。
2.6.3 对照品溶液制备精密称取PDG对照品1.65 mg置10 mL量瓶中,加流动相定容为含PDG 0.165 mg/mL的溶液,取上述溶液5 mL于10 mL量瓶中,加流动相定容,配制成含PDG 82.5 μg/mL的对照品储备液。
2.6.4 色谱条件色谱柱为Zorbax-C18(150 mm×4.6 mm,5 μm);流动相为甲醇-水(25∶75);体积流量1 mL/min;柱温30 ℃;检测波长228 nm;进样量10 μL。在此色谱条件下,PDG峰与其他组分峰达到基线分离,峰形对称。
2.6.5 线性关系考察取“2.6.3”项下配制的PDG储备液加适量流动相配制成以下6个梯度质量浓度的对照品溶液:C1溶液20.625 μg/mL(精密量取对照品储备液5 mL置20 mL量瓶中,加流动相定容即得)、C2溶液17.187 5 μg/mL(精密量取C1溶液8.3 mL置10 mL量瓶,加流动相定容即得)、C3溶液13.750 μg/mL(精密量取C1溶液6.7 mL置10 mL量瓶,加流动相定容即得)、C4溶液10.313 μg/mL(精密量取C1溶液5 mL置10 mL量瓶,加流动相定容即得)、C5溶液6.875 μg/mL(精密量取C3溶液5 mL置10 mL量瓶,加流动相定容即得)、C6溶液3.438 μg/mL(精密量取C5溶液5 mL置10 mL量瓶,加流动相定容即得)。在“2.6.4”项色谱条件下,分别测定PDG峰面积。以质量浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,回归方程为Y=15 263 X+2.842 9,r=0.999 9,说明PDG在上述梯度质量浓度(3.438~20.625 μg/mL)内线性关系良好。
2.6.6 精密度试验取PDG对照品储备液,在“2.6.4”项色谱条件下连续进样5次,测定峰面积,其RSD为0.1%,说明仪器精密度较好。
2.6.7 稳定性试验取杜仲42 Hz超微粉体样品按照“2.6.1”项下的方法操作,超声40 min制得供试品溶液,取供试品溶液于0、2、4、6、8、10 h在“2.6.4”项色谱条件下进样测定峰面积,其RSD为0.4%,说明样品在10 h内具有良好的稳定性。
2.6.8 重复性试验取杜仲42 Hz超微粉体样品共6份,按照“2.6.1”项下的方法操作,超声时间40 min,制得供试品溶液,在“2.6.4”项色谱条件下测得峰面积,计算RSD为1.6%。
2.6.9 加样回收率试验取杜仲42 Hz超微粉体样品共6份,加入一定量的PDG对照品,按照“2.6.1”项下的方法操作,超声40 min,制得供试品溶液,在“2.6.4”项色谱条件下测得峰面积,计算回收率,结果显示PDG平均回收率为99.4%,其RSD为2.2%。
2.6.10 超声提取法供试品溶液测定 按照“2.6.1”项所述方法制备供试品溶液,在“2.6.4”项色谱条件下进样测定。对照品PDG和供试品的HPLC图谱见图 3。利用峰面积,由线性方程计算得到PDG的质量分数,进一步计算出相对提取率(相对提取率=ω/ωmax,其中ω为质量分数,ωmax为提取实验中的最大质量分数),见表 2。分析表 2可知在一定时间范围内超声时间越长提取率越高,但超出一定时间后超声时间越长提取率增加不明显(如42 Hz的40 min与60 min比较),并有下降趋势(如23、60 Hz的40 min与60 min比较),初步筛选超声提取的最佳超声时间为40 min;在同一提取时间内比较不同粒径的提取率可知,超微粉体的提取率大于普通粉体,说明超微粉碎有利于杜仲成分的溶出;在同一时间内比较超微粉体间的提取率可知,粒径越小提取率不一定越高,初步筛选3个不同粒径粉体中,42 Hz超微粉体的提取率较高。
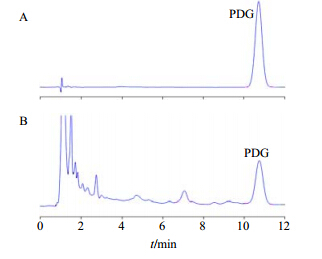 | 图 3 b>PDG对照品 (A) 和供试品 (42 Hz超微粉体超声60 min,B) 的HPLC图 Fig.3 HPLC of PDG reference substance (A) and sample (42 Hz ultrafine powder,B) |
| 表 2 杜仲不同粒径粉体超声、回流提取的比较 Table 2 Comparison on ultrasonic extraction and reflux extraction of different size powders of E. ulmoides |
按照“2.6.2”项所述方法制备供试品,在“2.6.4”项色谱条件下进样测定。利用峰面积,由线性方程计算得到PDG的质量分数,进一步计算出相对提取率,见表 2。由表 2可知,延长回流时间,提取率增加不明显;在同一提取时间内比较不同粒径的提取率可知,超微粉体的提取率大于普通粉体,进一步验证超微粉碎有利于杜仲成分的溶出。
2.7 不同溶出介质下溶出度比较 2.7.1 溶出度样品制备分别取“2.1”项下制备的杜仲普通粉体和60、42、23 Hz超微粉体各约3 g,精密称定,投入溶出仪中,按照《中国药典》2010年版二部附录溶出度浆法测定法[10],以已超声脱气的900 mL蒸馏水为溶剂,浆法,转速为100 r/min,温度为(37.0±0.5)℃,分别于5、15、30、45、60 min各取样5 mL,同时向溶出杯中补充相同温度 和体积的水,再将取出的样品溶液滤过,取续滤液过0.45 μm滤膜,得到以蒸馏水为溶出介质的供试品溶液。同样方法,按照《中国药典》2010年版一部附录项下制备人工胃液、人工肠液[11],溶出实验步骤同蒸馏水,分别得到以人工胃液、人工肠液为溶出介质的供试品溶液。
2.7.2 溶出度样品测定方法色谱条件、线性关系、精密度、稳定性、重复性、加样回收率等依据“2.6.3”~“2.6.9”项下方法进行。
2.7.3 溶出度样品测定结果取所制备上述供试品溶液,按照上述色谱条件测定。根据标准曲线方程计算各供试品中PDG的累积溶出量,以所测得PDG的最大累积溶出量为100%,其他累积溶出量与之相对比,得出各供试品中PDG的相对累积溶出率,以相对累积溶出率为纵坐标,时间为横坐标作图,绘制累积溶出度变化曲线,见图 4。
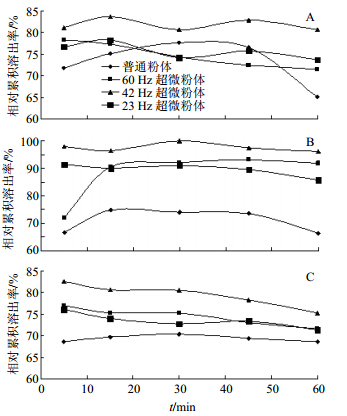 | 图 4 杜仲不同粒径粉体在人工肠液 (A)、人工胃液 (B)、蒸馏水 (C) 溶出介质中的相对累积溶出率 Fig.4 Relative cumulative dissolution rate of simulated intestinal fluid (A),simulated gastric fluid (B),and distilled water (C) of different powders of E. ulmoides |
经分析可知,以水为溶出介质时,时间延长,相对累积溶出率有下降的趋势;水溶、胃溶时,普通粉体的相对累积溶出率总是小于超微粉体的相对累积溶出率,而肠溶的规律不明显,可能受碱性条件的影响,而超微粉体间比较,并不是粒径越小相对累积溶出率越大,本实验中42 Hz超微粉体的相对累积溶出率最大,进一步说明了适度的超微粉碎是必要的。
3 讨论 3.1 超微粉体的制备气流粉碎机设备成本高、加工成本大、能耗高,而振动研磨机是由电动机、弹性联轴器、激振器、磨管等主要部件组成,结构相对复杂,操作不便。基于成本、环保、效益等多方面因素,本实验选用HM-701超微粉碎机,其主机电机和分机电机均采用了变频技术,通过设置不同风机频率得到不同粒径粉体。制备粉体时,设置超微粉碎机相关参数(主机频率、风机频率)和粉碎机部件状态(进样调节器、研轮调节器、出料阀门)进行粉碎。在粉碎过程中粉体的粒径主要受风速的影响,而风速主要由风机频率控制,故在实验中主要通过调节风机频率来制备不同粒径的粉体。实验中为探究不同粒径粉体特性而设置了高、中、低3个不同风机频率60、42、23 Hz进行实验,得到的3个超微粉体粒径具有代表性,其显微特性差异显著。
3.2 色谱条件及测定成分的选择关于杜仲中PDG定量测定的色谱条件文献报道不一[12, 13],本实验在借鉴《中国药典》2010年版中的色谱条件[流动相为甲醇-水溶液(25∶75),检测波长277 nm]的基础上,将检测波长改为228 nm,实验结果表明在此条件下峰形对称性较高,无拖尾现象,重要的是在分析人工胃液、人工肠液制得的供试品时也取得了较好的效果。
杜仲皮含有多种活性成分,其中PDG为其主要的降压成分。《中国药典》2010年版规定杜仲按干燥品计算,含PDG不得少于0.10%。因此本实验通过测定PDG的提取率和溶出度来比较不同粉体之间其量的差异。
3.3 不同溶出介质的选择由于药物在人体内的吸收有着极其复杂的情况,为了探究杜仲在人体内外的溶出情况,本实验按照《中国药典》2010年版第二部溶出度测定法桨法模拟蒸馏水、人工胃液和人工肠液,通过设置5个不同的取样点,测定其有效成分的溶出情况,进而比较其在人体内的溶出情况。实验结果显示:从溶出量来看,不论是在水、胃液还是肠液中溶出,都是42 Hz的溶出量最多;从溶出介质来看,在胃液的累积溶出速率最大,说明该成分在胃中更有利于吸收。
综合上述内容可知,中药在超微粉碎过程中,并不是越细越好,而应控制在一定的范围内,这可能是因为一方面超微粉体比表面积大、表面能增加,使颗粒处于非稳定状态,因而有强烈的相互吸引而达到稳定的趋向。这种倾向使粒子产生团聚而影响其溶出效果。另一方面粉末在溶出过程中存在溶出与吸附平衡,微粉溶出虽然稍多,但药材超微粉碎粒度过小,药材表面积急剧增大而使其表面能增加,药物粉体对极性成分的吸附力增大,从而使其不易溶出[14, 15]。对于植物类中药,由于不同中药有不同的组织结构,所以超微粉体细胞破壁的粒度不同,呈现出不同的显微特征,因此对不同中药的超微粉碎都要适度。
| [1] | 朱华明, 付廷明, 郭立玮, 等. 水蛭的湿法超微粉碎提取及其工艺优化 [J]. 中草药, 2013, 44(15): 2079-2084. |
| [2] | 谢瑞红, 王顺喜, 谢建新, 等. 超微粉碎技术的应用现状及发展趋势 [J]. 中国粉体技术, 2009, 15(3): 64-67. |
| [3] | 罗刚, 陈立庭, 周晶. 超微粉碎技术在中药研究中的应用 [J]. 现代药物与临床, 2011, 26(2): 108-112. |
| [4] | 夏宁, 孙莉, 范久波, 等. 中药超微粉应用中面临的问题及对策 [J]. 检验医学与临床, 2014, 11(23): 3359-3363. |
| [5] | 王志宏, 彭胜, 雷明盛. 杜仲主要生物活性研究进展 [J]. 天然产物研究与开发, 2013, 25(9): 1302-1309. |
| [6] | 邬晓臣, 欧阳辉, 张近宝, 等. 杜仲多糖对兔心肌缺血再灌注损伤的保护作用 [J]. 药物评价研究, 2014, 37(1): 34-36. |
| [7] | 李雅, 蔡光先, 杨永华, 等. 杜仲微粉细胞破壁率的测定 [J]. 中成药, 2009, 31(10): 1634-1636. |
| [8] | 苏瑞强, 何煜, 王瑞成. 超微粉碎技术提高六味地黄丸 (水蜜丸) 溶出度的研究 [J]. 中国中药杂志, 2002, 27(7): 511-513. |
| [9] | 董玉秀, 宋珍鹏, 崔素娟. 对休止角测定方法的讨论 [J]. 中国药科大学学报, 2008, 39(4): 317-320. |
| [10] | 中国药典 [S]. 二部. 2010. |
| [11] | 中国药典 [S]. 一部. 2010. |
| [12] | 张倩茹, 肖清, 赵洺, 等. HPLC法测定杜仲及其相关制剂中松脂醇二葡萄糖苷的含量 [J]. 遵义医学院学报, 2009, 32(4): 338-340. |
| [13] | 王丽楠, 杨美华. HPLC法测定不同生长年限杜仲皮中松脂醇二葡萄糖苷 [J]. 中草药, 2009, 40(4): 651-653. |
| [14] | Garcia F, Le Bolay N, Frances C. Rheological behavior and related granulometric properties of dense aggregated suspensions during an ultrafine comminution process [J]. Powder Technol, 2003, 130(1/3): 407-414. |
| [15] | Zhao X Y, Du F L, Zhu Q J, et al. Effect of superfine pulverization on properties of Astragalus membranaceus powder [J]. Powder Technol, 2010, 203(3): 620-625. |
 2015, Vol. 46
2015, Vol. 46


