2. 中国医药工业研究总院 上海医药工业研究院 化学制药新技术中心, 上海 200437;
3. 爱茉莉太平洋(上海)研发有限公司, 上海 201801
2. Novel Technology Center of Pharmaceutical Chemistry, Shanghai Institute of Pharmaceutical Industry, China State Institute of Pharmaceutical Industry, Shanghai 200437, China;
3. Amorepacific Shanghai R & I Center, Shanghai 201801, China
槲寄生Visci Herba为桑寄生科(Loranthaceae)槲寄生属Viscum L. 植物Viscum coloratum (Komar.) Nakai的干燥带叶茎枝。槲寄生属植物常寄生于梨树、榆树、杨树、山楂树等植物,在我国主要分布于黑龙江、吉林、辽宁、河北、山东、安徽、江苏等省[1]。《中国药典》2010年版记载槲寄生味苦,性平,其具有祛风湿、补肝肾、强筋骨、安胎元等功效,用于治疗风湿痹痛、腰膝酸软、胎动不安等疾病[2]。为开发利用天然资源,国内外学者对槲寄生属植物进行了大量的研究。本文对有关槲寄生属植物的文献资料进行系统整理,全面综述其化学成分和药理活性研究进展,为相关的中药研究、开发和利用提供参考。
1 化学成分目前,槲寄生属植物中已经发现的化学成分主要包括黄酮类、三萜类、苯丙素类及其苷,其次还有糖类、挥发油等成分,各类型化合物见表 1。
|
|
表 1 槲寄生属植物中的化学成分) Table 1 Chemical constituents from plants of Visci L. |
从槲寄生属植物中分出36个黄酮类化合物,包括鼠李秦素(23)、鼠李秦素-3-O-β-D-葡萄糖(24)、鼠李秦素-3-O-β-D-芹糖基 (6″-β-羟基-β-甲基戊二酸半酯)-葡萄糖苷(槲寄生新苷VII)(25)、鼠李秦素-3-O-β-D-(6″-β-羟基-β-甲基戊二酸酯) 葡萄糖苷(槲寄生新苷IV)(26)、鼠李秦素-3-O-β-D-(6″-乙酰)-葡萄糖苷(槲寄生新苷II)(27)、异鼠李秦素- 7-O-β-D-葡萄糖苷(28)等,结构式见图 1~4。
 | 图 1 槲寄生属植物中二氢黄酮类化合物的骨架 Fig. 1 Structural skeletons of flavonoidsfrom plants of Visci L. |
 | 图 2 槲寄生属植物中黄酮类化合物的骨架 Fig. 2 Skeletons of flavonoids from plants of Visci L. |
 | 图 3 槲寄生属植物中查耳酮类化合物的骨架 Fig. 3 Skeletons of chalcone from plants of Visci L. |
 | 图 4 槲寄生属植物中色原酮类化合物的骨架 Fig. 4 Skeletons of chromone from plants of Visci L. |
从槲寄生属植物中分出的三萜类化合物有常春藤皂苷元(43)、丝石竹酸(44)、马斯里酸(48)、β-香树脂醇(52)、羽扇豆醇(58)等25个三萜类化合物,结构式见图 5。
 | 图 5 槲寄生属植物中三萜类化合物的骨架 Fig. 5 Skeletons of triterpenoids from plants of Visci L. |
目前已发现丁香脂素(67)、(+)-丁香脂素(68)、紫丁香苷(72)、丁香苷(73)等12个苯丙素类化合物,结构式见图 6。
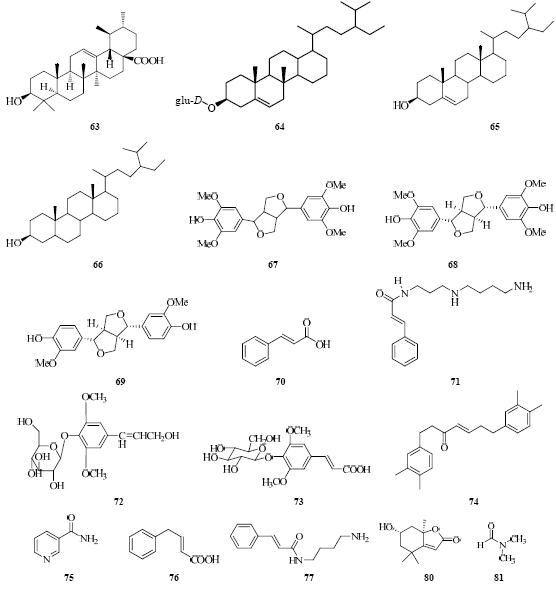 | 图 6 槲寄生属植物中苯丙素类和其他类化合物 Fig. 6 Skeletons of phenylpropanoids and others from plants of Visci L. |
槲寄生属植物中已经发现的挥发油有苯甲醛、芳樟醇、柠檬烯、1-薄荷醇等。
1.5 糖类大量研究发现,槲寄生属植物中还含有高度酯化半乳糖聚合物、中性多糖、酸性多糖、阿拉伯糖、半乳糖、葡萄糖、鼠李糖、糖醛酸、木糖和甘露糖等。
1.6 其他化合物除了上述化合物外,槲寄生属植物中还含有尼克酰胺、β-榄香精棕榈酸酯、β-榄香精、五加苷、浙贝素、肉桂酸等化合物,部分结构式见图 6。
2 药理活性 2.1 抗肿瘤作用Pryme等[23]研究了槲寄生凝集素对雌性非霍奇金淋巴瘤小鼠的影响,对照组小鼠的饮食为乳清蛋白,实验组小鼠分别每天给予2.5、5、10 mg的槲寄生凝集素。在最高每日给予10 mg槲寄生凝集素的情况下,肿瘤核裂分能力下降了75%,细胞核区减少了21%。同时实验组小鼠体内肿瘤淋巴细胞渗透(CD3阳性细胞)的总体水平提高了2倍。形态学研究表明,实验组小鼠的非霍奇金淋巴瘤中有较多的凋亡小体。在给予槲寄生凝集素11 d后,27%的小鼠肿瘤消失。结果表明口服槲寄生凝集素具有明显的抗肿瘤活性。
其他研究发现,白果槲寄生对肿瘤血管生成以及造血、非造血肿瘤细胞的转移具有抑制作用[24],槲寄生提取液还具有抗乳腺癌[25]、肝癌[26]、胰腺癌[27]、皮肤鳞状细胞癌[28]等作用。Braun等[29] 研究了寄生于枞树(ME-A)和松树(ME-P)的槲寄生水提物对实验性肿瘤转移的影响,还利用RAW 117H10淋巴肉瘤细胞和L-1肉瘤细胞,在BALB/c小鼠体内复制了肝癌和肺癌模型,在接种第14天的时候观察发现ME-A和ME-P能够显著性降低小鼠体内实验性肝肿瘤和肺肿瘤的转移。
2.2 降血糖和调血脂作用Abdel-Sattar等[30]利用链脲霉素诱发糖尿病大鼠模型,糖尿病大鼠进行口服葡萄糖耐量实验,在研究槲寄生提取物抗高血糖作用的同时也研究了槲寄生提取物对糖尿病大鼠血浆胰岛素水平及肌肉和肝脏糖原量的影响;另外通过测定三酰甘油、总胆固醇、高密度和低密度脂蛋白胆固醇水平,来研究槲寄生提取物的调血脂作用。同龄糖尿病雄性Wistar大鼠每天ig槲寄生甲醇提取物(500 mg/kg),持续4周。第7、14、21、28天测定空腹血糖水平,血浆胰岛素水平在第28天结束时测定。研究发现,在第4周血糖水平下降最多(37%),此外血浆胰岛素水平也有显著性增加(321.6%)。三酰甘油、总胆固醇、低密度和高密度脂蛋白分别下降32.6%、32.2%、27.2%、171.5%。以上研 究证明,槲寄生既具有降血糖作用又具有调血脂作用。
2.3 对心血管系统的作用 2.3.1 降压作用Rodríguez-Cruz等[31]研究了槲寄生乙醇粗提物对灌注大鼠主动脉环(有功能内皮细胞、无功能内皮细胞)血管舒缩反应的影响。在有无L-NAME和消炎痛的情况下,该提取物对这2种主动脉环均无影响。在苯肾上腺素预收缩时,低质量浓度的槲寄生提取物(300 μg/mL)可以使2种主动脉环产生轻微紧张,而增加的张力稍比在未受损内皮细胞的动脉环压力大一些。槲寄生提取物在高质量浓度时(400~800 μg/mL)可以剂量依赖性地舒张苯肾上腺素引起的主动脉收缩,而L-NAME能够消除这种舒张作用,但是当连续给予L-NAME时,该提取物反而会使主动脉环出现明显的收缩,消炎痛不能消除该提取的舒张作用。这表明,槲寄生乙醇提取物主要是诱导内皮依赖性的舒张作用,而这种作用似乎是通过NO的合成和释放来调节的。
吴继雄等[32]给予犬和兔iv槲寄生乙醇提取物,降压作用可维持3 min,ip降压作用延长到1 h,证明槲寄生乙醇提取物有显著的降压作用。
2.3.2 抗心律失常一系列研究表明槲寄生提取物具有抗心律失常的作用,但其对不同原因引起的心律失常作用差异显著,研究表明其对心肌梗死引起的心律失常作用最为显著,有效率达到75%,但是其作用机制的多方面的。
吴继雄等[32]用玻璃电极术及选择性膜通道阻滞剂观察槲寄生黄酮苷对离体狗心脏浦氏细胞及豚鼠心室肌细胞快反应动作电位的影响,结果表明槲寄生加速心肌细胞快反应动作电位(FAP)复极进程,使有效不应期(ΔERP)/动作电位时程(ΔAPD)值增加,该作用与减少慢内向离子流及增加时间依赖性钾离子流有关,提示槲寄生抗快速心律失常主要与其相对延长ERP消除折反有关,这可能是槲寄生抗快速心律失常的重要机制。研究表明,槲寄生黄酮苷对大鼠心律失常有一定的拮抗作用[21]。槲寄生可能通过阻断β受体来提高小鼠耐缺氧能力和对抗异丙基肾上腺激素的作用,从而达到抗室颤作用[21]。
2.4 对血液流变学的影响Ofem等[33]研究了白果槲寄生对高食盐小鼠体内红细胞、细胞容积比、血红蛋白数量、绝对血液学价值 [平均红细胞容积(MCV)、平均血红蛋白量(MCH)、平均血红蛋白浓度(MCHC)、比色指数(CI)]、血浆蛋白质和血沉(ESR)的影响。将24只患有白化病的雄性Wistar鼠分为4个组,每组6只,第1组(对照组)给予正常食物和饮水;第2组在第1组的基础上每天再ig给予槲寄生提取物(150 mg/kg);第3组给予高含盐量(8% NaCl)的食物和含1% NaCl的水;第4组在第3组的基础上再每天ig槲寄生提取物(150 mg/kg)。6周后观察发现对照组红细胞数量、红细胞压缩体积、血红蛋白平均水平分别为(5.21±0.09)×106/mm3、(43.50±1.61)%、(10.88±0.21)g/dL。槲寄生提取物能够显著地减少高食盐组大鼠体内红细胞数量 [(5.72±0 .09)×106/mm3]、红细胞压缩体积 [(54.50±2.64)%]、血红蛋白 [(14.33±5.78)g/dL] 到对照组水平。槲寄生提取物也使得高食盐组大鼠总血浆蛋白水平和低血沉 [(86.77±1.08)g/L、(1.83±0.31)mm/h] 恢复到对照组水平 [(82.23±0.91)g/L、(2.83±0.31)mm/h]。表明槲寄生提取物可以预防血液黏度显著地改变。槲寄生提取物和盐负荷不会明显地改变小鼠MCV、MCH、MCHC、CI水平。
2.5 免疫调节作用Lee等[34]通过体外观察免疫细胞的增殖、NK细胞和巨噬细胞介导的细胞毒性,以及强迫游泳实验和冷应激实验来研究槲寄生凝集素的免疫调节作用。在分裂素诱导的小鼠脾淋巴细胞增殖实验中,伴刀豆球蛋白A和脂多糖分别可以显著增加T细胞和B细胞的增殖。研究发现槲寄生凝集素可以促进淋巴细胞的增殖,同时还可以增强NK细胞和巨噬细胞的活性,并能够促进巨噬细胞分泌白细胞介素- 1(IL-1)和IL-6等细胞因子。使用槲寄生凝集素(30、100、300、600 μg/kg)干预2周后,淋巴细胞、单核细胞、巨噬细胞均有所增加。在强迫游泳实验中,300、600 μg/kg槲寄生凝集素干预组小鼠,不动时间显著缩短。在冷应激实验中,与对照组小鼠相比,槲寄生凝集素干预组小鼠脾脏和胸腺质量有所增加,而肾上腺的质量有所减轻。槲寄生凝集素还可以使小鼠血清转氨酶、乳酸脱氢酶、碱性磷酸酶水平有所下降。槲寄生凝集素也可以提高胸腺中CD4+和CD8+细胞的百分比。以上结果表明槲寄生凝集素通过调节淋巴细胞、NK细胞和巨噬细胞来提高机体免疫力。
Braun等[29]利用BALB/c小鼠观察了寄生于枞树和松树的槲寄生水提物的免疫调节作用。定期对荷瘤小鼠皮下和腹膜注射槲寄生水提物,能够上调胸腺质量和周边血液白血球数量。
2.6 抗微生物作用槲寄生在非洲尼日利亚部落的豪萨族和富拉尼族常用于治疗人类和动物的疾病,包括胃疼、腹泻、痢疾、创伤和癌症等。Deeni等[35]研究发现,14种宿主不同的槲寄生对某些多重耐药细菌和真菌有着广谱的抗菌活性。植物化学研究发现非洲槲寄生一般都含有蒽醌类、皂苷类、鞣酸,而生物碱和鞣质类却很少。但非洲槲寄生的抗菌活性及化学成分均与其宿主植物有关。
2.7 其他作用韩国槲寄生不仅可通过调节蛋白激酶信号来促进滋养层细胞的增殖和侵入[36],而且还能够激活Toll样受体4(TLR4)信号通路,促进巨噬细胞分泌肿瘤坏死因子-α(TNF-α)[37]和树突状细胞的成熟[38]。在无叶槲寄生中得到的问荆色苷-D具有转录抑制作用,缺乏糖结合活性,但是具有很高的细胞毒性,这一发现为解释核糖体失活蛋白家族的细胞毒性提供了新的观点[39]。
3 结语通过整理槲寄生属植物国内外有关其化学成分和药理活性的研究文献,发现槲寄生属植物有着悠久的民间药用历史,随着对其化学成分和药理活性研究的不断深入,逐步阐明了其药效物质基础和药理作用机制。目前从槲寄生属植物中分离得到的化学成分种类有黄酮类、三萜类、甾体类和苯丙素类,以及一些其他成分如糖类、挥发油等。其中黄酮类化合物具有抗氧化活性、抗心律失常作用,而且对不同原因引起的心律失常作用明显不同,但是其作用机制尚不明确。今后还应对其特色药理作用机制进行深入研究,为开发新的、强效的天然药物提供科学依据。
| [1] | 赵晶, 贺江萍. 槲寄生的化学成分及药理作用研究 [J]. 天津中医学院学报, 2005, 24(3): 185-186. |
| [2] | 中国药典 [S]. 一部. 2010. |
| [3] | 吕彦礼, 洪宝云, 黄聪龙. 槲寄生之活性成分研究 [A] // 海峡两岸中西医结合学术研讨会论文集 [C]. 厦门: 中国中西医结合学会, 2003. |
| [4] | 陶明煊, 吴国荣. 槲寄生的研究与开发利用 [J]. 中国野生植资源, 2001, 20(6): 14-15. |
| [5] | 陈柏年. 槲寄生化学成分的研究 [D]. 太原: 山西医科大学, 2007. |
| [6] | 王俊, 王国基, 彦辉, 等. 槲寄生的化学成分及药理作用研究进展 [J]. 时珍国医国药, 2005, 16(4): 300-303. |
| [7] | 王晓林, 李良琼, 李美蓉. 偏枝槲寄生化学成分研究 [J]. 华西药学杂志, 1995, 10(1): 1-3. |
| [8] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研究- III. 槲寄生新甙III的结构 [J]. 药学学报, 1988, 23(8): 593-600. |
| [9] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研究- VI. 槲寄生新甙VI的结构 [J]. 药学学报, 1990, 25(5): 349-352. |
| [10] | 朱海燕, 余正文, 杨小生, 等. 绿茎槲寄生的化学成分及其促PC12细胞的分化作用 [J]. 中国中药杂志, 2006, 31(16): 1340-1342. |
| [11] | 杨燕军, 林洁红, 许雄伟. 枫香槲寄生化学成分的分离与结构鉴定 [J]. 药学学报, 2005, 40(4): 351-354. |
| [12] | 孔德云, 李惠庭, 罗思齐. 槲寄生化学成分的研究-VII. 槲寄生新甙VII的分离和结构 [J]. 药学学报, 1990, 25(8): 608-611. |
| [13] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研究- IV. 槲寄生新甙IV的结构 [J]. 药学学报, 1988, 23(9): 707-710. |
| [14] | 孔德云, 罗思齐, 李惠庭, 等. 槲寄生化学成分的研II [J]. 上海医药工业杂志, 1987, 18(10): 445-447. |
| [15] | 曾广方, 陈仲良. 国药中黄酮类的研究 (vi) 桑寄生化学成分的研究 (第二报) 广寄生中槲寄生及其配糖体的分离 [J]. 药学学报, 1957, 5(4): 317-321. |
| [16] | 孙永慧, 凌勇, 任美容, 等. 红果槲寄生化学成分研究 [J]. 中草药, 2010, 41(9): 1418-1420. |
| [17] | 杨燕军. 枫香槲寄生化学成分的研究 [J]. 中药材, 1998, 21(1): 22-23. |
| [18] | 杨燕军, 陈梅果, 沙聪威. 飘香槲寄生三萜及三萜皂苷类成分研究 [J]. 中国中药杂志, 2011, 36(2): 162-165. |
| [19] | 杨燕军, 沙聪威, 陈梅果. 榴果槲寄生化学成分的研究 (II) [J]. 中国药学杂志, 2011, 46(1): 11-13. |
| [20] | 孙艳秋, 刘珂, 王守愚, 等. 槲寄生的研究进展 [J]. 中草药, 2000, 31(6): 471-474 . |
| [21] | 张水仙, 刘越, 孙洪波, 等. 槲寄生化学成分及药理作用研究进展 [J]. 中药材, 2012, 34(12): 1962-1967. |
| [22] | 孔德云, 李惠庭, 罗思齐. 槲寄生化学成分的研究 [J]. 药学学报, 1992, 27(10): 792-795. |
| [23] | Pryme I F, Bardocz S, Pusztai A, et al. A mistletoe lectin (ML-1)-containing diet reduces the viability of a murine non-Hodgkin lymphoma tumor [J]. Cancer Detect Prev, 2004, 28(1): 52-56. |
| [24] | Yoon T J, Yoo Y C, Choi O B, et al. Inhibitory effect of Korean mistletoe (Viscum album coloratum) extract on tumour angiogenesis and metastasis of haematogenous and non-haematogenous tumour cells in mice [J]. Cancer Lett, 1995, 97(1): 83-91. |
| [25] | Eisenbraun J, Scheer R, Kröz M, et al. Quality of life in breast cancer patients during chemotherapy and concurrent therapy with a mistletoe extract [J]. Phytomedicine, 2011, 18(2): 151-157. |
| [26] | Al-Gayyar M M H, Ebrahim M A, Shams M E E. Measuring serum levels of glycosaminoglycans for prediction and using viscum fraxini-2 for treatment of patients with hepatocellular carcinoma [J]. J Pharm Res, 2013, 7(7): 571-575. |
| [27] | Tröger W, Galun D, Reif M, et al. Viscum album [L.] extract therapy in patients with locally advanced or metastatic pancreatic cancer: A randomised clinical trial on overall survival [J]. Eur J Cancer, 2013, 49(18): 3788-3797. |
| [28] | Werthmann P G, Sträter G, Friesland H, et al. Durable response of cutaneous squamous cell carcinoma following high-dose peri-lesional injections of Viscum album extracts-A case report [J]. Phytomedicine, 2013, 20(3): 324-327. |
| [29] | Braun J M, Ko H L, Schierholz J M, et al. Application of standardized mistletoe extracts augment immune response and down regulates metastatic organ colonization in murine models [J]. Cancer Lett, 2001, 170(1): 25-31. |
| [30] | Abdel-Sattar E A, Elberry A A, Harraz F M, et al. Antihyperglycemic and hypolipidaemic effects of the methanolic extract of Saudi mistletoe (Viscum schimperi Engl.) [J]. J Adv Res, 2011, 2(2): 171-177. |
| [31] | Rodríguez-Cruz M E, Pérez-Ordaz L, Serrato-Barajas B E, et al. Endothelium-dependent effects of the ethanolic extract of the mistletoe Psittacanthus calyculatus on the vasomotor responses of rat aortic rings [J]. J Ethnopharmcol, 2003, 86(2): 213-218. |
| [32] | 吴继雄, 余国瑞, 王彬尧. 槲寄生黄酮苷对心脏快反应动作电位的效应 [J]. 中国医药工业杂志, 1993, 24(10): 457-460. |
| [33] | Ofem O E, Eno A E, Nku C O, et al. Viscum album (mistletoe) extract prevents changes in levels of red blood cells, PCV, Hb, serum proteins and ESR in high salt-fed rats [J]. J Ethnopharmcol, 2009, 126(3): 421-426. |
| [34] | Lee C H, Kim J K, Kim H Y, et al. Immunomodulating effects of Korean mistletoe lectin in vitro and in vivo [J]. Int Immunopharmacol, 2009, 9(13): 1555-1561. |
| [35] | Deeni Y Y, Sadiq N M. Antimicrobial properties and phytochemical constituents of the leaves of African mistletoe (Tapinanthus dodoneifolius (DC) Danser) (Loranthaceae): an ethnomedicinal plant of Hausaland, Northern Nigeria [J]. J Ethnopharmacol, 2002, 83(3): 235-240. |
| [36] | Lyu S Y, Choi J H, Lee H J, et al. Korean mistletoe lectin promotes proliferation and invasion of trophoblast cells through regulation of Akt signaling [J]. Reprod Toxicol, 2013, 39: 33-39. |
| [37] | Park H J, Hong J, Kwon H J, et al. TLR4-mediated activation of mouse macrophages by Korean mistletoe lectin-C (KML-C) [J]. Biochem Biophys Res Commun, 2010, 396(3): 721-725. |
| [38] | Kim J J, Hwang Y H, Kang K Y, et al. Enhanced dendritic cell maturation by the B-chain of Korean mistletoe lectin (KML-B), a novel TLR4 agonist [J]. Int Immuno- pharmacol, 2014, doi: 10.1016/j.intimp.2014.05.010. |
| [39] | Das M K, Sharma R S, Mishra V. A cytotoxic type-2 ribosome inactivating protein (from leafless mistletoe) lacking sugar binding activity [J]. Int J Biol Macromol, 2011, 49(5): 1096-1103. |
 2015, Vol. 46
2015, Vol. 46


